缺镁胁迫对纽荷尔脐橙叶绿素荧光特性的影响
凌丽俐,彭良志,*,王男麒,邢 飞,江才伦,曹 立,淳长品
(1.中国农业科学院柑桔研究所/国家柑桔工程技术研究中心,重庆 400712;2.西南大学园林园艺学院,重庆 400712)
脐橙是当今我国栽培规模最大的甜橙品种,中国已成为世界最大的纽荷尔脐橙产地。但是,随着N、P、K化肥用量的增加和有机肥用量的减少,纽荷尔脐橙叶片缺镁黄化现象在赣南-湘南-桂北柑桔优势产区普遍存在,而且呈逐年加重趋势,已成为南方地区阻碍柑桔产量和品质提高的重要因素之一[1]。镁是植物生长的必需元素之一,不仅对维持叶绿体结构有重要作用,而且在多种酶活化、作物产量提高和作物品质改善等方面也发挥着重要作用[2-3]。目前,缺镁胁迫对植物光合生理影响的研究主要集中在龙眼[4]、青枣[5]、菜薹[6]、水稻[7]等方面,研究表明缺镁会导致叶片光合色素含量、光合参数(净光合速率、光饱和点和CO2饱和点)、Chl a荧光动力学参数(Fv/Fo、Fv/Fm、ΔFv/Fm和Fd/Fs)的降低。目前,缺镁胁迫对纽荷尔脐橙叶片(特别是不同叶龄叶片)光合荧光特性的影响研究尚未见报道,不利于缺镁黄化植株叶面平衡施肥矫治技术的建立。本文研究了不同缺镁胁迫条件下纽荷尔脐橙不同叶龄叶片的叶绿素合成与荧光特性变化,以期为纽荷尔脐橙的高产优质生产提供理论指导和相关依据。
1 材料与方法
1.1 实验材料
试验于重庆市北碚区歇马镇中国农业科学院柑桔研究所脐橙课题盆栽场内进行。供试品种为1年生枳[Poncirus trifoliate(L.)]砧纽荷尔脐橙(Citrus sinensis Osbeck‘Newhall’)。选取砧木直径约1.5 cm、高度约35 cm生长良好的嫁接苗,将植株地上部剪至25 cm左右,留有5片2010年秋梢叶片,主根剪至5 cm左右。2011年3月23日定植进行盆栽砂培试验,每盆一株,加体积1∶1的石英砂与珍珠岩8 kg,盆底放托盘。前期仅供应去离子水进行炼苗。
1.2 实验设计
春梢萌发初期(4月15日)用Hoagland(1/2浓度)和Aron全浓度配方进行镁梯度营养液胁迫处理。完全营养液配方为:Ca(NO3)2·4H2O 4 mmol/L,KNO36 mmol/L,NH4H2PO41 mmol/L,MgSO4·7H2O 2 mmol/L,H3BO346 μmol/L,MnCl2·4H2O 6 μmol/L,ZnSO4·7H2O 0.7 μmol/L,CuSO4·5H2O 0.3 μmol/L,H2MoO41 μmol/L,Fe-EDTA 50 μmol/L,pH 值 6.0。试验设3 个镁水平,即无镁(0 mmol/L,DM)、低镁(0.1 mmol/L,LM)和正常供镁(1 mmol/L,CK),每个水平处理15盆,共45盆。其中DM和LM为了维持离子浓度的平衡和避免硫元素的缺乏以添加Na2SO4替代MgSO4·7H2O。实验期间,每2 d各实验盆补浇500 mL营养液,每7 d用去离子水洗盐1次,防止盐分累积。2个月后测定植株老叶(2010年秋梢叶片)及新叶((2011年春梢叶片))不同叶位叶片的相对叶绿素含量和Fv/Fm值,并分别测定倒数第一位老叶和新叶的快速光响应曲线。
1.3 相对叶绿素含量测定
相对叶绿素含量(SPAD)测定采用SPAD-502叶绿素测定仪(日本Konica公司)进行,于8:30—10:30在每个叶片主脉两侧中部从叶尖到叶基部均等测6个点,取其平均值,每次测定前用标准色板校正仪器基准数值[8]。测定时避开叶脉。每株测定顺序为由下至上依次测定老叶5片(A1、A2、A3、A4和A5),新叶4片(S1、S2、S3 和 S4)。
1.4 叶绿素荧光特征测定
PSⅡ原初光能转化效率(Fv/Fm)测定:叶绿素荧光采用PAM-2500调制叶绿素荧光仪(德国WALZ公司)测定。测定于6:00—8:00点进行,每株从下至上依次测定A1、A2、A3、A4和A5,再依次测定 S1、S2、S3和S4。叶片暗适应20 min后,开启检测光(0.15 μmol m-2s-1)得到叶绿素荧光参数初始荧光(Fo),再由饱和脉冲光(4000 μmol m-2s-1,0.8 s)测得最大荧光(Fm)。根据 Fo和 Fm,计算 Fv/Fm:

快速光响应曲线测定:每个水平处理选择5株测定A1和S1叶片的快速光响应曲线。连体叶片经暗适应10 s后,迅速打开叶夹,测得 Fo和 Fm;随后,逐渐开启光强度分别为 53、93、134、178、237、408、660、820、999、1177、1387、1648 μmol m-2s-1的光化光,每个强度的光化光照射 10 s后,经检测光和饱和脉冲光测得 Ft、Fm',计算得到叶绿素荧光特征参数值,分别取平均值绘出快速光响应曲线[9];随后用PamWin-3软件依据Platt等的公式(2)对快速光响应曲线进行拟合[10],得到快速光响应曲线的最大相对电子传递速率(rETRmax)和半饱和光强(Ik)。通过测定的叶绿素荧光参数计算出有效荧光产量ΔFv/Fm、光化学淬灭系数qP、非光化学淬灭系数qN和相对光合电子传递速率rETR[9],公式如下:
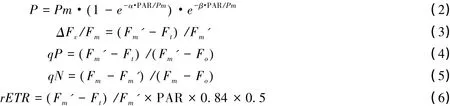
1.5 数据处理
采用SPSS13.0软件对实验数据进行处理和分析。缺镁胁迫对植株相对叶绿素含量及荧光参数的影响采用单因素方差分析完成(one-way ANOVA)。用LSD法判断各处理组植株的差异显著性,用独立样本t测试(Independent-Samples T test)检验各处理组植株与对照组植株间的差异。文中的图表由Microsoft Excel软件制作完成。
2 结果与分析
2.1 相对叶绿素含量的变化
由图1可知,随着叶位的升高老叶相对叶绿素含量呈增加趋势;且随着供镁浓度的降低老叶相对叶绿素含量呈降低趋势。与对照相较,低镁处理组A1、A2、A3、A4和A5的SPAD值分别降低了5.9%、1.2%、0.1%、0.8%和0.6%,差异不显著(P>0.05);而无镁处理组的SPAD值分别降低了10.7%(P<0.05)、1.8%(P>0.05)、0.9%(P>0.05)、5.2%(P<0.05)和4.2%(P<0.05)。
由图1还可知,随着供镁浓度的降低新叶相对叶绿素含量呈降低趋势。与对照相较,低镁处理组S1、S2、S3和S4的SPAD值分别下降了4.6%、1.6%、4.4%和0.4%,差异不显著(P>0.05);而无镁处理组的SPAD值分别下降了5.5%(P<0.05)、4.8%(P<0.05)、5.4%(P<0.05)和3.6%(P>0.05)。

图1 缺镁对纽荷尔脐橙不同叶位叶片相对叶绿素含量的影响Fig.1 The effect of Mg deficiency on relative chlorophyll content in leaves at different leaf position of Newhall navel orange
2.2 Fv/Fm的变化
Fv/Fm反映了当所有的光系统Ⅱ(PSⅡ)反应中心均处于开放态时的量子产量,可以直接作为最适状态下光合作用光化学效率的指标[11]。由图2可知,对照组不同叶位老叶的Fv/Fm差异不显著,而随着叶位的升高其余两组植株的Fv/Fm呈增加趋势(A5除外)。与对照相较,低镁组A1、A2、A3、A4和A5的Fv/Fm分别下降了3.1%(P<0.05)、0.8%(P>0.05)、1.2%(P>0.05)、1.0%(P>0.05)和 2.3%(P<0.05);而无镁组 Fv/Fm的降低幅度有所增大,分别下降了7.0%、2.8%、1.7%、1.8%和2.8%,差异显著(P<0.05)。
由图2还可知,随着供镁浓度的降低新叶的Fv/Fm呈降低趋势,但各实验组不同叶位的Fv/Fm无显著差异。与对照相比,低镁组S1、S2、S3、S4的Fv/Fm分别降低了0.7%、1.3%、1.1%和0.6%,差异不显著(P>0.05);而无镁组的Fv/Fm分别降低了1.9%、1.7%、2.0%和1.5%,差异显著(P<0.05)。
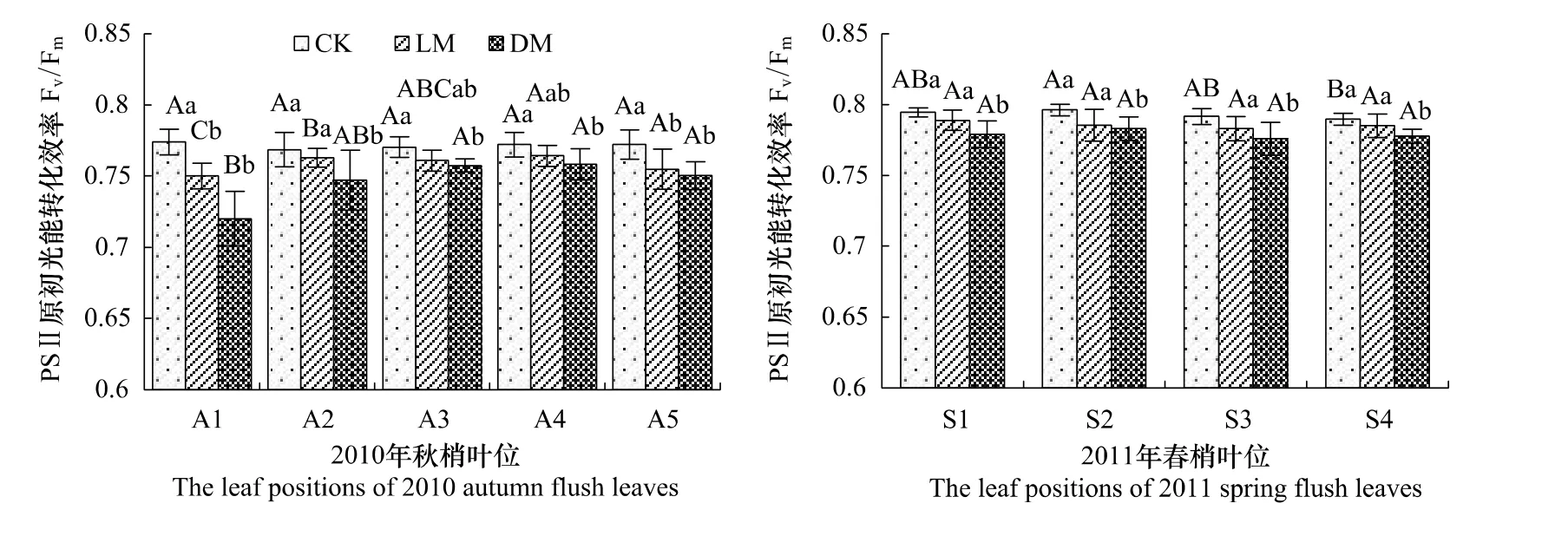
图2 缺镁对纽荷尔脐橙不同叶位叶片Fv/Fm的影响Fig.2 The effect of Mg deficiency on Fv/Fmin leaves at different leaf position of Newhall navel orange
2.3 快速光响应曲线的变化
光强-ΔFv/Fm曲线:有效荧光产量(ΔFv/Fm)是表明光化学反应状况的一个重要参数,表示在照光下PSⅡ的实际光化学效率,反映吸收的光子供给PSⅡ反应中心的效率[12]。由图3可知,随着供镁浓度降低老叶ΔFv/Fm呈降低趋势;低镁组ΔFv/Fm与对照差异不显著(P>0.05),而无镁组ΔFv/Fm与对照差异显著(P<0.05)。随着供镁浓度降低新叶ΔFv/Fm略为降低,但是差异不显著;对照组、低镁组和无镁组新叶ΔFv/Fm的平均降低幅度分别为82.6%、82.9%和83.6%。
光强-qP曲线:qP和qN描绘了能量耗散途径的相对影响。qP是PSⅡ天线色素吸收的光能用于光化学电子传递的份额,较低的qP反映PSⅡ中开放的反应中心比例和参与CO2固定的电子减少[13]。由图4可知,对于对照组、低镁组和缺镁组植株来说,无论是新叶还是老叶,其qP值无显著差异。

图3 ΔFv/Fm随光强的变化Fig.3 Change in ΔFv/Fmas a function of PAR
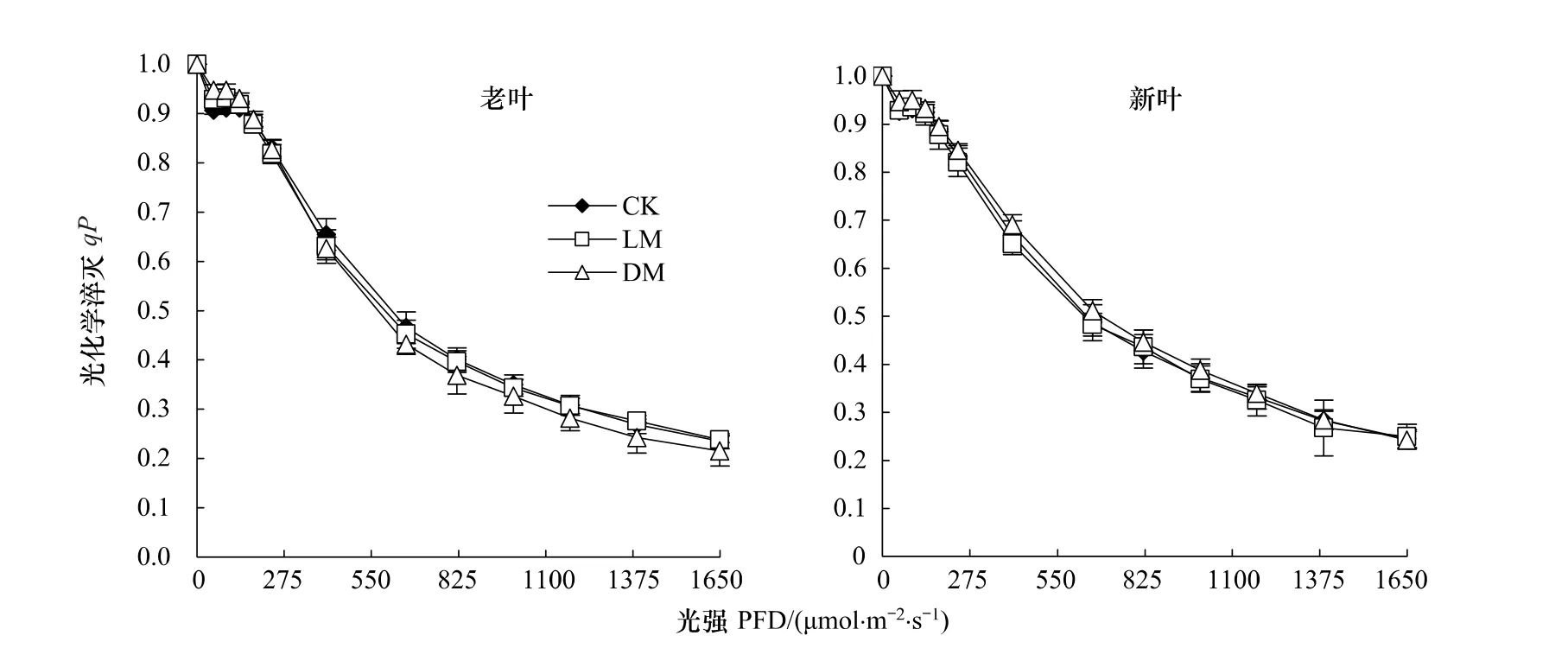
图4 光化学淬灭(qP)随光强的变化Fig.4 Change in photochemical quenching(qP)as a function of PAR
光强-qN曲线的影响:qN反映的是天线色素吸收的光能不能用于电子传递而以热等的形式耗散掉的光能部分,而热耗散是植物保护PSⅡ的重要机制[14]。由图5可知,随着供镁浓度的降低老叶和新叶的qN呈增加趋势,热耗散量增加。低镁组老叶qN与对照差异不显著,而无镁组老叶qN与对照差异显著;且它们新叶的qN与对照差异均不显著。
光强-rETR曲线的影响:PSⅡ的相对光合电子传递速率(rETR)是反映实际光强下的表观电子传递效率[12],用于度量光化学反应导致碳固定的电子传递情况[13]。由图6可知,随着供镁浓度的降低老叶相对电子传递速率呈明显的降低趋势。对照组老叶的半饱和光强、rETRmax分别为224.18 μmol m-2s-1和81.55 μmol m-2s-1,而低镁组和无镁组老叶的半饱和光强分别比对照低2.0%(P>0.05)和28.8%(P<0.01),rETRmax分别比对照低3.4%(P>0.05)和29.0%(P<0.01)。
缺镁胁迫也会导致新叶相对电子传递速率降低。对照组新叶半饱和光强及rETRmax分别为238.5 μmol m-2s-1、89.95 μmol m-2s-1,而低镁组和无镁组新叶的最小饱和光强分别比对照低 4.2% 和 2.2%,rETRmax分别比对照低4.6%和1.9%,差异均不显著(P>0.05)。

图5 非光化学淬灭(qN)随光强的变化Fig.5 Change in non-photoche-mical quenching(qN)as a function of PAR

图6 相对电子传递速率(rETR)随光强的变化Fig.6 Change in relative electron tranaport ratio(rETR)as a function of PAR
3 讨论
3.1 缺镁胁迫对纽荷尔脐橙不同叶龄叶片叶绿素合成的影响
镁是构成叶绿素的中心元素,其含量与相对叶绿素呈极显著相关关系[8]。作为活动性元素,植物组织中70%的镁是可移动的,再利用性好。28Mg示踪试验表明镁可以通过韧皮部进行运输,老叶里的镁素可以移动至新叶中[15]。植物缺镁时首先会在低位衰老叶片上表现症状[16-18]。目前,缺镁植株叶绿素含量降低的机制尚存在较大的争议[19-22]。研究表明,缺镁胁迫处理2个月后,随着叶位的升高纽荷尔脐橙植株老叶的相对叶绿素含量呈增加趋势,且最老叶片(即第1位老叶)的相对叶绿素含量显著低于其他各叶。因此,随着叶位的升高,纽荷尔脐橙低位老叶将会逐渐表现出缺镁黄化症状。农业上,植株缺镁首先是通过叶片黄化症状进行判定。研究表明,虽然缺镁胁迫导致纽荷尔脐橙植株老叶相对叶绿素含量降低,但是低镁组老叶的相对叶绿素含量与对照无显著性差异,而无镁组老叶的相对叶绿素含量与对照差异显著。表明只有在完全缺镁胁迫条件下短期胁迫(2个月)才会导致老叶叶绿素合成显著受阻,否则,即使在严重缺镁胁迫条件下柑橘老叶(低镁组)也不会在短期内显现黄化症状。这也是通过叶片黄化诊断法不能及时发现柑橘植株缺镁的原因。
此外,与对照相较,低镁组和无镁组新叶不同叶位的相对叶绿素含量均有所降低,且后者新叶的相对叶绿素含量低于前者。表明在缺镁胁迫条件下新叶的叶绿素合成也会受阻,且随着缺镁胁迫程度的增大叶绿素合成受阻幅度增大。因此,在纽荷尔脐橙表现缺镁黄化症状前,不仅老叶,新叶也发生了叶绿素合成降低。这种“潜在”缺镁状态,也会严重影响纽荷尔脐橙的农业生产。
3.2 缺镁胁迫对纽荷尔脐橙不同叶龄叶片光合作用的影响
缺镁胁迫不仅影响植株的叶绿素合成,而且也会影响植株的光合作用。Fv/Fm不仅可以直接作为最适状态下光合作用光化学效率的指标,也是反映植物受胁迫程度的常用指标[11]。缺Mg不仅使叶片叶绿素含量降低[23],也会导致Fv/Fm降低[4,7]。将纽荷尔脐橙老叶和新叶的SPAD值分别与Fv/Fm做相关分析。由表1可知,各缺镁胁迫组老叶的SPAD值与Fv/Fm呈极显著正相关关系,而各实验组新叶的SPAD值与Fv/Fm也呈显著正相关关系。研究表明,虽然缺镁胁迫导致植株叶片Fv/Fm降低,但是低镁组老叶和新叶的Fv/Fm与对照差异不显著(P>0.05),而无镁组老叶和新叶的Fv/Fm均与对照差异显著(P<0.05)。因此,在非完全缺镁条件下短期缺镁胁迫对纽荷尔脐橙叶片的最适光化学效率无显著影响,但是在完全缺镁条件下短期缺镁即会导致老叶和新叶的最适光化学效率显著降低。

表1 纽荷尔脐橙叶片相对叶绿素与Fv/Fm的相关关系矩阵[n=25(老叶),n=20(新叶)]Table 1 The correlation matrix between relative chlorophyll content and Fv/Fmin leaves of Newhall navel orange(Citrus sinensis Osbeck)[n=25(last year autumn flush leaves),n=20(this year spring flush leaves)]
缺镁胁迫对纽荷尔脐橙叶片光合作用的影响,还主要体现在叶片对光的响应能力上。低镁组老叶和新叶的ΔFv/Fm、qP、rETR和qN与对照差异不显著,光响应能力降低不显著。而无镁组老叶的ΔFv/Fm、rETR显著降低,qN显著增大,qP降低不显著;新叶ΔFv/Fm、rETR、qP和qN与对照差异不显著,新叶光响应能力的降低幅度显著低于老叶。表明无镁组老叶光响应能力的降低与光化学效率、电子传递速率降低和热耗散量增大有关。现有的研究表明,PSⅡ光能活化、活性氧代谢与植物叶片的黄化有密切的联系[22,24-26]。缺Mg不仅使植物叶片叶绿素含量降低,而且导致光合电子传递速率下降、CO2同化受抑制而导致Fv/Fm、ΦPSⅡ等下降、净光合速率降低,进而加重叶片受到光抑制的程度[4,7]。在夏季强光照条件下叶片吸收的光能如不能完全通过光化学、非光化学和光子跃迁淬灭,过剩的光能将会导致活性氧自由基和抗氧化酶类活性增加,大量活性氧自由基如不能被抗氧化酶类及时清除掉,积累到一定程度会引起膜脂过氧化加剧而使叶绿体结构受到损伤,最终使得叶片失绿坏死,显现黄化症状[7,24]。本研究表明,缺镁胁迫不仅导致纽荷尔脐橙植株叶绿素含量降低,也导致Fv/Fm、ΔFv/Fm、qP和rETR降低;而且,缺镁胁迫对植株老叶的胁迫程度显著大于新叶,在完全缺镁条件下老叶的叶绿素含量和光响应能力均显著降低。因此,在夏季高温、高光条件下缺镁纽荷尔脐橙植株老叶易发生光抑制,甚至可能发生光氧化伤害,这可能也是夏季纽荷尔脐橙老叶黄化现象更为普遍的原因。在农业生产上,夏季对缺镁纽荷尔脐橙植株进行施肥矫治时,适当的遮荫可能会有利于降低光伤害,避免早衰现象的出现。
[1] Peng L Z,Lai J J,Chun C P,Cao L,Zhong L H,Jiang C L,Ling L L.Role of compound magnesium fertilizer in correcting leaf yellowing caused by nutrient element deficiency on navel orange in Gannan.South China Fruits,2008,37(3):10-12.
[2] Huber S C,Maury W.Effects of magnesium on intact chloroplasts.Plant Physiology,1980,65(2):350-354.
[3] Liu H C,Song S W,Lei Y,Chen R Y.Primary studies of magnesium deficiency on growth of flowering Chinese cabbage//Lei J J,ed.Advances of Horticulture(5).Guangzhou:Guangzhou Press,2002:539-542.
[4] Li Y,Liu X H,Zhuang W M.The effect of magnesium deficiency on photosynthesis of Longan(Dimocarpus long ana Lour.)seedlings.Acta Horticulturae Sinica,2001,28(2):101-106.
[5] Liang K M,Cao H L,Xu Z F,Ye W H,Liu S P,Li W J.Diurnal variations and light response of photosynthesis in three cultivars and wild type of Ziziphus mauritiana Lam.Acta Horticulturae Sinica,2008,35(6):793-798.
[6] Liu H C,Chen X M,Chen R Y,Song S W,Sun G W.Effects of magnesium deficiency on photosynthesis characteristic of flowering Chinese cabbage.Acta Horticulturae Sinica,2006,33(2):311-316.
[7] Yang Y,Jiang D A,Sun J W,Huang Z A,Jin S H.Effects of different magnesium nutrition levels on chlorophyll fluorescence characteristics and excitation energy dissipation in rice leaves.Plant Nutrition and Fertilizer Science,2005,11(1):79-86.
[8] Zhang G Y,Peng L Z,Chun C P,Zeng M,Ling L L,Lai J J,Wang Z X.Seasonal changes in leaf magnesium and boron contents and their relationships to leaf yellowing of navel orange(Citrus sinensis Osbeck).Acta Horticulturae Sinica,2010,37(8):1317-1324.
[9] Schreiber U,Gademann R,Ralph P J,Larkum A W D.Assessment of photosynthetic performance of Prochloron in Lissoclinum patella in hospite by chlorophyll fluorescence measurements.Plant and Cell Physiology,1997,38(8):945-951.
[10] Platt T,Gallegos C L,Harrison W G.Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton.Journal of Marine Research,1980,38(4):687-701.
[11] Demmig-Adams B,Adams W W Ⅲ,Barker D H,Logan B A,Bowling D R,Verhoeven A S.Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation.Physiologia Plantarum,1996,98(2):253-264.
[12] Bilger W,Björkman O.Role of the xanthophyll cycle in photoprotection elucidated by measurements of light-induced absorbance changes,fluorescence and photosynthesis in leaves of Hedera canariensis.Photosynthesis Research,1990,25(3):173-185.
[13] Genty B,Briantais J M,Baker N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence.Biochimica et Biophysica Acta,1989,990(1):87-92.
[14] Ögren E.Prediction of photoinhibition of photosynthesis from measurements of fluorescence quenching components.Planta,1991,184(4):538-544.
[15] Schimansky C.Possibilities and limitations of utilizing28Mg for studying Mg-specific problems in higher plants.Journal of Plant Nutrition,1985,8(6):467-489.
[16] Terryn N,Ulrich A.Effects of magnesium deficiency on the photosynthesis and respiration of leaves of sugar beet.Plant Physiology,1974,54(3):379-381.
[17] Rao L H.Mineral Nutrients and Diagnosis on Plants.Beijing:Agricultural Press,1993:78-82.
[18] Cao G,Liang M Z.Magnesium the essential middle element of plants in balance culture system.Soils and Fertilizers,2003,(3):1-3.
[19] Thomson W W,Weier T E.The fine structure of chloroplasts from mineral-deficient leaves of Phaseolus vulgaris.American Journal of Botany,1962,49:1047-1055.
[20] Zielinski R E,Price C A.Relative requirements for magnesium of protein and chlorophyll synthesis in Euglena gracilis.Journal of Plant Physiol,1978,61:624-625.
[21] Hermans C,Bourgis F,Faucher M,Strasser R J,Delrot S,Verbruggen N.Magnesium deficiency in sugar beets alters sugar partitioning and phloem loading in young mature leaves.Planta,2005,220:541-549.
[22] Cakmak I,Kirkby E A.Role of magnesium in carbon partitioning and alleviating photooxidative damage.Physiologia Plantarum,2008,133:692-704.
[23] Balakrishnan K,Rajendran C,Kulandaivelu G..Differential responses of iron,magnesium,and zinc deficiency on pigment composition,nutrient content,and photosynthetic activity in tropical fruit crops.Photosynthetica,2000,38(3):477-479
[24] Jiao D M,Li X,Huang X Q,Ji B H.The relationship among photoinhibition,Photooxidation and early aging at later developmental stages in different high yield varieties.Scientia Agricultura Sinica,2002,35(5):487-492.
[25] Demmig-Adams B,Adams W W.Xanthophyll cycle and light stress in nature:uniform response to excess direct sunlight among higher plant species.Planta,1996,198(3):460-470.
[26] Cakmak I,Hengeler C,Marschner H.Partitioning of shoot and root dry matter and carbohydrates in bean plants suffering from phosphorus,potassium and magnesium deficiency.Journal of Experimental Botany,1994,45(9):1245-1250.
参考文献:
[1] 彭良志,赖九江,淳长品,曹立,钟莉华,江才伦,凌丽俐.复合镁肥对赣南脐橙缺素黄化的矫治作用.中国南方果树,2008,37(3):10-12.
[3] 刘厚诚,宋世威,雷雨,陈日远.缺镁对菜心生长影响的初步研究//雷建军.园艺学进展 (第5辑).广州:广州出版社,2002:539-542.
[4] 李延,刘星辉,庄卫民.缺镁对龙眼光合作用的影响.园艺学报,2001,28(2):101-106.
[5] 梁开明,曹洪麟,徐志防,叶万辉,刘世平,李武军.台湾青枣及野生种的光合作用日变化及光响应特征.园艺学报,2008,35(6):793-798.
[6] 刘厚诚,陈细明,陈日远,宋世威,孙光闻.缺镁对菜薹光合作用特性的影响.园艺学报,2006,33(2):311-316.
[7] 杨勇,蒋德安,孙骏威,黄宗安,金松恒.不同供镁水平对水稻叶片叶绿素荧光特性和能量耗散的影响.植物营养与肥料学报.2005,11(1):79-86.
[8] 张广越,彭良志,淳长品,曾明,凌丽俐,赖九江,王振兴.脐橙叶片镁、硼含量变化与缺素黄化的关系.园艺学报,2010,37(8):1317-1324.
[17] 饶立华.植物矿质营养及其诊断.北京:农业出版社,1993:78-82.
[18] 曹恭,梁鸣早.镁——平衡栽培体系中植物必需的中量元素.土壤肥料,2003,(3):1-3.
[24] 焦德茂,李霞,黄雪清,季本华.不同高产水稻品种生育后期叶片光抑制、光氧化和早衰的关系.中国农业科学,2002,35(5):487-492.
——缺镁对柑橘光合作用及相关生理生化的影响

