食物链长度理论研究进展
张 欢,何 亮,张培育,沙永翠,徐 军
(1.中国科学院水生生物研究所,武汉 430072;2.中国科学院大学,北京 100049)
1.1 食物链长度的定义与重要性
食物网是指生态系统中生物间通过摄食关系构成的复杂网状营养关联,是现代生态学的核心内容之一[1-4]。较食物网的复杂网络结构而言,食物链通常是用来综合指示能量从食物网底端的初级生产者、有机碎屑到顶端捕食者之间的流动[5-7]。对顶级捕食者的营养级位置的估算是基于所有可能的从基础资源到消费者间能流路径的加权计算,即:是 i物种的第 j种食物来源所占的比例(0≤Wij≤1,是食物物种j的营养级位置,L是所研究群落中所有物种的集合。通常采用所研究群落L集合中营养级位置最高的物种营养级位置,食物链长度作为该群落的食物链长度。
食物链长度(FCL)是生态系统中最重要的特点之一;它表征了生态系统食物网从初级生产者到顶级捕食者之间的营养级数,是一个反映食物网物质转换与能量传递的综合指数[4,6-8]。食物链及其动态特征是生态学许多重要理论的基础,例如Elton的能量金字塔[9]、绿色世界理论[10]、营养级联[5,11]。FCL既反映了从初级生产者到顶级捕食者能量流动[9,12],又反映了顶级捕食者对低营养级的影响强度[13]。FCL通过影响群落结构、物种多样性、生物间营养交互作用以及生态系统内部群落的稳定性,进而改变生态系统的主要功能,例如资源要素循环[14]、初级生产力、与大气的碳交换[15]、生物操纵以及全球变化[7]、污染物生物富集[16-17]从而决定生物体内污染物的浓度[4],并且也很大程度上决定了顶级捕食者的污染物的浓度,包括大部分被人类食用的鱼[18]。
1.2 食物链长度的估算方法和评价及技术手段
1.2.1 估算方法
度量食物链长度最常用的方法共有3种(图1)[4,7]。第1种是基于链接度食物网,是用食物网底部初级生产者与顶级消费者间平均链接点数量来度量的食物链长度,被称为链接度食物链长度(CFCL)[7,19];第2种是基于功能食物网,以对一个或多个低营养级有显著控制效应的消费者作为顶级捕食者,根据它对低营养级影响路径与强度来度量FCL,被称为功能食物链长度(FFCL)[13,20];第3种是基于能量食物网,以食物网底部初级生产者与顶级消费者间平均能量传递路径加权来度量FCL(EFCL)[6-8]。EFCL反映了全部到达顶级捕食者的能量路径(CFCL的特点),也反映了不同路径能量传递的强度或效率(FFCL的特点)[2,13,21];同时它还具有易于计算的特点,即通过稳定同位素技术实测食物网底部初级生产者和碎屑与消费者的碳氮稳定性同位素值,计算从资源到顶级捕食者之间的能量流动路径与强度的“加权”平均,即EFCL[22-26]。
(1)基于链接食物网的食物链长度的定义如图1
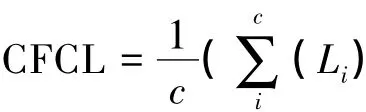
式中,L表示在一个相对比较复杂的食物网中链接基底可利用资源与顶级消费者的第i条食物链的链接数量,c表示的是链接基底可利用资源到顶级消费者的总路径数。
(2)基于功能食物网的食物链长度的定义如图1
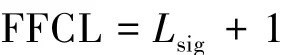
式中,Lsig表示的是基底可利用资源与功能重要性的顶级消费者之间的链接数,功能重要性是指捕食者引起营养耦联的能力或者降低在他以下基数个营养级的物种的生物量的能力。
(3)基于能量食物网的食物链长度的定义如图1
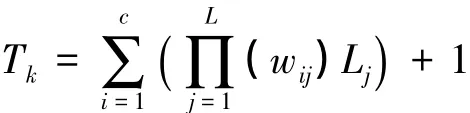
式中,Tk是第k个捕食者的营养级位置,wij是消费者同化一种资源的比例,Lj是能量通过第j条链传到该捕食者的需要同化的次数。
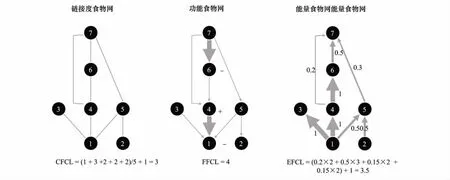
图1 基于链接度、功能、能量食物网的食物链长度度量方法Fig.1 CFCL,connectance-based food chain length;FFCL,functional food chain length;EFCL,energetic food chain length
1.2.2 不同类型食物链长度估算方法的评价
基于链接度食物网的食物链长度(CFCL)的计算,通常可以通过把复杂的食物网分解为线性的或是近似线性的食物链,然后可以计算其最大长度,平均长度,和最小长度,每一个都从不同的方面反映了食物网的实现的能量流动模式,通常把最大的长度作为食物链长度。但是CFCL通常是遭到很多生态学家的批评,主要原因有3个,第一,通常研究的食物网是不完整的,导致计算的CFCL可能偏小;第二,CFCL是不连续的,所反映的营养级都是整数的,无法表达食物网中的杂食性等非常重要的特征;第三,CFCL未考虑不同能量流动路径占有的比重不同。在图1中最大食物链和平均食物链长度都是4,最小食物链长度是2。较链接点食物网相比,能量食物网减少了由于食物网不完整引起的误差,同时反映了全部到达顶级捕食者的能量路径以及各路径的所占的比重,还考虑了食物网中杂食性或效率(FFCL的特点)[2,13,21],而且EFCL还具有易于实现的特点。
1.2.3 计算能量食物链长度的技术手段
计算EFCL主要有两种方法,第1种食性分析方法(肠含分析或是胃含物分析),这种方法需要详细的能量食物网(例如通过食性分析和摄食观察等);第2种方法即通过稳定同位素技术实测食物网基底可利用资源与消费者的碳氮稳定性同位素比值,获得从资源到顶级捕食者之间的能量流动路径与强度的“加权”平均,即EFCL[22-28]。食性分析方法直观的看到顶级捕食者的食物种类,但是这种方法需要很专业的分类学知识,也需要大量的样品,并且这种方法并不能反映长期的物质转换和能量流动[27],与食性方法相比,稳定性同位素技术的主要优点在于样品量需要不大对被研究的生态系统影响非常小,同时也更好地反映了生态系统中物质循环和能量流动,能反映生物长期的物质转化和能量传递[29-30]。
在自然生态系统中,利用稳定性同位素技术为研究FCL的理论提供了一个新的实验手段[22,24,27,29-31],这主要是基于消费者与其食物稳定性同位素比率之间的稳定性的关系,即与其食物相比,消费者的稳定性碳、氮同位素的比率分别增加约0—1‰和3‰—5‰,由于稳定性同位素碳每次营养转换后分馏非常小[29],因而稳定性碳同位素一般用来区分生态系统中不同栖息地的物质和能量的流动例如湖泊中沿岸带和敞水区[32-33]或是河流食物网中的急流和静水区等等。而每经过一次营养转换消费者与食物的稳定性同位素氮分馏差异很明显,从而为连续测定食物网中各消费者的营养级位置,以及食物网中的最大营养级位置(即食物链长度),生态系统之间的比较研究,提供了简单省力而又强有力的方法。
2 食物链长度决定因素假说与交互作用
自Hairston等1960[10]发表的关于种群、群落水平竞争关系的文章以来,生态学者越来越认识到食物网结构在调节大范围的生态模式和生态过程中的重要性[13,15,34-36]。FCL作为食物网营养结构与功能的基本属性,其决定因素一直是是生态学中悬而未决的问题[12,37-42]。国际上,决定食物链长度的主要的假说大体分为四类[4,7,24,28],即资源可利用性假说、生产力空间假说、动态稳定假说与生态系统大小假说(图2A)。四大假说中,资源可利用性假说(也称为能量限制假说)于1959年最早提出[43];基于热力学第二定律,该假说认为能量在连续的营养级传递过程中不断减少,受营养传递效率的限制,能够被更高营养级利用的资源越来越少[43-44],因而能量传递效率决定了FCL的大小[1-4]。Schoener[3]1989提出的生产力空间假说是资源可利用性假说的一种延伸[3],综合考虑了生产力和生态系统大小两个因子。该假说认为生产力空间与初级生产力共同决定了系统物种的多样性和群落的组成,进而决定了FCL的大小[3,28,45]。动态稳定假说是基于对Lotka-Volterra模型可行性与稳定性的理论观测所提出的[46]。该假说认为长FCL对干扰的恢复力相对较差[11,46],由于生态系统始终处于一定强度和频率的的干扰之中,因此FCL随着干扰的增加而变短[14,47]。生态系统大小假说是结合理论研究[48-49]与生产力空间假说而提出的[3-4,28,45,48-49]。该假说认为大的系统不仅能为食物网提供更多的可以利用的资源[3],还能通过增加物种多样性、栖息地可利用性与异质性、捕食者-被捕食者相互作用的稳定性,降低消费者杂食性、提高食性专一性程度,可以形成更丰富的功能营养多样性以及空间异质性,从而可以维持更长的食物链长度,进而增加了FCL[24,28,48,50-51]由于在自然生态系统中,关于功能食物链长度变化的数据很少[4],在本综述中主要关注的是基于能量流动食物网的食物链长度的决定因素。分别从这几个主要的决定因素详细的论述。
2.1 资源可利用性假说(生产力假说)
资源可利用性假说(也称为能量限制假说)最早是在1959年由Hutchinson[43]提出的,50多年来,广泛被生态学家讨论,并且被综合成为理论[43,52],该理论是基于热力学第二定律,在生态系统中,当能量以食物的形式在生物之间传递时,食物中相当一部分能量被降解为热而消散掉(使熵增加),其余则用于合成新的组织作为潜能储存下来。所以一个动物在利用食物中的潜能时常把大部分转化成了热,只把一小部分转化为新的潜能。因此能量在生物之间每传递一次,一大部分的能量就被降解为热而损失掉。该理论认为能量是在连续的营养级传递过程中不断减少,能量传递效率影响了FCL的大小[1-4,34]。该理论认为FCL会随着食物网中能量传递效率和可利用资源的总量的增加而增加[4]。目前资源可利用性假说即食物链长度会随可利用资源的增加(例如初级生产或是碎屑的增加)而变长的假说被学者广泛的讨论和验证[8,25,53],关于这个假说的验证不同的学者得出相互矛盾的结论,Sabo等[7]综述了31个关于食物链长度决定因子的相关文献,其中有20篇对资源可利用性假说检验,发现有10篇文献得出食物链长度随可利用的资源的增加而增长,有4个研究未发现可利用的资源对食物链长度有影响,有2篇文献发现可利用的资源增加食物链长度反而变短。在实验室微系统中生产力是限制食物链长度的一个重要的因子[54],在热带雨林中树洞中的实验发现在生产力较小的单元中主要的捕食者量较少,验证了FCL随生产力的增加而增加的这个假说,Kaunzinger等[52]同样在微宇宙系统也验证了资源可利用性假说的正确性。但是在许多自然生态系统中,很多研究发现可利用的资源并不直接决定食物链的长度[23,45,55]。理论研究表明,自然生态系统中复杂的的食物网与人工的简单的微宇宙系统中简单线性的食物链功能机制差别非常大。在自然生态系统中,最长的食物链出现在生产力中等水平的系统中。这主要是由于在很高生产力的生态系统中顶级捕食者的密度可以达到较高的水平,由于顶级捕食者的捕食压力大,可能会使中间捕食者消失,导致现实的食物链长度缩短[56-57]。有研究表明即使是在单位面积可利用的资源受限的系统中,也未发现可利用的资源对食物链长度的影响[42,54]也有些研究得出可利用的资源对食物链长度负影响的结论,但是这些研究只是测定了受限制的可利用的资源的范围。然而Post等[28]却很充分的证明了,在存在影响的情况下,生态系统的地理位置和系统可利用的资源范围的下限共同能解释这些矛盾的结论。模型研究[46,58]发现单位可利用的资源在小于1—10gcm-2a-1。范围内时,可利用的资源对食物链长度的影响最大。有研究[52,54]发现可利用的资源对食物链长度的影响作用大,所研究的系统的单位面积的可利用的资源都低于10gcm-2a-1,但是在[8,28,53]的研究中,发现可利用的资源对食物链长度的影响不大,这几个研究中系统的单位面积的可利用的资源都超过了10gcm-2a-1。可利用的资源只在特定的状态条件下(例如生态系统可利用的资源受限的情况下)才决定食物链的长度。
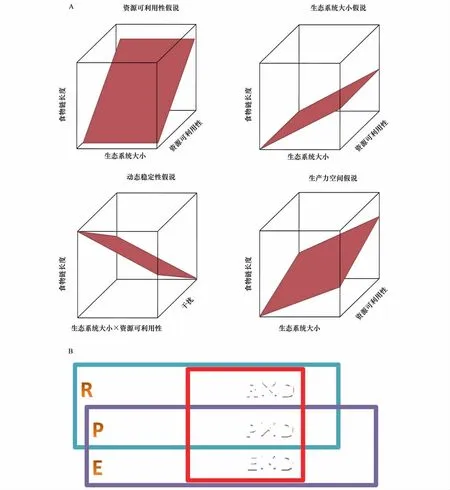
图2 食物链长度限制因素假说A:4种假说包括资源可利用性假说(Resource availability hypothesis,R)、生态系统大小假说(Ecosystem size hypothesis,E)、动态稳定假说(Dynamic stability hypothesis,D)与生产力空间假说(Productive space hypothesis,P);B:4种假说之间的独立与相互作用,反映了生态系统食物链长度限制因素的多样性与复杂性Fig 2 Four hypothesis control food chain length A:resource availability hypothesis,productivity space hypothesis,ecosystem size hypothesis and dynamic stability hypothesis;B:The independence and interaction between four hypothesis indicate the complexity and diversity of food chain length controls in ecosystems
2.2 生产力空间假说
Schoener[3]1989年提出的生产力空间假说是实际资源可利用性假说的延伸[3],该假说在可利用资源假说的基础上引入了生态系统大小这个因子,认为生产力空间与初级生产率共同决定了系统物种的多样性和群落的组成,进而决定了FCL的大小[3,28,45]。该假说可以通过简单的观察生产力空间和食物链长度的关系来验证[3],但是这种方法并不能得到非常准确的结论,因为这种方法无法具体的确认食物链长度是仅仅只受单位空间内可以利用的资源或系统大小单独还是他们共同影响的。更有效的检验方法是通过测量生态系统大小和单位空间可利用的资源双梯度条件下的食物链长度来验证该理论[6]。将生态系统大小和单位空间可利用资源的影响区分开,这样就可以弄清楚潜在的影响机制,确认是系统大小直接影响食物链长度还是由于系统大小影响了总的初级生产力而影响食物链长度的。Doi等[25]2009年对日本松山的15个池塘生态系统的研究,通过测量每个池塘总的生产力,池塘的体积(代表生态系统的大小),以及可被食用的藻类碳源(可利用的资源),发现(生产力-空间)(即可食用的碳与池塘的体积)决定了池塘食物链长度,然而总的生产力并不能直接影响食物链长度,Doi等[25]2009年的研究生产力空间提供了有力的支持。然而关于这个假说的验证其他不同的学者得出的结论并不一致,甚至相互矛盾。有3个研究用定量的数据检验了生产力空间假说[8,28,53]。他们都证明了生态系统大小,对食物链长度有很大的影响,但是单位空间可利用的资源对食物链长度几乎没有影响,验证了生态系统大小假说。Sabo等[7]综述了31个关于食物链长度决定因子的相关文献,有6个相关研究检验了生产力空间假说,其中有3个研究认为生产力空间假说成立,是由单位可利用的资源和生态系统的大小共同(生态系统中总的生产力)决定的。综合分析这些不一致的结论,原因可能有3个,第一,研究中可利用资源大多都不是直接测量的,而是用其他间接指标(例如总氮浓度,总磷浓度,叶绿素浓度),与真实可利用资源有偏差。第二,大多数研究在估算可利用的资源的时候并未考虑藻类及其他初级生产者的适口性和外源物质对生态系统的补给,只有少数研究[25]从可利用资源中扣除了不适口的资源,这两个因子都可能影响资源可利用性假说和生产力空间假说的检验。第三,在有重复的梯度的食物链长度的研究中,很多结果是来源于不完全的梯度的数据,离散变量的可利用资源和生态系统大小也是很常见的,这两个因子都可能会影响生产力空间假说的检验[45]。
2.3 生态系统大小假说
生态系统大小假说是结合理论研究[48-49]与生产力空间假说而提出的。该假说认为大的系统不仅能为食物网提供更多的可以利用的资源[3]还能通过增加物种多样性、栖息地可利用性与异质性、捕食者-被捕食者相互作用的稳定性,降低消费者杂食性、提高食性专一性程度,可以形成更丰富的功能营养多样性以及空间异质性,从而可以维持更长的食物链长度[3-4,48-49]进而增加了FCL。生态学家对生态系统大小假说的解释是,以湖泊生态系统为例Vander Zanden等[8]认为较大的湖泊有较长的食物链可能是由于两个原因。第一,较大湖泊的顶级捕食者例如湖鳟(lake trout)在较小的湖泊不一定能够找得到。第二,有些鱼,如黑鲈(black bass)在较大的湖泊中比在较小的湖泊中以较高营养级的生物为食物。更多的生态学家认为在较大的生态系统的食物链可能会更加多样化,允许更多物种的食性专门化,随着栖息地多样性的的增加,物种的多样性[48],捕食者-被捕食者之间的相互关系的稳定性增强,杂食性减少,栖息地的可获得性以及异质性[53]这些因素都被认为是可降低杂食性提高食性的专门化,从而增加食物链的长度[28]。认为是可降低杂食性提高食性的专门化,从而增加食物链的长度[51]。生态系统大小假说的提出较资源可利用性和生产力空间较晚,关于生态系统大小假说的验证的研究较前两者少,自生态系统大小假说提出以来,对于该假说的验证也吸引了越来越多生态学家的兴趣,尤其是在湖泊和池塘生态系统中[8,25,28]。对于该假说的验证,有明确的方向,生态系统大小对食物链长度都是正影响,Sabo等[7]综述的31篇相关研究中,有8个对生态系统大小假说进行了验证,其中6个研究认为,较大的生态系统能维持能长的食物链长度,但仍有一个研究却得出了相反的结果[41]。Vander Zander等[23]通过收集全球219多个生态系统的食物链长度数据,发现在全球格局下,生态系统大小对食物链长度没有明显的影响,在收集了全球127个淡水湖泊的食物链长度与湖泊的面积发现没有明显的相关性(R2=0.063),但是在一定经度纬度范围内又呈显著的正相关性,但是在一定经度纬度范围内又呈显著的正相关性,在纬度为41—47°之间和经度为72—80°之间食物链长度与湖泊大小又有显著的正相关性(R2=0.59),若分别只限定经度或纬度的变化时这种相关性都有所下降(图3)。
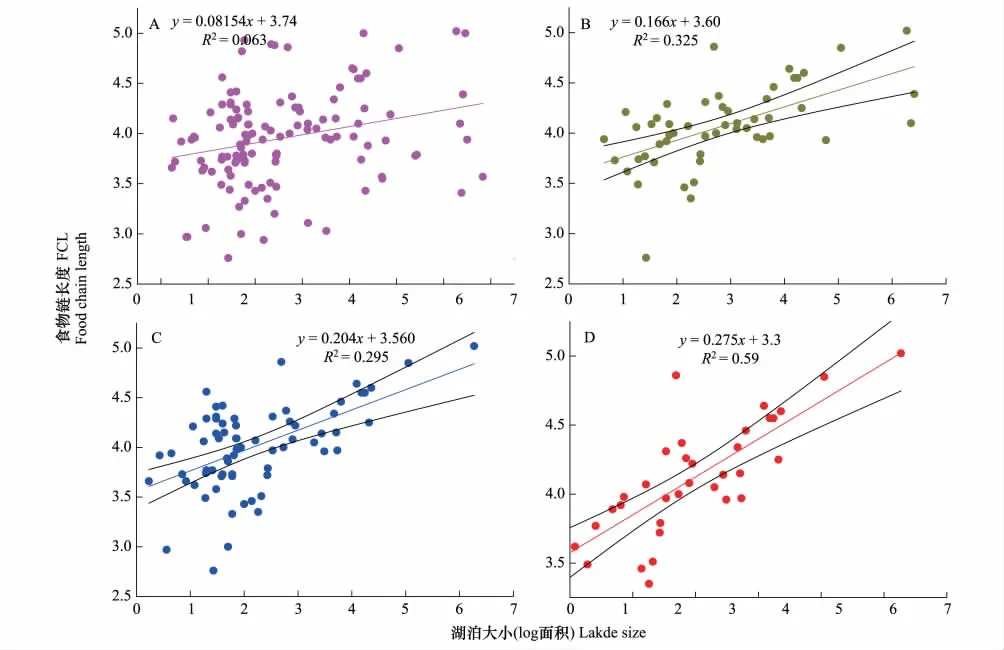
图3 全球范围内的湖泊面积与食物链长度(FCL)的相关关系(A);为纬度为41—47°之间的湖泊面积与食物链长度的相关关(B);为经度为72—80°之间的湖泊面积与食物链长度的相关关系(C);为纬度为41—47°、经度为72—80°之间湖泊的面积与食物链长度的相关关系(D)(数据引自[8,18,60-95])Fig.3 Relationship between the food chain length of lakes and lake size in the global scale(A);Relationship between lake size and food chain length of lakes located at(41—47N)(B);Relationship between lake size and food chain length of lakes located at(71—80W)(C);Relationship between lake size and food chain length of lakes located at(41—47 N,72—80W)(D)(Data cited from[8,18,60-95])
Vender Zanden等[22]和Post等[28]都报道了湖泊的生态系统面积的大小与食物链长度的正相关关系,他们所研究的湖泊都分布在很窄的一个经纬度范围内。这说明淡水湖泊生态系统的食物链长度可能还受气候、温度、日照、降水、地理区位等非生物因素的影响。同时也说明了在其它非生物环境因素一致的条件下,淡水湖泊食物链长度主要受湖泊面积的大小影响。对这些研究的综合分析,发现Sabo等中得出正相关的研究大都是在池塘或者湖泊这种有明确边界的系统中的研究[8,25,28],对系统大小的定义很明确(湖泊的面积或者体积)。对于该假说在河流生态系统中的验证比较少,Sabo和Mchugh等[26,59]分别在河流生态系统中验证了生态系统大小假说,他们对系统大小的变量都是自行定义。综合分析这些结果发现,对生态系统大小假说的验证学者大多偏向于现在边界清晰的生态系统。对于这些研究所得出不同结论的解释有以下几点:第一,湖泊和池塘生态系统有明显的边界,所以容易定义系统大小这个变量,因而在湖泊生态系统中对生态系统大小假说的验证比在河流中多。第二,在河流生态系统对系统大小的定义,方法多样,采用不同的方法定义可能会得出不同的结论,第三,在小的区域范围内生态系统大小是决定食物链长度非常重要的因子。
2.4 动态稳定性假说(干扰)
动态稳定假说是基于对Lotka-Volterra模型动态性与稳定性的理论观测所提出的[46]。该假说认为长FCL对干扰的恢复力相对较差[11,46],由于生态系统始终处于一定强度和频率的的干扰之中,因此FCL随着干扰的增加而变短[14,47]。这个假说的理论基础是基于系统的恢复性和稳定性的,但是把这个理论进一步推广到群落中,食物链长度越长越稳定。因而动态稳定性假说的理论基础受到了挑战,对于这个假说的验证,不同的研究者所得的结果也大相径庭,甚至相互矛盾,大多数的关于动态稳定性假说的验证,得出的结论是干扰(如干旱或者洪水)使食物链变短[15,31,59,96]。这些认为干扰使食物链长度变短的研究,认为干扰对食物链长度影响的机制也不一致,Hoeinghaus等在巴拉那河流域的水库的研究发现,水文波动是影响了支持更高营养级的碳源从而导致食物链变短,McHugh等[59]在Rakaia河流域的研究发现,扰动(水文变化,地貌及温度的)是通过影响中间捕食者,而导致食物链长度变短。而Takimoto[24]等在巴哈马群岛上的研究则发现干扰并没有改变食物链长度,只是原先的顶级捕食者被其他的同一个营养级的生物替代了。Marks等[41]在鳗河的研究则发现干扰(洪水)增加了食物链长度。关于干扰对食物链长度的影响没有一个定论,这可能因为每个研究者对于干扰的定义选择不同,对于这个假说的验证的研究主要集中在河流和phytotelmata中,几乎在湖泊中未曾报道过,且多以洪水干旱等水文的变化等因子作为干扰变量。再者,动态稳定性的理论基础存在疑问,对于干扰对食物链长度的影响的机制需要更进一步深入的研究。在以后的研究中,对于动态稳定性假说的验证的几点建议:第一,需要在湖泊及池塘等生态系统中验证,第二,要考虑干扰的类型和时效性,灾难性的干扰还是周期有规律的的干扰,以及人类活动的干扰。
2.5 食物链长度决定因素的交互作用
最近的一些研究中发现单一的用资源可利用性(能量)或者动态稳定性是很难阐述清楚FCL在时空尺度上的多样性格局[3,47,53,97],因为在自然生态系统中,FCL是受众多因素交互作用和过程共同决定,这些因素和过程的作用使得FCL在时空尺度上呈现出明显的格局多样性,因此不同时空范围内决定FCL的主导因子也不同(图4)[2,23,26,39,55]。从生态系统进化的角度讲,形成初期或是处于隔离状态的生态系统,其 FCL 主要受群落结构的自组织特征限制[10,13,48]。在非生态隔离或进化后期的生态系统中,FCL的主要决定因子为资源的可利用性,即资源不足则FCL受到限制,若资源充足则不限制FCL[21,25,36,98];此时捕食者与被捕食者之间的相互作用,成为FCL的主要决定因子[21,40,99-100]。处于进化稳定期的生态系统,决定FCL的主要因子就是干扰[24,41,54,59,101]。如果生态系统处于低水平干扰,那么 FCL在一定程度上是决定于生态系统大小;而在高频干扰下的生态系统,其 FCL 则主要受系统的稳定性或恢复力的限制[4,14,24,51,59,102]。
3 食物链长度研究的展望
3.1 食物链长度决定因子的理论机制研究进展
食物链长度的最终决定因子仍然是悬而未决,不同的生态学家得出不同的结论,在以往的研究中很多关于食物链长度决定因子的研究所得到的结果是来自实验室或野外容器中,而不是真正的生态系统,这些人工的生态系统可控制性更好,但是得出来的结论却没有真正野外河流、湖泊、池塘、湿地等水生态系统中的现实可靠。在野外的研究也有一个共同点就是缺乏重复,野外实验很难获得这些独立变量(生态系统大小)的梯度变化数据。很多研究对独立变量没有清晰的定量测量,而直接得出这些因素对决定食物链长度有重要的作用。很多研究是用其他的方法间接测量可以利用的资源,还有一些研究没有量化扰动的大小而直接猜想不同扰动的差异。另外,在有重复梯度的食物链长度的研究中,很多结果是来源于不完全的梯度的数据,离散变量的可利用资源和生态系统大小是很常见的,这两个因子可以同时影响资源可利用性假说、生态系统大小假说以及生产力空间假说的检验[45]。
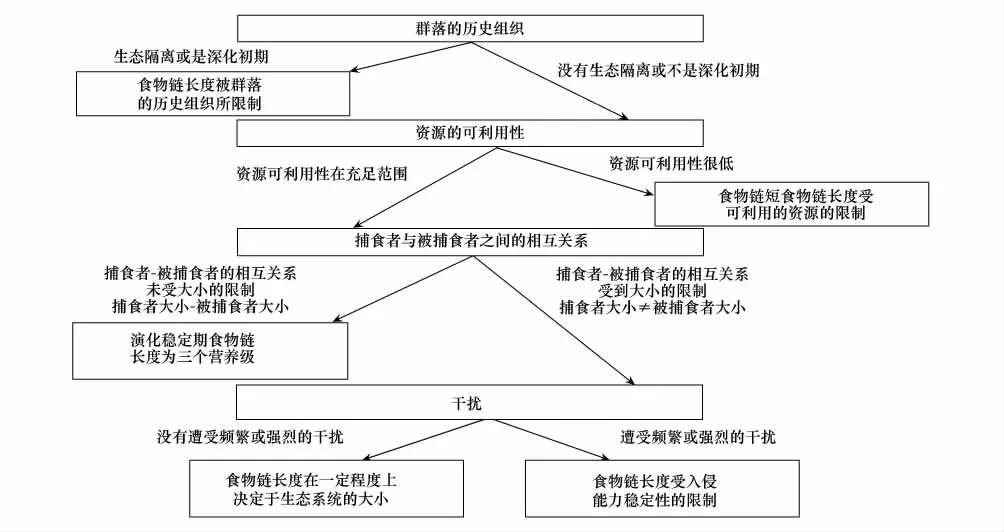
图4 在生态系统进化的不同状态食物链长度受不同的因子限制[9]Fig.4 Food chain length constrained by different controls at differet stage of ecosysetem evolution [9]
在以后的研究中应考虑所有可能主要影响食物链长的因素。测量可利用的资源应包括系统原地的初级生产力、外源输入,以及碎屑;测量可利用资源时,无论是原位的生产力还是外源的输入都需要测量其持续供给速率,对于可利用的资源还应该测量顶级捕食者生长季节时的平均生产力,若是有多年生的顶级捕食者还应该考虑连续几年的平均生产力。在选择度量生态系统大小的指标要把握两点,第一,系统大小控制食物食物链长度的机制,第二是和其他的变量相互独立;在像河流这样的开放生态系统中,系统的边界不清晰,在定义生态系统大小时,需要考虑多种多个指标来最有效的解释生态系统大小与食物链长度的关系的机制。在讨论环境变动对食物链长度影响的时候应该要考虑恰当的的响应时间,单个的事件和持续的扰动对食物链长度的影响是不同的。测量多种来源的干扰对食物链长度的影响。周期性和不规则的的扰动、随机的干扰和灾难性的扰动对食物链长度的影响是不一样的.应该不仅仅收集顶级捕食者,应该同时考虑中间消费者以及共同的基准生物,食物的结构也影响了各种潜在的决定因子与食物链长度的关系,因此更详细的收集可以解释清楚这些潜在因子(生态系统大小,可利用的资源,干扰)决定食物链长度的机制。
3.2 食物链长度在污染物生物富集中的研究进展
人类的活动导致淡水环境中污染物的增加[7],很多污染物(如重金属汞,持续性污染物)在水体中分布广,难分解,而且可在环境中持久存在,再经物理化学作用进入水体沉积物或富集于生物体中。有机污染物一方面通过沉积物的再悬浮作用而重新进入水体,另一方面通过水生生物体的富集,通常是通过食物链的传递这条途径经过生物富集进入到水生动物体内的,亲脂性的污染物,例如可持续性污染物在食物网中还会经过生物放大的作用,导致鱼类以及其他水生动物体内污染物的浓度比周围环境中高几个数量级[7,16],因此食物链长度是决定污染物重金属物质浓度(例如甲基汞)以及持续性污染有机物(例如PCBs)[7,103-105],因此在研究水生食物网中污染物浓度时,食物链长度是非常重要的一个指标。湖泊中食物网的结构决定了鱼虾等水产品体内的污染物的浓度,因此,关注养殖性鱼类的营养级位置非常重要。
食物网的动态特征变化是指示水生态系统中顶级捕食者体内污染物的重要因子。在一个特定的湖泊生态系统中可能会改变食物链长度的因子主要有两个,第一是新分类群的入侵,外来种的入侵,插入到原食物链中可能会导致食物链变长,第二是由于环境的变化,导致食物来源的改变,也可能会导致食物链长度变长,从而在一定程度上影响具有生物富集效应毒素的浓度。Sharma等[106]在Moab湖中由于环境变化引起食物网结构的变化,由于生产力的增加,导致鱼类食物链长度的增加,从而导致了顶级捕食者体内汞增加了五倍。
由于食物链长度对水鸟及鱼体内污染物浓度的巨大的影响作用,因此通过生物操作控制食物链的结构越来越多作为管理湖泊污染物浓度的有效的手段,例如移除大的pike(Esox lucius)已经成为管理湖泊污染物浓度的一个优选,因为移除这些顶级捕食者不仅可以降低较小个体pike的污染物浓度,还可以降低一些家养鱼类的污染物浓度[107]但是,目前产生这种影响的机制还不清楚,食物网评估和生物操控在管理和降低污染物浓度是基础生态和应用生态学结合快速发展的一个领域[108]。
3.3 食物链长度在指导生物操纵中的研究进展
生物操纵是通过管理和调节水生食物网的结构来达到净化水体的目的,或者说是生物操纵越来越多的被用来缓解富营养化作用。生物操纵主要是通过对水生生物群及其栖息地的一系列调节,以增强其中的生物间的相互作用,促使浮游植物生物量下降。自1972年Hlerlbert[109]等首次发现一种名为食蚊鱼(mosquito)的鱼类具有降低轮虫和枝角类数量并导致浮游植物生物量上升的能力,并第一次提出了通过控制鱼类达到控制藻类水华的设想人们普遍注重位于较高营养级的鱼类对水生生态系统结构与功能的影响,生物操纵的对象主要集中于鱼类,特别是浮游生物食性的鱼类,即通过去除食浮游生物者或添加食鱼动物降低浮游生物食性鱼的数量,使浮游动物的生物量增加和体型增大,从而提高浮游动物对浮游植物的摄食效率,降低浮游植物的数量。Carpenter等[111]提出的营养级联假说,认为顶级捕食者-被捕食者的这种动态作用贯穿到湖泊的整个食物网中(从顶级捕食者到初级生产者),因此功能食物链长度决定了初级生产者的生物量,Scheffer的稳态转换理论认为有偶数个营养级的食物网存在两个可以交替转换的稳定状态。可以通过生物操作的手段改变食物链的长度引发营养级联效应,促进由浊水型稳态向清水型稳态转换,随后的实验和模型都表明了有偶数个营养级的食物链能够促进一个以消费者为主导的对藻类生物量的控制[11,110-111],当营养水平降低到阈值以,还可以进一步的从本质上提升水体的透明度[11,113]。
3.4 食物链长度在在对气候变化响应中的研究进展
联合国政府间气候变化专门委员会,第四次报告指出了许多全球气候的预测变化。第一,全球年平均气温升高将导致白天更暖夜晚更冷;第二,更频繁的发生强降雨事件,第三,干旱也会更加频繁,尤其是在中纬度地区;第四,将会出现,北纬地区和热带地区地表径流增加,而中纬度地区将会遭遇地表径流明显减少的变化。这些变化都会对淡水生态系统产生重要的环境干扰,都可能会成为改变食物链长度的重要的潜在因子。第四次评估报告表明,全球变暖,会带来全世界多达30%的物种面临灭绝的威胁。很多濒危物种可能是鱼类[114],很多鱼是顶级捕食者,增加了由全球变化诱发的食物链长度变化的可能性。除了上述联合国政府间气候变化专门委员会,第四次报告预测的这些直接的影响,还有一些值得注意的是全球变化与食物链长度有关的,例如第一,水表面温度的升高导致小水池以及池塘生态系统就更加不稳定了,原本比较稳定的顶级捕食者类群,由于水温的变化,可能导致系统中类群和食物链长度的变化。第二,陆地表面温度的升高,同时会影响湖面温度,从而导致浅水湖泊生态系统中溶解氧和营养物质浓度的升高。地表温度的升高也会导致北纬地区湖泊的湖面更早的解冻会影响跃温层中较冷水和较热水的混合[115]。持续的季节变化会被零星的小的变动替代,导致降水的不规则。最后,高频次的强降雨事件,意味着未来河流径流的全球格局的不可预测性。更重要的是,可能会有更频繁的极端干旱出现,会出现很多河流干涸现象,尤其是在中纬度地区,都会是影响食物链长度的重要的潜在因子。目前关于水文和食物链长度联系的证据非常多,但是并没有强有力的统一定论,大多数的关于动态稳定性假说的验证,得出的结论是干扰(如干旱或者洪水)使食物链变短[15,31,59,96]。Mark[41]等在鳗河的研究则发现干扰(洪水)增加了功能食物链长度。研究报道了洪水对链接度食物网长度没有影响[98]。以后的研究应该更关注食物链长度在水文变化影响下的变化机制以便于能更好的预测全球变化对食物链长度的影响。
[1]Yodzis P.Energy flow and the vertical structure of real ecosystems.Oecologia,1984,65(1):86-88.
[2]Briand F,Cohen J E.Environmental correlates of food chain length.Science,1987,238(4829):956-960.
[3]Schoener T W.Food webs from the small to the large.Ecology,1989,70(6):1559-1589.
[4]Post D M.The long and short of food-chain length.Trends in Ecology& Evolution,2002,17(6):269-277.
[5]Pace M L,Cole J J,Carpenter S R,Kitchell J F.Trophic cascades revealed in diverse ecosystems.Trends in Ecology& Evolution,1999,14(12):483-488.
[6]Post D M,Takimoto G.Proximate structural mechanisms for variation in food-chain length.Oikos,2007,116(5):775-782.
[7]Sabo JL,Finlay JC,Post D M.Food chains in freshwaters.Annals of the New York Academy of Sciences,2009,1162(1):187-220.
[8]Vander Zanden M J,Shuter B J,Lester N,Rasmussen J B.Patterns of food chain length in lakes:a stable isotope study.The American Naturalist,1999,154(4):406-416.
[9]Elton C.Animal ecology.Chicago:University of Chicago Press,1927.
[10]Hairston N G,Smith F E,Slobodkin L B.Community structure,population control,and competition.American Naturalist,1960,94(879):421-425.
[11]Carpenter SR,Kitchell J F.The trophic cascade in lakes.Cambridge University Press,1996.
[12]Lindeman R L.The trophic-dynamic aspect of ecology.Ecology,1942,23(4):399-417.
[13]Paine R T.Food webs:linkage,interaction strength and community infrastructure.Journal of Animal Ecology,1980,49(3):667-685.
[14]DeAngelis D L,Bartell SM,Brenkert A L.Effects of nutrient recycling and food-chain length on resilience.American Naturalist,1989,134(5):778-805.
[15]Schindler D E,Carpenter S R,Cole J J,Kitchell J F,Pace M L.Influence of food web structure on carbon exchange between lakes and the atmosphere.Science,1997,277(5323):248-251.
[16]Vander Zanden M J,Rasmussen J B.A trophic position model of pelagic food webs:impact on contaminant bioaccumulation in lake trout.Ecological monographs,1996,66(4):451-477.
[17]Tomy G T,Pleskach K,Ferguson SH,Hare J,Stern G,MacInnis G,Marvin C H,Loseto L.Trophic dynamics of some PFCs and BFRs in a western Canadian Arctic marine food web.Environmental science& technology,2009,43(11):4076-4081.
[18]Kidd K A,Schindler D W,Hesslein R H,Muir D C G.Effects of trophic position and lipid on organochlorine concentrations in fishes from subarctic lakes in Yukon Territory.Canadian Journal of Fisheries and Aquatic Sciences,1998,55(4):869-881.
[19]Dunne JA,Williams R J,Martinez N D.Food-web structure and network theory:the role of connectance and size.Proceedings of the National Academy of Sciences,2002,99(20):12917.
[20]Power M E,Marks JC,Parker M S.Variation in the vulnerability of prey to different predators:community-level consequences.Ecology,1992,73(6):2218-2223.
[21]Power M E,Rainey WE.Food webs and resource sheds:towards spatially delimitingtrophic interactions//Hutchings MJ,John E A,Stewart JA,eds.Ecological Consequences of Habitat Heterogeneity,2000,291-314.
[22]Vander Zanden M J,Casselman JM,Rasmussen JB.Stable isotope evidence for the food web consequences of species invasions in lakes.Nature,1999,401(6752):464-467.
[23]Vander Zanden M J,Fetzer W W.Global patterns of aquatic food chain length.Oikos,2007,116(8):1378-1388.
[24]Takimoto G,Spiller D A,Post D M.Ecosystem size,but not disturbance,determines food-chain length on islands of the Bahamas.Ecology,2008,89(11):3001-3007.
[25]Doi H,Chang K H,Ando T,Ninomiya I,Imai H,Nakano S.Resource availability and ecosystem size predict food-chain length in pond ecosystems.Oikos,2009,118(1):138-144.
[26]Sabo J L,Finlay J C,Kennedy T,Post D M.The role of discharge variation in scaling of drainage area and food chain length in rivers.Science,2010,330(6006):965-967.
[27]Vander Zanden M J,Cabana G,Rasmussen J B.Comparing trophic position of freshwater fish calculated using stable nitrogen isotope ratios(δ15N)and literature dietary data.Canadian Journal of Fisheries and Aquatic Sciences,1997,54(1142-1158.
[28]Post D M,Pace M L,Hairston N G.Ecosystem size determines food-chain length in lakes.Nature,2000,405(6790):1047-1049.
[29]Post D M.Using stable isotopes to estimate trophic position:models,methods,and assumptions.Ecology,2002,83(3):703-718.
[30]Rybczynski SM,Walters D M,Fritz K M,Johnson B R.Comparing trophic position of stream fishes using stable isotope and gut contents analyses.Ecology of Freshwater Fish,2008,17(2):199-206.
[31]Hoeinghaus D J,Winemiller K O,Agostinho A A.Hydrogeomorphology and river impoundment affect food‐ chain length of diverse Neotropical food webs.Oikos,2008,117(7):984-995.
[32]Vander Zanden M J,Vadeboncoeur Y.Fishes as integrators of benthic and pelagic food webs in lakes.Ecology,2002,83(8):2152-2161.
[33]Lamberti G A,Chaloner D T,Hershey A E.Linkages among aquatic ecosystems.Journal of the North American Benthological Society,2010,29(1):245-263.
[34]Pimm SL.Food webs.University of Chicago Press,1982.
[35]Persson L,Diehl S,Johansson L,Andersson G,Hamrin S F.Trophic interactions in temperate lake ecosystems:a test of food chain theory.American Naturalist,1992,140(1):59-84.
[36]Arim M,Abades SR,Laufer G,Loureiro M,Marquet P A.Food web structure and body size:trophic position and resource acquisition.Oikos,2010,119(1):147-153.
[37]Beveridge O S,Humphries S,Petchey O L.The interacting effects of temperature and food chain length on trophic abundance and ecosystem function.Journal of Animal Ecology,2010,79(3):693-700.
[38]Freedman H,So J W H.Global stability and persistence of simple food chains.Mathematical biosciences,1985,76(1):69-86.
[39]Hastings A,Powell T.Chaos in a three-species food chain.Ecology,1991,896-903.
[40]Kooi B W,Boer M P,Kooijman SA L M.Resistance of a food chain to invasion by a top predator.Mathematical biosciences,1999,157(1/2):217-236.
[41]Marks J C,Power M E,Parker M S.Flood disturbance,algal productivity,and interannual variation in food chain length.Oikos,2000,90(1):20-27.
[42]Pimm S,Kitching R.The determinants of food chain lengths.Oikos,1987,302-307.
[43]Hutchinson G E.Homage to Santa Rosalia or why are there so many kinds of animals?The American Naturalist,1959,93(870):145-159.
[44]Slobodkin L.Calories/gm.in species of animals.Nature,1961,191(4785):299-299.
[45]Post D M.Testing the productive-space hypothesis:rational and power.Oecologia,2007,153(4):973-984.
[46]Moore J C,de Ruiter P C,Hunt H W.Influence of productivity on the stability of real and model ecosystems.Science,1993,261(5123):906-908.
[47]Sterner R W,Bajpai A,Adams T.The enigma of food chain length:absence of theoretical evidence for dynamic constraints.Ecology,1997,78(7):2258-2262.
[48]Cohen JE,Newman C M.Community area and food-chain length:theoretical predictions.American Naturalist,1992,1542-1554.
[49]Holt R D.Food webs in space:an island biogeographic perspective.Food webs,1996,313-323.
[50]Sprules W G,Bowerman JE.Omnivory and food chain length in zooplankton food webs.Ecology,1988,418-426.
[51]Thompson R M,Townsend C R.Energy availability,spatial heterogeneity and ecosystem size predict food‐ web structure in streams.Oikos,2005,108(1):137-148.
[52]Kaunzinger CM K,Morin P J.Productivity controls food-chain properties in microbial communities.Nature,1998,395(6701):495-497.
[53]Spencer M,Warren P H.The effects of habitat size and productivity on food web structure in small aquatic microcosms.Oikos,1996,75(3):419-430.
[54]Jenkins B,Kitching R,Pimm S.Productivity,disturbance and food web structure at alocal spatial scalein experimental container habitats.Oikos,1992,65(2):249-255.
[55]Arim M,Marquet P A,Jaksic F M.On the relationship between productivity and food chain length at different ecological levels.The American Naturalist,2007,169(1):62-72.
[56]Holt R D,Polis G A.A theoretical framework for intraguild predation.American Naturalist,1997,149(4):745-764.
[57]Diehl S,Feissel M.Intraguild prey suffer from enrichment of their resources:a microcosm experiment with ciliates.Ecology,2001,82(11):2977-2983.
[58]Moore J C,Ruiter P C,Coleman D C,Hendrix P.F Invertebrates in detrital food webs along gradients of productivity.Coleman D C,Hendrix P F,eds.Invertebrates as webmasters in ecosystems.Oxford:CABI Publishing,2000,161-184.
[59]McHugh P A,McIntosh A R,Jellyman P G.Dual influences of ecosystem size and disturbance on food chain length in streams.Ecology letters,2010,13(7):881-890.
[60]Toda H,Wada E.Use of 15 N/14 N rations to evaluate the food source of the mysid,Neomysis intermedia Czerniawsky,in a eutrophic lake in Japan.Hydrobiologia,1990,194(1):85-90.
[61]Fry B.Stable isotope diagrams of freshwater food webs.Ecology,1991,72(6):2293-2297.
[62]Hesslein R,Capel M,Fox D,Hallard K.Stable isotopes of sulfur,carbon,and nitrogen as indicators of trophic level and fish migration in the lower Mackenzie River basin,Canada.Canadian Journal of Fisheries and Aquatic Sciences,1991,48(11):2258-2265.
[63]Toetz D.Use of mass spectroscopy to investigate the diet of brook trout(Salvelinus fontinalis)in an alpine lake.Journal of Freshwater Ecology,1992,7(3):251-256.
[64]Bunn SE,Boon P I.What sources of organic carbon drive food webs in billabongs?A study based on stable isotope analysis.Oecologia,1993,96(1):85-94.
[65]Kline Jr T C,Goering JJ,Mathisen OA,Poe P H,Parker P L.Recycling of Elements Transported Upstream by Runs of Pacific Salmon:I,δ15N and δ13C Evidence in Sashin Creek,Southeastern Alaska.Canadian Journal of Fisheries and Aquatic Sciences,1993,47(1):136-144.
[66]Kling G W.Ecosystem-Scale Experiments.Environmental chemistry of lakes and reservoirs American Chemical Society,Washmgton,1994,91-120.
[67]Yoshioka T,Wada E,Hayashi H.A stable isotope study on seasonal food web dynamics in a eutrophic lake.Ecology,1994,75(3):835-846.
[68]Hecky R,Hesslein R.Contributions of benthic algae to lake food webs as revealed by stable isotope analysis.Journal of the North American Benthological Society,1995,14(4):631-653.
[69]Hobson K A,Welch H E.Cannibalism and trophic structure in a high Arctic lake:insights from stable-isotope analysis.Canadian Journal of Fisheries and Aquatic Sciences,1995,52(6):1195-1201.
[70]Kucklick J R,Harvey H R,Baker JE,Ostrom P H,Ostrom N E.Organochlorine dynamics in the pelagic food web of Lake Baikal.Environmental toxicology and chemistry,1996,15(8):1388-1400.
[71]Gu B,Alexander V,Schell D.Stable isotopes as indicators of carbon flows and trophic structure of the benthic food web in a subarctic lake.Archiv für Hydrobiologie,1997,138(3):329-344.
[72]Kidd K,Hesslein R,Ross B,Koczanski K,Stephens G,Muir D.Bioaccumulation of organochlorines through a remote freshwater food web in the Canadian Arctic.Environmental pollution,1998,102(1):91-103.
[73]Beaudoin C P,Tonn W M,Prepas E E,Wassenaar L I.Individual specialization and trophic adaptability of northern pike(Esox lucius):an isotope and dietary analysis.Oecologia,1999,120(3):386-396.
[74]Kidd K A,Paterson M J,Hesslein R H,Muir D C,Hecky R E.Effects of northern pike(Esox lucius)additions on pollutant accumulation and food web structure,as determined by δ13 C and δ15 N,in a eutrophic and an oligotrophic lake.Canadian Journal of Fisheries and Aquatic Sciences,1999,56(11):2193-2202.
[75]Tatrai I,Matyas K,Korponai J,Paulovits G,Pomogyi P,Presing M.Stable isotope analysis of food webs in wetland areas of Lake Balaton,Hungary.Archiv für Hydrobiologie,1999,146(1):117-128.
[76]Campbell L M,Schindler DW,Muir DC,Donald DB,Kidd K A.Organochlorinetransfer in the food web of subalpine Bow Lake,Banff National Park.Canadian Journal of Fisheries and Aquatic Sciences,2000,57(6):1258-1269.
[77]Garcia E,Carignan R.Mercury concentrations in northern pike(Esox lucius)from boreal lakes with logged,burned,or undisturbed catchments.Canadian Journal of Fisheries and Aquatic Sciences,2000,57(S2):129-135.
[78]Lake JL,McKinney R A,Osterman F A,Pruell R J,Kiddon J,Ryba SA,Libby A D.Stable nitrogen isotopes as indicators of anthropogenic activities in small freshwater systems.Canadian Journal of Fisheries and Aquatic Sciences,2001,58(5):870-878.
[79]Saito L,Johnson B M,Bartholow J,Hanna R B.Assessing ecosystem effects of reservoir operations using food web– energy transfer and water quality models.Ecosystems,2001,4(2):105-125.
[80]Stapleton H M,Masterson C,Skubinna J,Ostrom P,Ostrom N,Baker J.Accumulation of atmospheric and sedimentary PCBs and toxaphene in a Lake Michigan food web.Environmental science& technology,2001,35(16):3287-3293.
[81]Grey J,Thackeray S,Jones R,Shine A.Ferox Trout(Salmo trutta)asRussian dolls':complementary gut content and stableisotope analyses of the Loch Ness foodweb.Freshwater Biology,2002,47(7):1235-1243.
[82]Johnson B M,Martinez P J,Stockwell J D.Tracking trophic interactions in coldwater reservoirs using naturally occurring stable isotopes.Transactions of the American Fisheries Society,2002,131(1):1-13.
[83]Wantzen K M,de Arruda Machado F,Voss M,Boriss H,Junk W J.Seasonal isotopic shifts in fish of the Pantanal wetland,Brazil.Aquatic Sciences-Research Across Boundaries,2002,64(3):239-251.
[84]Black A R,Barlow G W,Scholz A T.Carbon and nitrogen stable isotope assessment of the Lake Roosevelt aquatic food web.Northwest Science,2003,77(1):1-11.
[85]Campbell L M,Hecky R E,Wandera S B.Stable isotope analyses of food web structure and fish diet in Napoleon and Winam Gulfs,Lake Victoria,East Africa.Journal of Great Lakes Research,2003,29(4):243-257.
[86]Gorski P R,Cleckner L B,Hurley JP,Sierszen M E,Armstrong D E.Factors affecting enhanced mercury bioaccumulation in inland lakes of Isle Royale National Park,USA.Science of the Total Environment,2003,304(1):327-348.
[87]Jones J I,Waldron S.Combined stable isotope and gut contents analysis of food webs in plant‐ dominated,shallow lakes.Freshwater Biology,2003,48(8):1396-1407.
[88]Stewart A R,Stern G A,Lockhart WL,Kidd K A,Salki A G,Stainton M P,Koczanski K,Rosenberg GB,Savoie D A,Billeck B N.Assessing trends in organochlorine concentrations in Lake Winnipeg fish following the1997 Red River flood.Journal of Great Lakes Research,2003,29(2):332-354.
[89]Vander Zanden M J,Chandra S,Allen B C,Reuter JE,Goldman CR.Historical food web structure and restoration of native aquatic communities in the Lake Tahoe(California– Nevada)basin.Ecosystems,2003,6(3):274-288.
[90]Grey J,Waldron S,Hutchinson R.The utility of carbon and nitrogen isotope analyses to trace contributions from fish farms to the receiving communities of freshwater lakes:a pilot study in Esthwaite Water,UK.Hydrobiologia,2004,524(1):253-262.
[91]Herwig B R,Soluk D A,Dettmers JM,Wahl D H.Trophic structure and energy flow in backwater lakes of two large floodplain rivers assessed using stable isotopes.Canadian Journal of Fisheries and Aquatic Sciences,2004,61(1):12-22.
[92]Paszkowski CA,Gingras B A,Wilcox K,Klatt P H,Tonn WM.Trophic relationsof the red-necked grebe on lakes in the western boreal forest:a stable-isotope analysis.The Condor,2004,106(3):638-651.
[93]Xu J,Xie P.Studies on the food web structure of Lake Donghu using stable carbon and nitrogen isotope ratios.Journal of Freshwater Ecology,2004,19(4):645-650.
[94]Gu B,Schelske C,Hoyer M.Stable isotopes of carbon and nitrogen as indicators of diet and trophic structure of the fish community in a shallow hypereutrophic lake.Journal of Fish Biology,2005,49(6):1233-1243.
[95]Vander Zanden M J,Fetzer W W.Global patterns of aquatic food chain length.Oikos,2007,116(8):1378-1388.
[96]Smith D C.Factors controlling tadpole populations of the chorus frog(Pseudacris triseriata)on Isle Royale,Michigan.Ecology,1983,501-510.
[97]Kitching R L.Food webs and container habitats:the natural history and ecology of phytotelmata.Cambridge Univ Pr,2000.
[98]Townsend CR,Thompson R M,McIntosh A R,Kilroy C,Edwards E,Scarsbrook M R.Disturbance,resource supply,and food-web architecture in streams.Ecology letters,1998,1(3):200-209.
[99]Jennings S,Warr K J.Smaller predator-prey body size ratios in longer food chains.Proceedings of the Royal Society of London Series B:Biological Sciences,2003,270(1522):1413-1417.
[100]Jonsson T,Ebenman B.Effects of predator-prey body size ratios on the stability of food chains.Journal of theoretical biology,1998,193(3):407-417.
[101]Walters A W,Post D M.An experimental disturbance alters fish size structure but not food chain length in streams.Ecology,2008,89(12):3261-3267.
[102]Allen-Morley CR,Coleman D.Resilience of soil biota in various food webs to freezing perturbations.Ecology,1989,1127-1141.
[103]Finlay JC,Power M E,Cabana G.Effects of water velocity on algal carbon isotope ratios:implications for river food web studies.Limnology and oceanography,1999,1198-1203.
[104]Johnson T B,Evans D O.Behaviour,energetics,and associated mortality of young-of-the-year white perch(Morone americana)and yellow perch(Perca flavescens)under simulated winter conditions.Canadian Journal of Fisheries and Aquatic Sciences,1991,48(4):672-680.
[105]Oliver J D,Holeton G F,Chua K E.Overwinter mortality of fingerling smallmouth bass in relation to size,relative energy stores,and environmental temperature.Transactions of the American Fisheries Society,1979,108(2):130-136.
[106]Sharma C M,Huitfeldt J.Selective exploitation of large pike Esox luciusEffects on mercury concentrations in fish populations.Science of the Total Environment,2008,399(1/3):33-40.
[107]Rasmussen JB,Vander Zanden M J.The variation of lake food webs across the landscape and its effect on contaminant dynamics.The University of Chicago Press:Chicago,2004.
[108]Williams A J,Trexler J C.A preliminary analysis of the correlation of food-web characteristics with hydrology and nutrient gradients in the southern Everglades.Hydrobiologia,2006,569(1):493-504.
[109]Hurlbert S H,Zedler J,Fairbanks D.Ecosystem alteration by mosquitofish(Gambusia affinis)predation.Science,1972,175(4022):639-641.
[110]Carpenter SR,Kitchell JF,Hodgson J R.Cascading trophic interactions and lake productivity.BioScience,1985,35(10):634-639.
[111]Carpenter S,Kitchell J,Hodgson J,Cochran P,Elser J,Elser M,Lodge D,Kretchmer D,He X,Von Ende C.Regulation of lake primary productivity by food web structure.Ecology,1987,68(6):1863-1876.
[112]Carpenter SR,Cole JJ,Hodgson JR,Kitchell JF,Pace M L,Bade D,Cottingham K L,Essington T E,Houser JN,Schindler D E.Trophic cascades,nutrients,and lake productivity:whole-lake experiments.Ecological monographs,2001,71(2):163-186.
[113]Carpenter SR,Christensen D L,Cole J J,Cottingham K L,He X,Hodgson J R,Kitchell J F,Knight S E,Pace M L.Biological control of eutrophication in lakes.Environmental science& technology,1995,29(3):784-786.
[114]Jelks H L,Walsh SJ,Burkhead N M,Contreras-Balderas S,Diaz-Pardo E,Hendrickson D A,Lyons J,Mandrak N E,McCormick F,Nelson J S.Conservation status of imperiled North American freshwater and diadromous fishes.Fisheries,2008,33(8):372-407.
[115]Magnuson JJ,Robertson D M,Benson B J,Wynne R H,Livingstone D M,Arai T,Assel R A,Barry R G,Card V,Kuusisto E.Historical trends in lake and river ice cover in the Northern Hemisphere.Science,2000,289(5485):1743-1746.

