气相色谱法测定水产品中硫丹及其代谢物残留
叶 玫,姜琳琳,余 颖
(福建省水产研究所,福建 厦门 361012)
硫丹(endosulfan)的化学名为1,2,3,4,7,7-六氯双环[2,2,1]庚烯-(2)-双羟甲基-5,6-亚硫酸酯,分子式:C9H6Cl6O3S,是一种高效有机氯广谱杀虫剂,已在我国等多个国家注册登记并在农、林业生产中广泛使用[1]。硫丹对几乎所有种类的动物均具有毒性,在环境中有很强的持久性,生物蓄积性潜力较大,有远距离环境迁移能力,同时是一种环境雌激素,干扰动物及人类的激素分泌和代谢,因此被列为持久性有机污染物[2-6],将在全球范围内禁止生产和使用[7]。商品硫丹是2个空间异构体α-硫丹、β-硫丹2:1~7:3的混合物;其主要代谢物硫丹硫酸酯具有和硫丹相当的毒性,在环境中的半衰期更长,因此在药残监控检测中“硫丹”通常是指硫丹母体和其代谢物硫丹硫酸酯的混合残留物[1-2]。
硫丹可通过水环境或渔用配合饲料中的植物性原料等途径,污染养殖水产品,影响水产品质量安全[8]。自日本2006年5月实施《肯定列表》制度以来,检出多例从中国进口的鳗鲡和泥鳅的硫丹残留超标,受此影响,输日活鳗曾一度暂停[9]。输日水产品硫丹超标事件之后,国内研究者相继开展对水产品硫丹残留的检测方法研究[10-20],气相色谱-电子捕获检测器(gas chromatographyelectron capture detection,GC-ECD)[10-15]和气质联用(gas chromatography-mass spectrography,GC-MS)[16-19]是较为有效的检测方法。GC-ECD具有灵敏度高、定量准确、仪器配置要求较低、适合于未配备GC-MS的基层实验室开展日常检测等优点,但其定性受基质干扰影较大,对样品的净化程度要求较高。现有水产品中硫丹的GC-ECD检测方法在实际应用中,仍存在缺陷和不完善之处,如:样品前处理繁琐成本较高[12],方法的建立仅局限于特定水产品[10-13],检测目标物未包含代谢物[10-11,14-15],回收率偏低[14]等。本实验在综合分析近年报道的相关检测方法的基础上,研究以GC-ECD法,建立快捷实用、准确可靠、灵敏度达到国内外现行标准限量要求、适合于鱼类、甲壳类和贝类等水产品中硫丹及其代谢物硫丹硫酸酯残留量的检测方法。
1 材料与方法
1.1 试剂与仪器
α-硫丹(α-endosulfan,CAS编码:959-98-8)、β-硫丹(β-endosulfan,CAS编码:33213-65-9)标准溶液(质量浓度均为100μg/mL,不确定度均小于±0.16μg/mL) 农业部环境保护科研监测所;硫丹硫酸酯(endosulfan sulfate,CAS编码:1031-07-8,纯度98%,临用前用乙酸乙酯逐级稀释至适当浓度) 德国Dr.Ehrenstorfer公司;乙腈、乙酸乙酯为色谱纯;无水硫酸钠为分析纯(500℃灼烧4h);SEPAX固相萃取小柱:中性氧化铝小柱(2000mg/6mL)、石墨化碳黑-佛罗里硅土复合小柱(250mg/1000mg/6mL)。
6890N气相色谱仪(配有63Ni微电子捕获检测器(μ-ECD))、DB-1MS毛细管柱(30.0m×250μm,0.25μm) 美国Agilent公司;AB204-E 电子天平 梅特勒-托利多仪器(上海)有限公司;R205旋转蒸发仪 上海申生科技有限公司;MS3 旋涡混合器 德国IKA公司;KQ-250DE 数控超声波清洗器 昆山市超声仪器有限公司;LD4-8离心机 北京时代北利医用离心机有限公司;Alltech固相萃取装置 美国奥泰公司。
1.2 样品前处理方法
1.2.1 提取
取贝类的软组织、鱼和虾的肌肉,用均质机破碎混匀,置冰箱中2~6℃冷藏待测或-18℃冷冻暂存。称均质样品3g(准确至0.01g)于50mL具塞离心管,加无水硫酸钠6g,分散均匀,加乙腈-乙酸乙酯(1:4,V/V)混合液15mL,浸泡试样30min,超声10min,涡旋混合2min,2000r/min离心5min,上层有机相过无水硫酸钠(约10g)收集于鸡心瓶;用乙腈-乙酸乙酯混合液15mL,重复萃取试样一次,合并萃取液,于35℃水浴减压旋转蒸发至近干。
1.2.2 净化
鸡心瓶内加3mL乙腈,涡旋混合10~20s,-18℃冷冻30min以上。准备石墨化碳黑-佛罗里硅土复合小柱、中性氧化铝小柱各一支,依次串联固定于固相萃取装置上,在石墨化碳黑-佛罗里硅土复合小柱上装填无水硫酸钠约1cm高,用6mL乙腈活化小柱;取出冷冻鸡心瓶,立即将上层乙腈转入萃取小柱,控制流速1滴/s,开始收集流出液;用3mL冰冷的乙腈洗涤鸡心瓶,洗涤液并入小柱;再用10mL乙腈-乙酸乙酯(1:4,V/V)洗脱液淋洗层析柱;流出液转入25mL梨形瓶中,于35℃旋转减压浓缩至干,残渣用1mL乙酸乙酯溶解定容,供气相色谱分析。
1.3 气相色谱分析条件
色谱柱:DB-1MS(30m×250μm,0.25μm);检测器:ECD;载气:99.999%高纯氮气;载气流速:1.0mL/min;进样口温度:260℃;检测器的温度:300℃。色谱柱升温程序:初始温度100℃,保持1min,以30℃/min升至150℃,再以5℃/min升至185℃,然后以10℃/min升至280℃,保持5min。进样方式:不分流进样,进样量:1μL。
1.4 标准曲线制作
以乙酸乙酯为溶剂,配制硫丹系列标准混合溶液,α-硫丹、β-硫丹和硫丹硫酸酯质量浓度均分别为0.001、0.004、0.01、0.02、0.04、0.1、0.2μg/mL,进行气相色谱测定,以峰面积为纵坐标,以质量浓度为横坐标,绘制标准曲线,并计算线性相关系数。
1.5 方法验证
方法主要实验条件的确定后,分别以有代表性的水产品:南美白对虾(甲壳类)、草鱼(低脂鱼)、鳗鲡(高脂鱼)、僧帽牡蛎(贝类)空白样品为测试对象,进行加标回收实验,样品中α-硫丹、β-硫丹和硫丹硫酸酯的添加量分别为1、10μg/kg和20μg/kg,计算每个水平6次重复实验的回收率和相对标准偏差,以验证方法的适用性,评价方法的准确度、精密度和灵敏度,确定方法的最低定量限。
2 结果与分析
2.1 气相色谱分析条件优化
已报道的硫丹GC-ECD分析方法,色谱分离柱采用DB-5[10-11,13-15]和HP-1701[12],两者分别属于弱极性和中等极性柱,对硫丹及其代谢物均有较好的分离效果。滴滴涕是水产品基质常见的药残,同为有机氯农药,在样品前处理过程中和硫丹是共萃物,在气相色谱分析中,和硫丹出峰时间相近。实验分析了滴滴涕同系物和硫丹在DB-5、HP-1701中色谱分离行为,DB-5中,滴滴涕同系物o,p’-DDD和β-硫丹非常靠近,很难达到基线分离;HP-1701中,另一同系物p,p’-DDT和β-硫丹几乎重叠。但采用DB-1色谱柱,通过优化色谱升温程序,滴滴涕同系物和硫丹各组分均能完全达到基线分离,不形成对硫丹定性定量干扰。
色谱柱升温程序对仪器的灵敏度有较大的影响。硫丹气相色谱分析柱升温程序的起始温度大致有80℃[18]和160℃[15]两种模式,实验中发现,在升温速率(20℃/min)、载气流速(1.0mL/min)等其他色谱条件相同的情况下,以80℃为起始温度的升温模式,出峰时间较以160℃为起始温度的升温模式慢5min左右,但硫丹各组分峰高响应较后者高近4倍。权重考虑分析灵敏度及避开滴滴涕同系物干扰因素,兼顾节省分析时间,本方法采用100℃初始温度,升温程序为初始温度100℃,保持1min,以30℃/min升至150℃,再以5℃/min升至185℃,然后以10℃/min升至280℃,保持5min。图1为优化后的色谱条件的硫丹标准溶液(3ng/mL)气相色谱图,硫丹出峰时基线稳定,峰形尖锐对称,仪器的灵敏度高,一个样品的上机分析时间约20min。

图 1 硫丹及代谢物标准溶液色谱图(3ng/mL)Fig.1 GC chromatogram of standard solutions of endosulfan and its metabolite (3 ng/mL)
2.2 萃取剂的选择
萃取剂的选择原则是将样品中的目标物充分提取出来,对脂肪等杂质溶出又要尽可能小,降低后续样品净化的难度。由于硫丹易溶于多数有机溶剂,不溶于水,所以样品中硫丹的提取大都采用有机混合液萃取的方法,如:乙腈-乙酸乙酯(4:1,V/V)[11,15]、丙酮-正已烷(4:3.5,V/V)[12]、正已烷-丙酮(1:1,V/V)[13]、乙酸乙酯[10]、乙腈[14]等,选用乙酸乙酯、丙酮、正已烷可以获得很高的萃取率,但这些溶剂对脂肪的溶解度也较大,油脂含量高的样品如鳗鲡等,用GC-ECD检测,样品的本底干扰大,对目标物难于定性定量。乙腈对有机氯农药有较好的溶解度,但对大部分油脂的溶解性较差,在乙腈中加入适量的乙酸乙酯,可提高对目标物的萃取效果。通过实验比对,本方法选择乙腈-乙酸乙酯(4:1,V/V)为萃取剂。
2.3 净化方法研究
水产品种类多,基质复杂,高脂鱼如鳗鲡,脂肪含量约为30%,净化过程中,如何降低和除去脂肪是非常关键的步骤。凝胶渗透色谱(gel permeation chromatography,GPC)对鳗鲡样品的净化效果良好[12],但设备价格昂贵,溶剂的消耗量较大,过程繁琐费时。在参考前人研究的基础上[11,15],通过大量的实验摸索,本方法采用冷冻除脂、固相萃取(solid-phase extraction,SPE)的净化方案。
样品经乙腈-乙酸乙酯混合溶液萃取蒸干后,加入乙腈溶解,待测目标物溶于乙腈中,而大部分油脂都沉淀在底部和壁上,再通过冷冻以降低油脂在乙腈中的溶解度来达到去脂的效果。此方法可有效减少脂溶性杂质的干扰,但还不能达到上机检测的要求,所以采用固相萃取法,进一步去除油脂和其他干扰物质。实验选择油脂含量较高的鳗鲡为基质,以乙腈-乙酸乙酯(4:1,V/V)为洗脱液,对几种不同规格的SPE小柱的净化效果进行和比较:分别用1000mg/6mL佛罗里硅土、1000mg/6mL中性氧化铝、2000mg/6mL中性氧化铝小柱净化,净化效果均不够理想,α-硫丹的回收率偏高,而杂质峰对硫丹硫酸的定量影响更大,因此考虑将两种小柱串联使用。部分水产品,如甲壳类、某些贝类体含有色素,商品化的复合小柱如石墨化碳黑-佛罗里硅土复合柱(250mg/1000mg/6mL)使用起来非常方便,和2000mg/6mL中性氧化铝小柱串联,上层的石墨化碳黑-佛罗里硅土复合小柱上装填无水硫酸钠约1cm高,以去除样液中可能残余的少量水分。用这样串联小柱对样品进行净化,基质干扰基本消除,色素被完全吸附,达理想的净化效果。
为了使硫丹各组分从SPE柱完全洗脱下来,对洗脱剂用量进行优化实验。3g鳗鲡样品,按上述方法提取、冷冻除脂,添加硫丹各单体为60ng的混合标准溶液,样液过串联小柱,用乙腈-乙酸乙酯(4:1,V/V)淋洗,间隔2.5mL收集流出,洗脱曲线如图2所示,在洗脱体积为12.5mL时,各组分回收率达到85%以上,15mL时已检不出目标物,因此最佳洗脱体积为15mL。

图 2 硫丹的洗脱曲线Fig.2 Elution curve of endosulfan
2.4 方法的准确度和精密度
硫丹在南美白对虾、草鱼、僧帽牡蛎、鳗鲡空白样品中的加标回收实验结果如表1所示,α-硫丹的平均回收率74.1%~95.8%、相对标准偏差(RSD)为2.69%~7.33%;β-硫丹的平均回收率为74.9%~95.3%、RSD为1.22%~7.79%;硫丹硫酸酯平均回收率为86.3%~108%、RSD为2.38%~7.20%。结果表明,本方法的准确度、精密度符合药残检测技术要求,适用于鱼类、甲壳类和贝类水产品。

表 1 方法的平均回收率和精密度(n=6)Table 1 Recovery and precision of the method (n=6)
2.5 方法的线性范围、检出限和最低定量限

表 2 硫丹测定的线性回归方程、相关系数、检出限和定量下限Table 2 Linear equations, correlation coefficients, limits of detection, limits of quantification for α-endosulfan, β-endosulfan and endosulfan sulfate

图 3 空白对虾样品色谱图Fig.3 GC chromatogram of blank shrimp sample
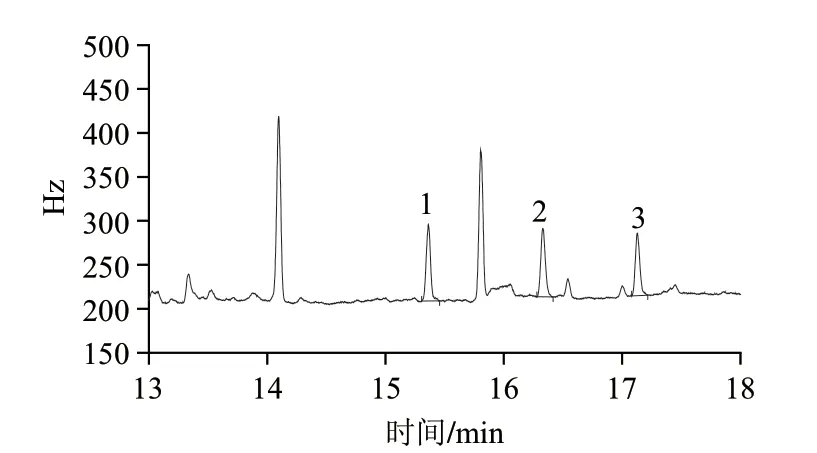
图 4 最低定量限水平(1μg/kg)的空白对虾样品加标色谱图Fig.4 GC chromatogram of blank shrimp sample spiked with endosulfan at the limit of quantification of 1 μg/kg
方法的线性范围、检出限和最低定量限如表2所示。硫丹各组分在0.001~0.2μg/mL范围内线性关系良好,相关系数不小于0.9996。方法检出限以空白样品信噪比不小于3估算,α-硫丹的检出限为0.035μg/kg,β-硫丹和硫丹硫酸酯的检出限均为0.06μg/kg。方法最低定量限的确定依据是样品的实际加标回收率在70%~120%之间,信噪比不小于10,精密度不大于15%;从表1可知,硫丹各组分加标量为1μg/kg时,α-硫丹、β-硫丹和硫丹硫酸酯的信噪比大于10,实际回收率78.2%~108%,相对标准偏差1.22%~7.79%,因此,本方法确定α-硫丹、β-硫丹和硫丹硫酸酯的最低定量限均为1.00μg/kg,低于日本肯定列表中水产品硫丹总量0.004mg/kg的限量要求[21]。空白对虾样品色谱图和最低定量限水平的空白对虾样品加标色谱图如图3、4所示。
3 结 论
本实验建立水产品中硫丹及其代谢物硫丹硫酸酯残留的GC-ECD检测方法。选择DB-1色谱分析柱,消除基质中可能存在的滴滴涕污染物对目标物定性定量的干扰;优化色谱升温程序,提高仪器对硫丹各组分的响应灵敏度;采用冷冻、佛罗里硅土-中性氧化铝固相萃取净化样品,有效地去除样品中的脂类等杂质。建立的分析方法稳定灵敏,可操作性强,适用于鱼类、甲壳类、贝类水产品,仪器配置、运行成本较低,适合基层实验室开展对水产品硫丹残留的日常检测。
[1] 李富根, 张文君, 王以燕. 硫丹的使用风险和管理动态[J]. 农药, 2009, 48(7): 542-544
[2] 徐甫, 周志俊. 硫丹的毒理学研究进展[J]. 环境与职业医学, 2011, 28(5): 319-320.
[3] CAPKIN E, ALTINOK I, KARAHAN S. Water quality and fish size affect toxicity of endosulfan, an organochlorine pesticide, to rainbow trout[J]. Chemosphere, 2006, 64: 1793-1800.
[4] MOON J M, CHUN B J. Acute endosulfan poisoning: a retrospective study[J]. Hum Exp Toxicol, 2009, 28(5): 309-316.
[5] WEBER J, HALSALL C J, MUIR D, et al. Endosulfan, a global pesticide: A review of its fate in the environment and occurrence in the Arctic[J]. Science of the Total Environment, 2010, 408(15): 2966-2984.
[6] SILVA M H, BEAUVAIS S L. Human health risk assessment of endosulfan Ⅰ: toxicology and hazard identification[J]. Regul Toxicol Pharmacol, 2010, 56(1): 4-17.
[7] 刘琴. 硫丹将全球禁用[J]. 农药市场信息, 2011(13): 7.
[8] 郭少忠. 关于鳗鱼硫丹残留初步调查的探讨[J]. 科学养鱼, 2006(10): 6-7.
[9] 肖乐、胡国成, 王峰. 硫丹超标事件再次说明了什么?[J]. 中国水产, 2006(9): 13-14.
[10] 刘晓松, 黄大新, 卢声宇. 毛细管气相色谱法测定南美白对堤虾中硫丹的残留量[J]. 色谱, 2007, 25(3): 392-394.
[11] 谢建军, 陈捷, 焦红, 等. 气相色谱法测定鳗鱼中残留的硫丹[J]. 色谱, 2007, 25(6): 951-952.
[12] 李爱军, 周晓, 张代辉, 等. 气相色谱法快速测定鱼肉中硫丹含量[J]. 饲料研究, 2007(6): 20-21.
[13] 陈树兵, 俞雪钧, 樊苑牧, 等. 冷冻去脂-固相萃取-气相色谱法快速测定水产品中硫丹、硫丹硫酸酯和溴氰菊酯残留量[J]. 分析试验室, 2008, 27(4): 80-83.
[14] 张金虎. 气相色谱法快速测定水产品中硫丹和溴氰菊酯残留量[J]. 水产科学, 2009, 28(11): 687-690.
[15] 柯常亮, 陈洁文, 林钦, 等. 鱼、虾、贝硫丹残留量的气相色谱分析[J]. 农药, 2009, 48(7): 515-518.
[16] 吴玉銮, 黄金凤, 杜志峰, 等. 出鳗鱼硫丹残留量的GC分析及GC-MS确证[J]. 食品与发酵工业, 2007, 33(5): 105-108.
[17] 葛宝坤, 陈其勇, 王伟, 等. 水生动物及水产品中硫丹及其代谢物残留量的气相色谱-质谱测定[J]. 分析测试学报, 2007, 26(6): 911-913.
[18] 韩丽, 郭德华, 邓晓军, 等. 气相色谱-负离子化学电离质谱法测定水产品中残留的硫丹及其代谢物[J]. 色谱, 2008, 27(4): 902-906.
[19] 高华鹏, 俞雪均, 沈维军, 等. 气相色谱-质谱法测定水产品中硫丹和毒死蜱的残留量[J]. 理化检验: 化学分册, 2009, 45(1): 85-87.
[20] 刘俊伟, 王俊平, 张鸿雁, 等. 虾中硫丹残留的酶联免疫吸附检测方法的研究[J]. 中国食品学报, 2009, 9(5): 191-194.
[21] 吴成业. 我国鳗业界应对日本“肯定列表”制度应采取的措施研究[J]. 中国水产, 2008(1): 66-68.

