果汁饮料中邻苯二甲酸二(2-乙基己基)酯的测定及其来源分析
杨春英,刘学铭,徐玉娟
(广东省农业科学院蚕业与农产品加工研究所,广东省农产品加工公共实验室,广东 广州 510610)
2011年4月,台湾爆发了堪称30年来最严重的食品掺毒事件——增塑剂邻苯二甲酸二(2-乙基己基)酯(bis(2-ethylhexyl) phthalate,DEHP)风波,这是继“三聚氰胺”后又一次重大食品安全危机,已经引起全球公众的极大关注。增塑剂,又称为邻苯二甲酸酯(phthalic acid esters,PAEs),是一种有毒的化工用塑料软化剂[1-3],其对人体的危害性远远大于三聚氰胺[4-6],PAEs通过呼吸、饮食和皮肤接触进入人体[7-8],长期接触邻苯二甲酸酯对外周神经系统有损伤作用,可引起多发性神经炎和感觉迟钝、麻木等症状,对中枢神经系统也有抑制和麻醉作用。常用的PAEs主要有邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丙烯酯(DAP)、DEHP、邻苯二甲酸二异壬酯(DINP)、邻苯二甲酸二异癸酯(DIDP)等[9-10]。其中,DEHP是一种使用最广泛的塑化剂[11],在塑胶材料中普遍使用[12]。DEHP的作用类似于人工荷尔蒙[13],会危害男性生殖能力并促使女性性早熟,长期摄入可引起生殖系统异常,甚至有造成畸胎、癌症的危险。含有DEHP的“起云剂”已被非法应用于部分饮料等产品的生产加工[14],必须重视对饮料等食品中的DEHP检测。
本研究建立D E H P 的气相色谱-质谱联用(g a s chromatography-mass spectrometry,GC-MS)检测方法,并利用该方法对市售不同包装规格果汁饮料(橙汁、葡萄汁、芒果汁、混合果汁)中DEHP的含量进行测定,同时对其进行溯源分析,以期为果汁饮料的安全性评价提供实验依据。
1 材料与方法
1.1 材料与试剂
橙汁、葡萄汁、芒果汁和混合果汁饮料(玻璃瓶装、500mL纸盒装和1000mL纸盒装) 市售。
DEHP标准品(>99.5%) 美国Sigma公司;正己烷、二氯甲烷、丙酮、乙酸乙酯、四氢呋喃、乙腈、甲醇均为色谱纯试剂;所用的水为超纯水。
准确称取0.1000g DEHP标准品于100mL棕色容量瓶中,用正己烷定容,配制成标准储备液,于4℃冰箱中保存备用。再根据需要逐级稀释,配成标准系列溶液。
1.2 仪器与设备
6890N/5975B气相色谱-质谱联用仪 美国Agilent公司;CW-2000超声-微波协同萃取仪 上海新拓分析仪器科技有限公司;Biofuge Stratos台式高速冷冻离心机 美国Themo公司;超声波发生器 宁波新芝生物科技股份有限公司;N-110S-W型旋转蒸发仪 东京理化器械株式会社;万分之一分析天平 德国赛多利斯公司;实验所用的器皿均为玻璃器皿,清洗干净后用丙酮浸泡2h烘干待用。
1.3 方法
1.3.1 气相色谱条件
色谱柱:J&W D B-5 M S U I 毛细管色谱柱(30m×0.25mm,0.25μm);进样口温度:250℃;进样量:1.0μL,不分流进样;载气:高纯氦气,流速为1.0mL/min;程序升温:初始温度60℃,保持1min,以20℃/min的升温速率升至220℃,保持1min,再以5℃/min的升温速率升至280℃,保持5min。
1.3.2 质谱条件
电子电离源(electron ionization,EI),电子能量70eV;离子源温度230℃;传输线温度280℃;质量范围40~500u,全扫描方式;溶剂延迟4min。
1.3.3 样品处理
考察提取溶剂(包括纯溶剂和混合溶剂)、提取方式及提取时间对样品中DEHP提取率的影响,最终确定样品处理方法。
1.3.3.1 果汁试样
采用两种处理方法:①按照国标[15]:取5.00mL果汁试样,加入2.00mL正己烷振荡萃取40min,取上层清液进行气相色谱-质谱分析;②国标[15]基础上修改:取50.00mL果汁饮料试样,加入等体积正己烷振荡萃取40min,取上层清液25.00mL,用氮气浓缩至1.0mL,进行GC-MS分析。
1.3.3.2 纸质包装盒的塑料薄膜
取完整一张塑料薄膜(纸盒内侧与果汁接触部分)裁剪成0.5cm×0.5cm大小碎片[16],准确称取2.0000g试样于具塞三角瓶中,每次加入15mL四氢呋喃-乙腈(1:1,V/V)的混合液,超声提取30min,过滤转移到50mL容量瓶,重复2次,合并滤液定容,待测。
1.3.3.3 纸质包装盒上的塑料盖
取5个完整塑料盖破碎成小于0.25cm×0.25cm颗粒[17],混合均匀后准确称取1.0000g试样于微波萃取管中,加入15mL正己烷-乙酸乙酯(1:1,V/V)的混合液,在100℃条件下微波提取40min,过滤转移到50mL容量瓶,残渣用少量混合液洗涤3次,合并滤液定容;取上述提取液20.00mL,用氮气浓缩至1.0mL,进行GC-MS分析。
以上处理均设空白对照。
1.3.4 定性和定量方法
为保证测定结果的准确性,本实验使用保留时间、标准品对照和质谱检索三者结合的定性方法;外标法峰面积定量。
2 结果与分析
2.1 标准曲线和检测限
按照本研究优化的实验条件,配制7个质量浓度水平(1.00、2.00、5.00、10.00、20.00、30.00、50.00mg/L)的标准溶液进行GC-MS分析,以峰面积Y对DEHP标样质量浓度X进行线性拟合,平行测定3次,得出线性拟合方程Y = 280986X-385822,DEHP质量浓度与峰面积呈良好的线性关系,r=0.9978;检测限为0.4mg/L(RSN=3)。
2.2 提取溶剂的选择
参考国内外关于DEHP提取与测定的报道[14-18],保持其他试验条件不变,比较正己烷、二氯甲烷、乙酸乙酯、四氢呋喃、乙腈5种不同纯溶剂及混合溶剂:正己烷-乙酸乙酯(1:1,V/V)、四氢呋喃-乙腈(1:1,V/V)、乙酸乙酯-乙腈(1:1,V/V)对样品中DEHP的提取效果。以DEHP回收率为判断依据,发现对于果汁饮料样品,正己烷、二氯甲烷的萃取率最高(回收率>90%),但提取时乳化现象比较严重,加入少量甲醇或者冷冻离心分离可大大改善这种状况,考虑到二氯甲烷毒性较大,故选用正己烷作为果汁样品的萃取剂;对于包装材料,单种溶剂不如使用混合溶剂提取效果好,实验最终确定四氢呋喃-乙腈(1:1,V/V)的混合体系作为塑料薄膜的提取溶剂,正己烷-乙酸乙酯(1:1,V/V)的混合体系作为塑料盖的提取溶剂,回收率均可达到80%以上。
2.3 提取方式和时间的选择
由于果汁饮料属于液态食品,故选用液-液萃取。实验证明:DEHP提取率随振荡萃取时间的延长而增加,振荡萃取时间为40min时,回收率可达到最高值(92.5%)。
塑料薄膜为软质材料,使用超声波有利DEHP的溶出,考察不同时间(10、20、30min和40min)、不同提取次数(1、2次和3次)对DEHP的提取效果,研究表明提取时间为30min时提取效果较好,且提取2次后DEHP提取量增加趋势不明显,故选用超声波提取时间为30min,提取次数为2次。
塑料盖为硬质材料,微波和高温条件下可加速DEHP的提取,考察不同温度(90、95、100℃和105℃)、不同提取时间(20、30、40min和50min)对DEHP提取效果的影响,证实在100℃条件下微波萃取40min即可提取完全(回收率达95.8%)。
2.4 方法的精密度和准确度
为了检验方法的准确度和精密度,对选取的样品进行高(10.0mg/L)、中(5.0mg/L)、低(1.0mg/L)3个不同水平的加标回收实验,每个水平分别做7份平行实验,计算平均回收率和相对标准偏差,结果见表1。
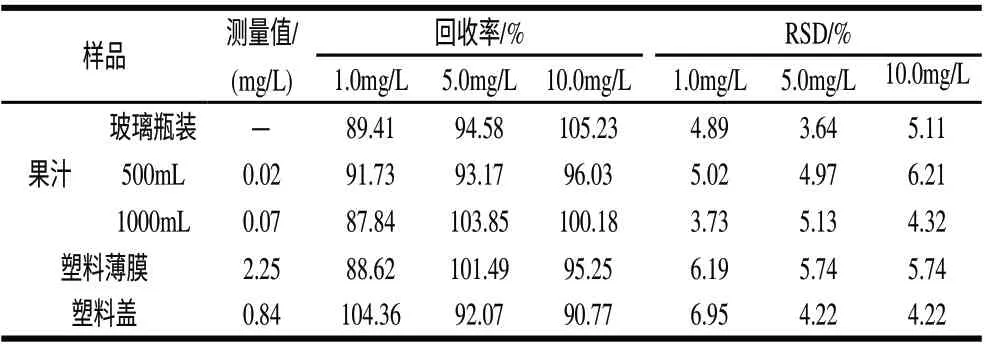
表 1 加标回收率及重复性实验结果(n=7)Table 1 Recovery and reproducibility of the analytical method (n=7)
由表1可知,样品加标回收率平均值达到87%以上,相对标准偏差(RSD)在3.64%~6.95%之间,可见,选用的方法具有较强的可靠性,能满足分析需要。
2.5 实际样品的测定及其来源分析
用本研究建立的最优化方法,对市售不同厂家生产的不同包装规格橙汁饮料样品中的DEHP进行分析,为追溯其来源,同时对其包装材料进行DEHP的测定,结果见图1,表2、3。

图 1 果汁样品(a)及其加标样(b)总离子流色谱图Fig.1 TIC of juice sample spiked or not with DEHP standard
由图1可见,本实验建立的方法能够实现样品中的DEHP与基体中其他组分的良好基线分离,样品的回收率较高。

表 2 果汁样品中DEHP含量的测定结果(n=3)Table 2 DEHP content in juice samples (n=3)μg/L

表 3 包装材料中DEHP含量的测定结果(n=3)Table 3 DEHP content in plastic packaging materials for juice (n=3)mg/kg
由表2、3可知,由于果汁样品中DEHP的含量较低,必须经过浓缩;除橙汁外,其余3种玻璃瓶装果汁饮料中始终未检测到DEHP,表明该果汁在加工过程中未使用DEHP或含有DEHP的“起云剂”,且原料并未受到污染;橙汁饮料经浓缩后检测到微量DEHP,分析其原因可能是加工过程中人为添加或者受污染,也可能是原材料受污染,其来源可能是橙子产地的土壤、大气及灌溉水源。纸盒装果汁饮料中检测到微量的DEHP,塑料包装材料中均检测到一定量DEHP,以塑料薄膜含量居高。由于果汁饮料在储存过程中长期与塑料薄膜直接接触,且接触面积较大,而瓶装饮料存放过程中基本瓶盖朝上放置,塑料盖与果汁的接触面积较小,接触概率也相对小,故初步认为果汁饮料中的DEHP主要是储藏过程中从包装材料中迁移污染的,其中塑料薄膜为主要污染因素;纸盒装橙汁饮料中DEHP含量是玻璃瓶装的3倍以上,也证实了包装材料中DEHP迁移污染,导致橙汁饮料中DEHP含量大大增加。DEHP等PAEs在塑料成型过程中是以氢键和范德华力与塑料连接,保留其独立的化学性质,随着使用时间的推移,可不断地释放至周围环境[19]。释放的DEHP可溶解在果汁饮料中,造成污染,影响产品质量。但从包装材料中迁移的DEHP含量极低,由于含量过低,经浓缩后才检出,不会对人体造成危害。
3 结 论
本实验针对果汁饮料及其包装材料中的DEHP提取技术和测定方法进行了研究,确定了最佳的分析测定条件,方法操作简单、重现性好、准确度高,能较好实现对实际样品的测定。通过对包装材料中DEHP含量的测定,对果汁饮料的塑化剂来源进行分析,为食品安全性和溯源评价提供了一定的参考价值。值得注意的是,企业在生产过程中应该考虑周全、注意各个生产环节,避免与DEHP等有害物质的接触污染,保障消费者的身体健康。
[1] ZHANG Lifei, DONG Liang, REN Lijun, et al. Concentration and source identification of polycyclic aromatic hydrocarbons and phthalic acid esters in the surface water of the Yangtze River Delta, China[J]. Journal of Environmental Sciences, 2012, 24(2): 335-342.
[2] SALIMA C J, LIUA H, KENNEDY J F. Comparative study of the adsorption on chitosan beads of phthalate esters and their degradation products [J]. Carbohydrate Polymers, 2010, 81(3): 640-644.
[3] LOHMANN R, GIOIA R, JONES K C, et al. Organochlorine pesticides and PAHs in the surface water and atmosphere of the North Atlantic and Arctic Ocean[J]. Environmental Science and Technology, 2009, 43(15): 5633-5639.
[4] 徐磊, 夏宁. 在线固相萃取/高效液相色谱法测定环境水样中的4种痕量邻苯二甲酸酯[J]. 分析测试学报, 2011, 30(5): 558-561.
[5] 陈如, 蒋晓琪, 王建平. 邻苯二甲酸酯及其生态毒性[J]. 印染助剂, 2010, 27(9): 52-56.
[6] 赵文华, 王永凤, 赵冬梅. 邻苯二甲酸酯环境行为和毒理性研究[J]. 福建分析测试, 2010, 19(2): 22-25.
[7] GUO Ying, WU Qian, KANNAN K. Phthalate metabolites in urine from China, and implications for human exposures[J]. Environment International, 2011, 37(5): 893-898.
[8] HEMANDEZ-DIAZ S, MITCHELL A A, KELLEY K E, et al. Medications as a potential source of exposure to phthalates in the US population[J]. Environ Health Perspect, 2009, 117(2): 185-189.
[9] 柴丽月, 辛志宏, 蔡晶, 等. 食品中邻苯二甲酸酯类增塑剂含量的测定[J]. 食品科学, 2008, 29(7): 362-365.
[10] NANNI N, FISELIER K, GROB K, et al. Contamination of vegetable oils marketed in Italy by phthalic acid esters[J]. Food Control, 2011, 22(2): 209-214.
[11] 刘芃岩, 高丽, 申杰, 等. 固相微萃取-气相色谱法测定白洋淀水样中的邻苯二甲酸酯类化合物[J]. 色谱, 2010, 28(5): 517-520.
[12] LI Hongna, ZHU Xiuping, JIANG Yi, et al. Comparative electrochemical degradation of phthalic acid esters using boron-doped diamond and Pt anodes[J]. Chemosphere, 2010, 80(8): 845-851.
[13] FOSTER P M. Disruption of reproductive development in male rat offspring following in utero exposure to phthalate esters[J]. Int J Andro, 2006, 29(1): 140-147.
[14] RANDY L S, WU W H. Rapid qualitative analysis of phthalates added to food and nutraceutical products by direct analysis in real timeorbitrap mass spectrometry[J]. Food Control, 2012, 25(1): 13-16.
[15] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 21911—2008 食品中邻苯二甲酸酯的测定[S]. 北京: 中国标准出版社, 2008.
[16] 楼佳. 快速溶剂萃取-气相色谱/质谱联用测定塑料桌布中的邻苯二甲酸酯[J]. 化学研究, 2011, 22(2): 65-67.
[17] 中华人民共和国国家质量监督检验检疫总局. SN/T 2249—2009 塑料及其制品中邻苯二甲酸酯类增塑剂的测定: 气相色谱-质谱法[S]. 北京: 中国标准出版社, 2009.
[18] 孙若男, 陈美瑜, 林竹光. 气相色谱-质谱联用同时测定蔬菜中16种邻苯二甲酸酯残留[J]. 分析试验室, 2010, 29(12): 73-76.
[19] 姚卫蓉, 俞晔, 阎微, 等. 食用油中邻苯二甲酸酯污染物的测定方法及其污染程度研究[J]. 中国油脂, 2010, 35(6): 38-41.

