利用Tol2 转座子构建转基因草金鱼初探
董颖 胡红霞 王巍 田照辉
(北京市水产科学研究所暨国家淡水渔业工程技术研究中心 农业部都市农业(北方)重点实验室,北京 100068)
转座子(transposon)是基因组上的一段具有一定长度的DNA 序列,其在自身编码的转座酶或逆转录酶的作用下,以“剪切/复制-粘贴”的方式在基因组中进行移动[1]。自1951 年McClintock[2]首次在玉米中发现AC/Ds(Activator/Dissociator)转座子以来,在细菌及多种真核生物中均发现有转座子的存在[3-6]。但是长期以来,对脊椎动物中转座子的研究和应用都还是空白。直到近十几年才有青鳉Tol1 和Tol2[7,8]、鲑鱼SB[9]以及金鱼Tgf2[10]等几例鱼类活性转座子发现的报道。
青鳉Tol2 转座子(Transposable element of Oryzias latipes,number 2)是脊椎动物中发现的第一例天然具有活性的转座子。Tol2 转座子属于hAT 超转座子家族,其自身包含编码转座酶的基因,能以“剪切-粘贴”的方式进行自主转座。自被发现以来,Tol2转座子已被成功应用于果蝇[11]、斑马鱼[12]、非洲爪蟾[13]和小鼠[14]等模式生物的转基因研究中,证明其具有一定的通用性。但是,Tol2 转座子在金鱼中的应用还未见报道。本研究采用PCR 的方法以质粒pCAgcGH 为模板扩增出一段含有草鱼生长激素(GH)5 个外显子、鲤鱼beta-actin 启动子及多个酶切位点的序列,并将这段序列与质粒pTol2-MCSEGFP 进行重组,得到重组质粒pTol2-GH-EGFP。采用显微注射的方法将重组质粒pTol2-GH-EGFP 与体外合成的Tol2 转座酶mRNA 一起注入草金鱼受精卵中,获得表达GH 基因和绿色荧光蛋白的转基因草金鱼。利用Tol2 转座子构建转基因草金鱼。
1 材料与方法
1.1 材料
1.1.1 试验动物 试验用草金鱼(Carassius auratus)购买自北京市通州区水产技术推广站。
1.1.2 主要试剂与试剂盒 内切酶BamH I、Xho I和Not I 购自NEB 公司。质粒提取试剂盒购自Omega 公司。胶回收试剂盒和基因组DNA 提取试剂盒购自Axygen 公司。mRNA 体外合成试剂盒(mMESSAGE mMACHINE® SP6 Kit)购自Invitrogen 公司。10×Holf’s 储 存 液:将1 g CaCl、20.5 g KCl 和3.5 g NaCl 加蒸馏水至1 L,煮沸储存。用时将10×储存液稀释至1×工作液,用气泵曝气过夜,并加入终浓度为10 万单位/L 的青霉素和5 万单位/L 的链霉素。使用1×Holf’s 工作液配置50 μg/mL 的胰酶溶液。
1.1.3 质粒载体 质粒pTol2-MCS-EGFP、pCSTol2由北京大学赵珏老师赠送;质粒pCAgcGH 由中科院水生生物研究所胡炜研究员提供。
1.1.4 主要仪器 凝胶成像系统为Bio-RAD 公司Gel Doc 2000 型产品,显微注射仪为ASI 公司MPPI3型产品,荧光显微成像系统为OLYMPUS 公司DP72型产品。
1.2 方法
1.2.1 载体构建 质粒pTol2-MCS-EGFP 含有绿色荧光蛋白基因GFP、Tol2 转座子和多个酶切位点。质粒pCAgcGH 含有草鱼生长激素基因(GH)的5 个外显子、鲤鱼beta-actin 启动子及多个酶切位点。因为质粒pTol2-MCS-EGFP(保留GFP 和Tol2 转座子序列)和质粒pCAgcGH(保留GH 的5 个外显子和鲤鱼beta-actin 启动子)待保留区域之间只有一个共同的酶切位点BamH I,所以针对质粒pCAgcGH 序列设计PCR 引物,从BamH I 酶切位点开始,跨GH的5 个外显子,并加酶切位点Xho I 的接头,引物序列为TGATGAAAATCGCTTAGGGA 和CCGCTCGAGAGGCTTTACACTTTATGCTT。使用上述引物对质粒pCAgcGH 进行扩增,使用胶回收试剂盒回收PCR 产物。再对回收后的扩增产物进行BamH I/Xho I 双酶切。纯化后与同样经双酶切处理的质粒pTol2-MCSEGFP 过夜连接,获得重组质粒,命名为pTol2-GHEGFP。根据质粒pCAgcGH 保留区序列及插入方向,设计一对检测引物,序列为CGCAACCCTCAGGTAAGT 和TCTTCAACAACGCAGTCA。将重组质粒pTol2-GH-EGFP 转入大肠杆菌DH10B 感受态细胞,涂于LB 平板培养基过夜培养,选取氨苄阳性的单克隆接入LB 液体培养基,并使用检测引物对菌液进行扩增验证,使用质粒提取试剂盒从可以成功扩增检测引物的菌株中提取质粒pTol2-GH-EGFP,并进行测序验证。
1.2.2 转座子mRNA 的合成 使用Not I 内切酶对质粒pCSTol2 进行酶切,使其线性化,用SP6 RNA聚合酶在体外转录合成Tol2 转座酶mRNA。
1.2.3 转基因草金鱼的获得及验证 选取自然性成熟的雌雄草金鱼,采用人工干法授精的方式获得受精卵。将受精卵置于1×Holf’s 工作液,受精后约2-3 min 开始举膜,待举膜比较完全后将Holf’s 工作液替换为胰酶溶液溶解卵膜,待卵脱膜以后用Holf’s 工作液清洗几次,将其转移到提前铺好琼脂糖并加有Holf’s 工作液的表面皿里。将质粒pTol2-GH-EGFP 与体外合成的Tol2 转座酶mRNA 按终浓度100 ng/μL 和70 ng/μL 进行混合,在受精卵第一次卵裂前,通过显微注射的方法注射入动物极。之后将卵转移到18℃的1×Holf’s 工作液中培养,鱼苗孵出后,在荧光显微镜下挑选发出绿色荧光的个体,获得转基因草金鱼。孵化2 周后,取几尾能发出绿色荧光的鱼苗,使用基因组DNA 提取试剂盒提取DNA,并以此为模板使用检测引物进行PCR,检验其中是否含有转入的外源基因。
2 结果
2.1 载体构建
设计PCR 引物扩增出质粒pCAgcGH 的一段序列,同时引入Xho I 酶切位点,得到4 330 bp 的扩增产物。回收并纯化PCR 产物,再进行BamH I/Xho I 双酶切,之后与经同样双酶切处理的质粒pTol2-MCS-EGFP 进行连接,获得重组质粒pTol2-GHEGFP。双酶切电泳分析结果见图1。
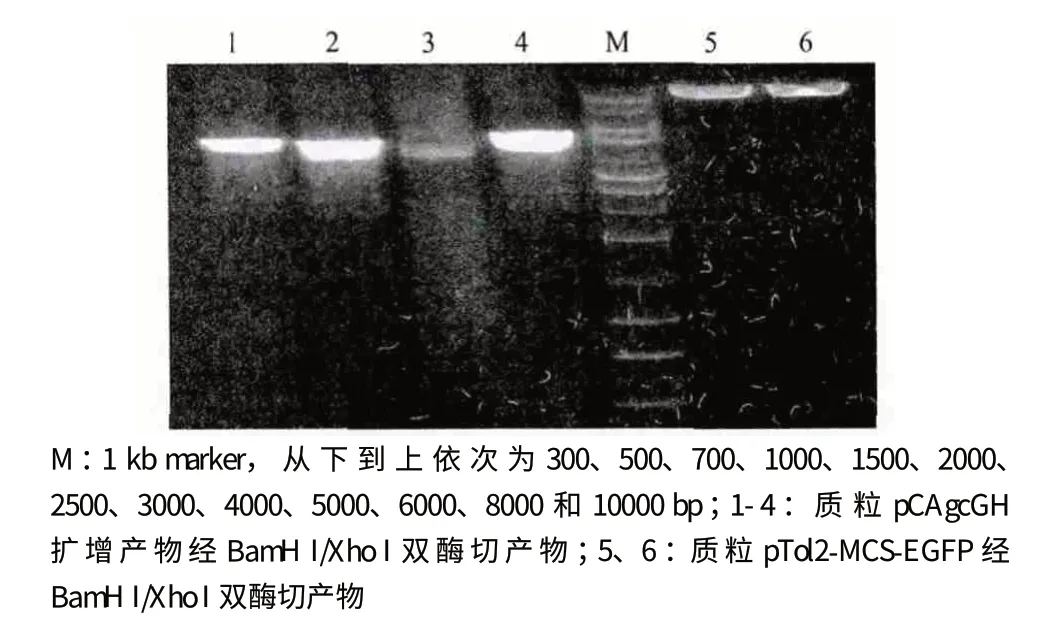
图1 质粒pCAgcGH 扩增产物和质粒pTol2-MCS-EGFP的双酶切鉴定
2.2 载体验证及阳性转基因鱼检测
将重组质粒pTol2-GH-EGFP 转入大肠杆菌DH10B 感受态细胞,挑选氨苄阳性的菌落,使用本实验设计的草鱼GH 检测引物进行PCR 扩增,得到长度为1 580 bp 的扩增产物,证明重组质粒中包含有GH 基因,结果见图2 泳道1-5。设计测序引物对重组质粒pTol2-GH-EGFP(图3)进行测序,确保其中即含有Tol2 转座子和绿色荧光蛋白(GFP)基因,又含有草鱼生长激素(GH)基因的5 个外显子。取3 尾能发出绿色荧光的转基因鱼提取基因组DNA,以此为模板使用同样的检测引物进行PCR,得到长度为1 580 bp 的扩增产物,证明其中均含有转入的外源基因,结果见图2 泳道6-8。
2.3 转基因草金鱼的获得及验证
在紫外光下,最早可以于受精后21.5 h 观察到部分胚胎发出微弱的绿色荧光。在进行了显微注射的150 粒受精卵中共有133 尾仔鱼成功孵化,其中有26 尾可以在紫外光下观察到绿色荧光,占总数的17.3%。图4 为不同时期的转基因草金鱼荧光检测结果。
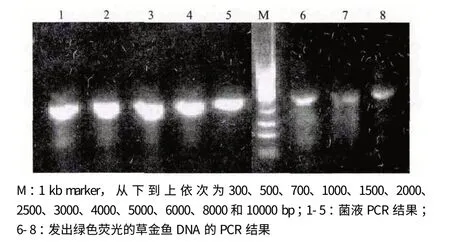
图2 重组质粒pTol2-GH-EGFP 菌液及转基因鱼外源基因检验结果
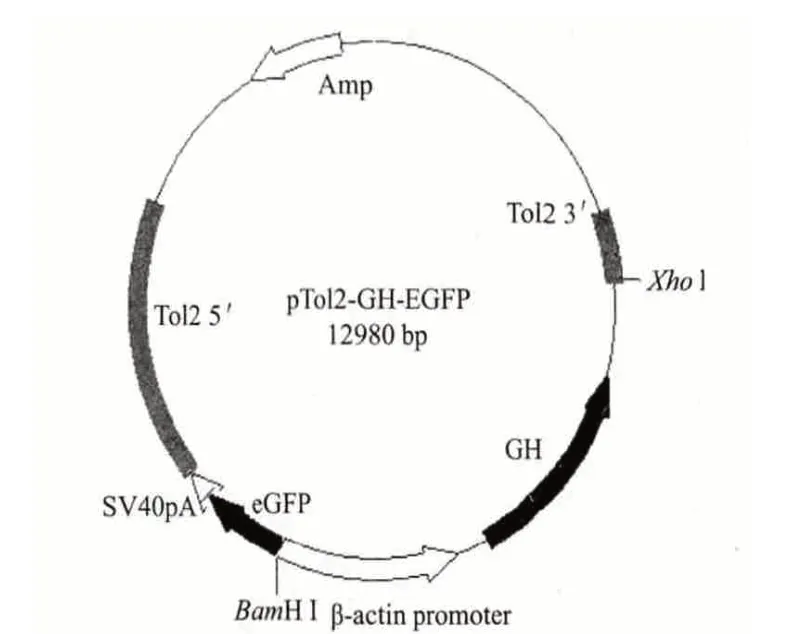
图3 质粒pTol2-GH-EGFP 图谱
3 讨论
3.1 转基因方法的比较
自朱作言等[15]利用显微注射法首次成功构建转基因鱼模型以来,显微注射法就被广泛应用于鱼类转基因研究中。除此之外,电脉冲(电穿孔)法[16]和精子载体法[17]也是比较常用的鱼类转基因方法。另外,还有磷酸钙共沉淀、脂质体融合、逆转录病毒转染、微弹轰击、激光介导和基因枪(粒子枪)等多种方法可以将外源基因导入受体细胞[18]。
显微注射法是目前被使用最多的转基因操作方法,它具有转基因阳性率较高的优点,但同时对试验者的操作技能要求较高,而且因为要在第一次卵裂前完成注射,所以一批次只能处理比较少的卵,相对费时费力。而电脉冲法虽然阳性率略低[19],但一次可以处理大量受精卵,且试验操作简单,省时省力。精子载体法不会对卵造成机械损伤,外源基因导入与受精过程同步完成,但是由于精子载体法的作用机理尚不明确,导入的外源基因可能会被降解或不能整合到基因组中去,而是更多的以附加体的形式存在[20],且转基因阳性率差异巨大,难以控制。
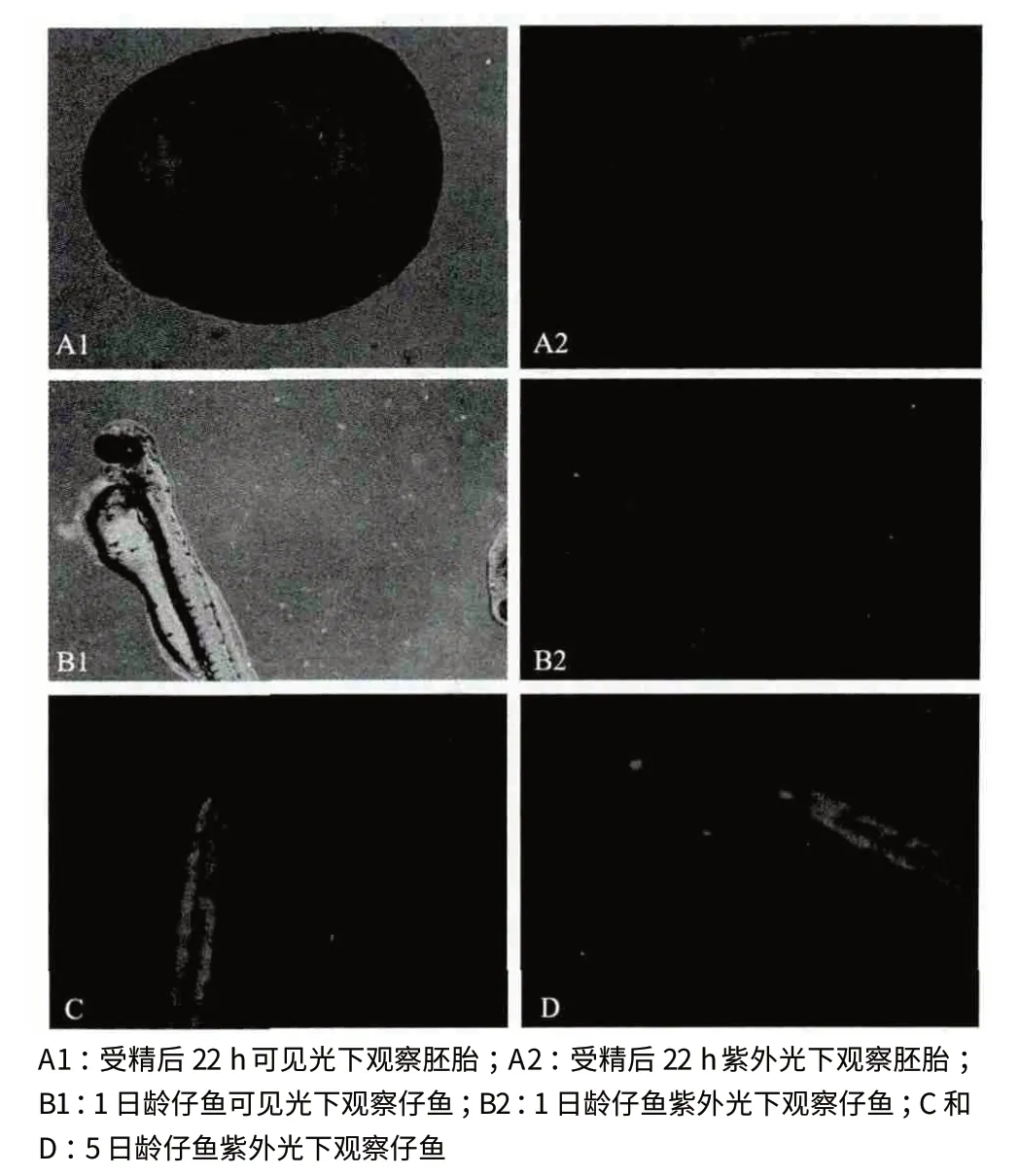
图4 胚胎及仔鱼期转基因草金鱼荧光检测结果
Sumiyama 等[21]首次将携带有外源基因的Tol2转座子载体与体外合成的转座酶mRNA 一起注射入小鼠受精卵的细胞质中,该方法可以较大幅度的提高外源基因的整合效率。本研究首次用此方法构建金鱼转基因方法,外源基因的表达率为17.3%,与Sumiyama 等[21]的20%阳性检出率差异不大,都显著高于常规显微注射转基因方法2%-5%的阳性检出率。
3.2 青鳉Tol2转座子的研究和应用
Tol2 转座子是日本学者在对正常日本青鳉(Oryzias latipes)与其白化变种的酪氨酸酶基因进行比较分析时发现的[8],它是脊椎动物中发现的第一例天然具有活性的转座子。Tol2 转座子属于hAT 转座子超家族,这个转座子超家族还包括玉米的Ac 转座子[22]、果蝇的hobo 转座子[23]、金鱼草的Tam3转座子[24]和金鱼的Tgf2 转座子[10]。Tol2 转座子全长4 681 bp,其自身包含一个由4 个外显子构成的编码转座酶的基因,它能翻译成一个含有649 个氨基酸的蛋白质,并催化Tol2 转座子以“剪切-粘贴”的方式在基因组中进行自主移动[8,25]。利用Tol2 转座子开展鱼类转基因研究,转基因效率较高,可携带大片段外源基因转入,畸形率较低,整合位点便于检测,同时不会引入质粒骨架而干扰鱼类正常基因的表达。
Kawakami 等[26]以绿色荧光蛋白基因GFP 作为报告基因,通过显微注射将带有Tol2 转座子和GFP基因的质粒和人工合成的编码转座酶的mRNA 一起注入到斑马鱼受精卵中,使转座子稳定地整合到基因组中,挑选含有外源基因的转基因斑马鱼作为亲本与野生型进行杂交,检测F1 代发现有50%-70%为转基因阳性。上述试验表明外源基因通过Tol2 转座子整合到宿主基因组上,并可以遗传到下一代。在对吕宋青鳉(O. luzonensis)(日本青鳉的近缘种,但是自身不含Tol2 转座子)的类似试验中也获得了相同的结果[27]。此外,Tol2 转座子也被成功应用于果蝇[11]、非洲爪蟾[13]、鸡[28]和小鼠[14]等动物的转基因研究中。
利用Tol2 转座子可以构建具有组织特异表达能力的转基因载体,如脊髓特异表达[29]或心脏组织特异表达[30]转基因斑马鱼家系的建立就对研究这两个组织的发育调控和基因表达具有重要意义。
Kawakami 等[31]利用Tol2 转座子对斑马鱼进行基因捕获研究,他们将带有报告基因GFP 的重组质粒随机整合到斑马鱼基因组中,然后通过反向PCR 的方法鉴定了捕获载体插入位点上下游的基因序列,再利用RACE 的方法获得了8 种报告基因与内源基因的融合转录本。Parinov 等[32]利用Tol2 转座子进行斑马鱼增强子捕获,以增强型绿色荧光蛋白(EGFP)基因为报告基因挑选出37 个阳性鱼苗,并以此为基础分离出28 个转基因斑马鱼家系用以研究斑马鱼的体内发育调控。Asakawa 和Kawakami[33]利用上游激活序列(Upstream activating sequence,UAS)的转录激活因子Gal4FF 构建载体进行基因捕获与增强子捕获,当有内源基因被捕获时转录激活因子得以表达,而将基因捕获个体与带有报告基因的转基因斑马鱼品系UAS-GFP 杂交后,转录激活因子可以刺激报告基因强烈表达。
目前,Tol2 转座子已经被成功应用于包括昆虫、两栖类、鱼类、鸟类以及哺乳动物等多种动物的转基因表达、基因捕获以及增强子捕获等方面的研究中,其中在模式生物斑马鱼上的研究成果最多。本研究利用Tol2 转座子成功构建转基因草金鱼,扩大了Tol2 转座子的应用范围,并为进一步开展关于基因捕获及其功能等方面的研究奠定了基础。
3.3 Tol2转座子对金鱼转基因阳性率的影响
Liu 等[34]利用显微注射法将含有猪生长激素基因的线性DNA 片段注入金鱼受精卵,其转基因阳性率为2%。刘艳红等[35]采用显微注射的方法将绿色荧光蛋白(GFP)基因重组表达质粒导入金鱼受精卵中,3 批试验获得的转基因阳性率分别为4.24%、8.51%和6.77%。胡莹莹等[36]利用精子载体法通过昆虫piggyBac 转座子介导成功获得转基因金鱼,但是其阳性率极低(小于1%)。而本试验通过显微注射法将带有Tol2 转座子和外源基因的质粒与体外合成的Tol2 转座酶mRNA 一起注入到金鱼受精卵中,获得转基因金鱼的阳性率为17.3%,显著高于未使用Tol2 转座子介导的转基因方法,说明Tol2 转座子在构建转基因金鱼的过程中有助于提高转基因效率。另外,利用新发现的金鱼Tgf2 转座子系统开展金鱼转基因试验获得的荧光率为83%[37],这可能是由于金鱼受精卵的细胞质中具有内源性的Tgf2 转座酶mRNA,而大量的转座酶mRNA 有助于提高转座子的转座效率。因此,可尝试通过加大Tol2 转座酶mRNA 的注射量来提高其在金鱼中的转基因阳性率。另外,外源基因的注射浓度以及质粒与转座酶mRNA 的混合比例也将在进一步试验中进行调整,以期提高外源基因的表达阳性率。
3.4 青鳉Tol2转座子与金鱼Tgf2转座子的比较
2010 年,邹曙明等[10]在我国不同品系金鱼中发现hAT 家族的一个新成员,命名为金鱼Tgf2 转座子,它是脊椎动物中发现的第二例具有自主活性的转座子。金鱼Tgf2 转座子全长4720 bp,由4 个阅读框组成,它与青鳉Tol2 转座子的序列相似度为97%,且都含有末端倒位重复、亚末端重复和内含子中间倒位重复序列。但是两者的末端倒位重复和亚末端重复序列存在一定差异,而这一区域恰好与转座子的转座活性密切相关[38]。另外,金鱼Tol2转座子第一内含子的1 453 bp 到2 091 bp 区域为反向重复序列,与青鳉Tol2 转座子中间反向重复序列可形成茎环结构不同,Tgf2 转座子的中间反向重复序列可形成“十”字结构,这也可能对其转座活性产生影响。目前,对金鱼Tgf2 转座子的研究尚处于起步阶段。考虑到Tol2 转座子和Tgf2 转座子的相似性,Tol2 转座子在金鱼中的应用将对研究Tgf2 转座子具有一定的积极作用。同时,对二者的比较研究也将有助于了解转座子序列及结构的功能。
4 结论
本研究采用PCR 的方法以质粒pCAgcGH 为模板扩增出一段含有草鱼生长激素(GH)5 个外显子、鲤鱼beta-actin 启动子及多个酶切位点的序列,并将这段序列与质粒pTol2-MCS-EGFP 进行重组,得到重组质粒pTol2-GH-EGFP。采用显微注射的方法将重组质粒pTol2-GH-EGFP 与体外合成的Tol2 转座酶mRNA 一起注入草金鱼受精卵中,获得表达GH基因和绿色荧光蛋白的转基因草金鱼,表达率为17.3%。
致谢:
感谢中科院水生生物研究所胡炜研究员提供草鱼GH 质粒;感谢北京大学朱作言院士实验室赵珏博士提供的Tol2 转座子及实验过程中给与的帮助。
[1] Curcio MJ, Derbyshire KM. The outs and ins of transposition:from mu to kangaroo[J]. Nature Reviews Molecular Cell Biology, 2003, 4(11):865-877.
[2] McClintock B. Chromosome organization and genic expression[J]. Cold Spring Harbor Symposia on Quantitative Biology, 1951, 16:13-47.
[3] Franz G, Savakis C. Minos, a new transposable element from Drosophila hydei, is a member of the Tc1-like family of transposons[J]. Nucleic Acids Research, 1991, 19(23):6646.
[4] Hirochika H, Fukuchi A. Transposable elements in rice plants [J]. Jpn Agr Res Q, 1992, 25:230-237.
[5] Amutan M, Nyyssonen E, Stubbs J, et al. Identification and cloning of a mobile transposon from Aspergillus niger var. awamori[J]. Current Genetics, 1996, 29(5):468-473.
[6] Nagy Z, Chandler M. Regulation of transposition in bacteria[J]. Research in Microbiology, 2004, 155:387-398.
[7] Koga A, Inagaki H, Bessho Y, et al. Insertion of a novel transposable element in the tyrosinase gene is responsible for an albino mutation in the medaka fish, Oryzias latipes[J]. Molecular and General Genetics, 1995, 249(4):400-405.
[8] Koga A, Suzuki M, Inagaki H, et al. Transposable element in fish[J]. Nature, 1996, 383:30.
[9] Ivics Z, Hackett PB, Plasterk RH, et al. Molecular reconstruction of sleeping beauty, a Tc1-like transposon from fish, and its transposition in human cells[J]. Cell, 1997, 91:501-510.
[10] 邹曙明, 杜雪地, 袁剑, 等. 金鱼hAT 家族转座子Tgf2 的克隆及其结构[J]. 遗传, 2010, 32:1203-1208.
[11] Urasaki A, Mito T, Noji S, et al. Transposition of the vertebrate Tol2 transposable element in Drosophila melanogaster[J]. Gene, 2008, 425:64-68.
[12] Kawakami K, Koga A, Hori H, et al. Excision of the Tol2 transposable element of the medaka fish, Oryzias latipes, in zebrafish, Danio rerio[J]. Gene, 1998, 225:17-22.
[13] Kawakami K, Imanaka K, Itoh M, Taira M. Excision of the Tol2 transposable element of the medaka fish Oryzias latipes in Xenopus laevis and Xenopus tropicalis[J]. Gene, 2004, 338(1):93-98.
[14] Kawakami K, Noda T. Transposition of the Tol2 element, an Ac-like element from the Japanese medaka fish Oryzias latipes, in mouse embryonic stem cells[J]. Genetics, 2004, 166(2):895-899.
[15] 朱作言, 许克圣, 谢岳峰, 等. 转基因鱼模型的建立[J]. 中国科学(B 辑), 1989, 2:147-155.
[16] 谢岳峰, 刘东, 邹钧, 等. 泥鳅受精卵的电脉冲基因转移[J]. 水生生物学报, 1989, 13(4):387-389.
[17] 于建康, 阎维. 精子介导鱼类基因转移和聚合酶链反应检测技术[J]. 动物学报, 1994, 40(1):96-99.
[18] 朱作言, 汪亚平. 转基因鱼. 生物学通报[J] , 1999, 34(5):1-3.
[19] 柳晓瑜, 王豪博, 仇雪梅, 等. 斑马鱼两种转基因方法的比较[J]. 生物技术通报, 2011(12):205-209.
[20] Nakanishi A, Iritani A. Gene transfer in the chicken by sperm-mediated methods[J]. Molecular Reproduction and Development, 1993, 36:358-261.
[21] Sumiyama K, Kawakami K, Yagita K. A simple and highly efficient transgenesis method in mice with the Tol2 transposon system and cytoplasmic microinjection[J]. Genomics, 2010, 95(5):306-311.
[22] Rosen E, Sivertsen A, Firtel RA. An unusual transposon encoding heat shock inducible and developmentally regulated transcripts in Dictyostelium[J]. Cell, 1983, 35(1):243-251.
[23] Streck RD, MacGaffey JE, Beckendorf SK. The structure of hobo transposable elements and their insertion sites[J]. The EMBO Journal, 1986, 5(13):3615-3623.
[24] Sommer H, Carpenter R, Harrison RJ, et al. The transposable element Tam3 of Antirrhinum majus generates a novel type of sequence alterations upon excision[J]. Molecular and General Genetics MGG, 1985, 199(2):225-231.
[25] Kawakami K. Tol2:a versatile gene transfer vector in vertebrates[J]. Genome Biology, 2007, 8(Suppl 1):S7.
[26] Kawakami K, Shima A, Kawakami N. Identification of a functional transposase of the Tol2 element, an Ac-like element from the Japanese medaka fish, and its transposition in the zebrafish germ lineage[J]. Proceedings of the National Academy of Sciences, 2000, 97(21):11403-11408.
[27] Koga A, Hori H, Sakaizumi M. Gene transfer and cloning of flanking chromosomal regions using the medaka fish Tol2 transposable element[J]. Marine Biotechnology, 2002, 4(1):6-11.
[28] Sato Y, Kasai T, Nakagawa S, et al. Stable integration and conditional expression of electroporated transgenes in chicken embryos[J]. Developmental Biology, 2007, 305(2):616-624.
[29] Suster ML, Kikuta H, Urasaki A, et al. Transgenesis in zebrafish with the Tol2 transposon system[M]//Cartwright EJ. Transgenesis Techniques, Humana Press, 2009, 561:41-63.
[30] 陈婷芳, 罗娜, 谢华平, 等. 利用Tol2 转座子构建斑马鱼心脏组织特异表达转基因载体及其表达分析[J]. 生物工程学报, 2010, 26(2):230-236.
[31] Kawakami K, Takeda H, Kawakami N, et al. A transposon-mediated gene trap approach identifies developmentally regulated genes in zebrafish[J]. Developmental Cell, 2004, 7(1):133-144.
[32] Parinov S, Kondrichin I, Korzh V, et al. Tol2 transposon-mediated enhancer trap to identify developmentally regulated zebrafish genes in vivo[J]. Developmental Dynamics, 2004, 231(2):449-459.
[33] Asakawa K, Kawakami K. The Tol2-mediated Gal4-UAS method for gene and enhancer trapping in zebrafish[J]. Methods, 2009, 49(3):275-281.
[34] Liu GS, Zhang ZH, et al. Study on integration, expression and biological effects of porcine growth hormone gene in transgenic goldfish[J]. Developmental and Reproductive Biology, 1998, 7(1):25-31.
[35] 刘艳红, 肖调义, 苏建明, 等. 用显微注射法将绿色荧光蛋白基因导入金鱼受精卵中表达[J]. 上海水产大学学报, 2002, 11(2):102-105.
[36] 胡莹莹, 郭学双, 周阳, 等. piggyBac 转座子在金鱼及泥鳅转基因中的应用[J]. 水产学报, 2012, 36(10):1473-1481.
[37] 杜雪地. 金鱼Tgf2 转座子的研究及其转基因应用[D]. 上海:上海海洋大学, 2011.
[38] Urasaki A, Morvan G, Kawakami K. Functional dissection of the Tol2 transposable element identified the minimal cis-sequence and a highly repetitive sequence in the sub-terminal region essential for transposition[J]. Genetics, 2006, 174(2):639-649.

