燕麦β-葡聚糖-表没食子儿茶素没食子酸酯复合物的体外稳定性
马雅钦,高瑞萍,2,刘 嘉,赵国华,3,*
(1.西南大学食品科学学院,重庆 400715;2.遵义医学院公共卫生学院,贵州 遵义 563000;3.重庆市农产品加工技术重点实验室,重庆 400715)
燕麦β-葡聚糖-表没食子儿茶素没食子酸酯复合物的体外稳定性
马雅钦1,高瑞萍1,2,刘 嘉1,赵国华1,3,*
(1.西南大学食品科学学院,重庆 400715;2.遵义医学院公共卫生学院,贵州 遵义 563000;3.重庆市农产品加工技术重点实验室,重庆 400715)
为研究燕麦β-葡聚糖-表没食子儿茶素没食子酸酯复合物在模拟胃肠液中的稳定性,采用真空冷冻干燥法制备燕麦β-葡聚糖-表没食子儿茶素没食子酸酯复合物。在模拟胃肠液中通过不同pH值和复合物质量浓度,探讨在胃肠液中pH值和复合物质量浓度对于复合物稳定性的影响。结果表明:在胃液和肠液中,pH值越低,复合物越稳定。由于进食会使得胃肠液的pH值增大,表明在禁食状态下复合物状态更稳定。复合物质量浓度越大,其在胃肠液中的稳定性越高,且达到在0.8 mg/L时,180 min孵育后复合物稳定性均达到80%以上。由此表明可以通过适当增大复合物的质量浓度来提高胃肠液的稳定性。
燕麦β-葡聚糖;表没食子儿茶素没食子酸酯;复合物;模拟胃肠液;稳定性
目前,膳食纤维与多酚形成的复合物在医药、食品领域的应用备受关注[1]。多酚和多糖可以通过氢键、疏水相互作用、共价键相互作用结合[2]。多糖多酚复合物在调节胃肠道中多酚的游离浓度方面起着重要的作用[3-6]。燕麦β-葡聚糖作为一种可溶性膳食纤维,主要以细胞结构成分的形式存在[7-10]。表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是茶多酚中主要功能成分,具有增强机体抵抗力、抗氧化性、抗癌、降血糖血脂等生理功能[10-15]。前期研究表明β-葡聚糖可吸附茶多酚形成复合物[16],而且在合适浓度下二者的复合作用在产物的抗氧化性影响方面表现为增效作用[17]。人工模拟胃肠液中pH值和儿茶素浓度对其稳定性具有较大影响[18]。但pH值和复合物质量浓度对于燕麦β-葡聚糖-EGCG复合物的影响尚不清楚。利用燕麦β-葡聚糖-EGCG复合物为实验材料,通过不同pH值梯度和不同复合物质量浓度的模拟胃肠液,探讨在胃肠液中pH值和复合物质量浓度对于复合物稳定性的影响,以期为探讨β-葡聚糖-EGCG复合物的体内生物学作用提供参考。
1 材料与方法
1.1 材料与试剂
燕麦β-葡聚糖 郑州荔诺生物科技公司。
EGCG 杭州禾田生物科技有限公司;胃蛋白酶(1∶10 000)、胰蛋白酶(1∶1 000) 美国Sigma公司;色谱甲醇 天津四友化学试剂有限公司;其他试剂均为分析纯 成都科龙试剂有限公司。
1.2 仪器与设备
WS-26恒温水浴锅 上海齐欣科学仪器有限公司;PB-10标准型电化学分析仪、pH计(酸度计) 德国赛多利斯公司;ALPHA 1-4/2 -4LSC真空冷冻干燥机 德国Christ公司;LC-20A高效液相色谱仪 日本岛津公司。
1.3 方法
1.3.1 燕麦β-葡聚糖-EGCG复合物制备
参照实验前期的方法制备燕麦β-葡聚糖-EGCG复合物[16]。将2 mL 0.7 mg/mL的EGCG和6 mL 0.5 mg/mL葡聚糖(均溶于pH 5.80、0.1 mol/L的PBS溶液)置于经处理的透析袋内,将透析袋浸入30 mL pH 5.80、0.1 mol/L的PBS溶液,50 ℃透析16 h后将透析袋于流水透析24 h后再用超纯水透析24 h以除去其中的磷酸盐。把透析袋内溶液进行冷冻干燥得复合物,于4 ℃避光保存备用。
1.3.2 EGCG的测定
游离的E GCG采用高效液相色谱法(high performance liquid chromatography,HPLC)方法测定。具体测定条件参考肖俊松等[19]并进行优化:色谱柱为Hypersil BDS(4.6 mm×250 mm)。流动相A为100%甲醇,流动相B为2%乙酸溶液,采用等度洗脱10 min,流动相由甲醇(A)、2%的乙酸(B),体积比为25∶75,流速0.9 mL/min,检测波长278 nm。复合物中EGCG的含量测定参照Tosh等[21]的酸水解方法并加以改进,称取100 mg在1.3.1节中制备的复合物溶解在100 mL超纯水中,加1.0 mol/L的盐酸调至pH 1.0,在70 ℃孵育50 min,冰浴中冷却至室温,用2 mol/L的NaOH调节至中性pH 6~7,将溶液经0.45 μm滤膜过滤后,HPLC测定EGCG含量即为复合物中的EGCG含量[20]。
1.3.3 复合物稳定性表示与计算
复合物的稳定性用复合物中EGCG的保留率表示,按照下式计算:
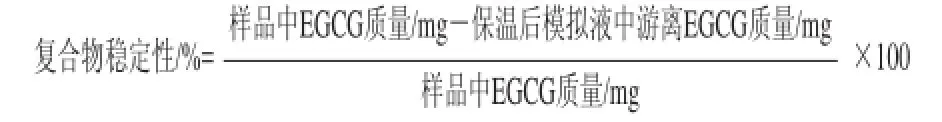
1.3.4 模拟胃肠液的制备
参照Hussain等[22]的方法配制胃肠液。模拟胃液的配制方法是称取3.2 g胃蛋白酶和7 mL 37% HCl加入1 L的容量瓶,用超纯水定容;模拟肠液的配制方法是称取6.8 g磷酸二氢钾溶于1 L超纯水,加入3.2 g胰蛋白酶,NaOH调节pH 6.8。
1.3.5 体外模拟胃肠液的pH值对复合物稳定性的影响
用HCl和NaOH对胃肠液的pH值进行调节,使胃液pH值为1.5~4.0,肠液pH值为5~8,称取12.5 mg复合物分别溶于25 mL不同pH值的胃液和肠液配成0.5 mg/mL的溶液,摇匀,于37 ℃保温30~180 min,经0.45 μm滤膜过滤后测定游离的EGCG。
1.3.6 复合物质量浓度对其在模拟胃肠液中稳定性的影响
分别称取12.5、15、17.5、20、22.5、25 mg复合物于pH 1.5的胃液和pH 6.8的肠液配制0.5~1.0 mg/mL的溶液,于37 ℃保温30~180 min。经0.45 μm滤膜后HPLC测定解离的EGCG的量。
1.4 数据处理
以上实验均重复3次,以复合物稳定性作为最终数据,数据结果以来表示。利用Origin作图软件,以时间为横坐标,复合物稳定性为纵坐标,得出不同因素对复合物稳定性影响的数据图。
2 结果与分析
2.1 体外模拟胃肠液pH值对复合物稳定性的影响
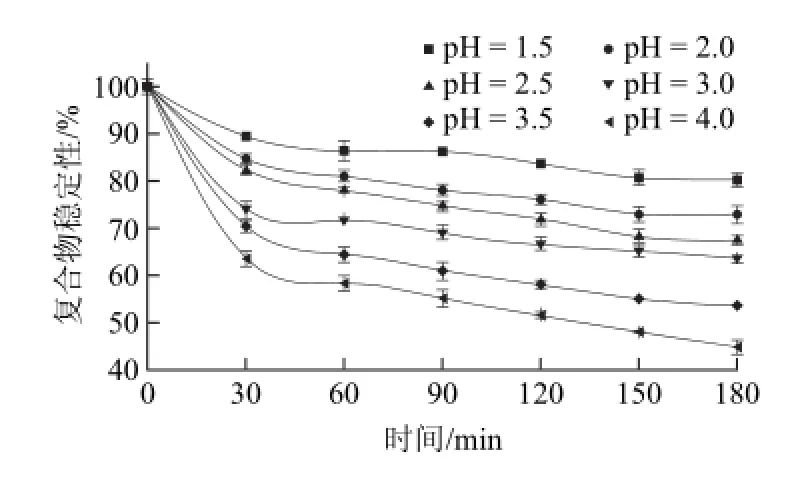
图1 体外模拟胃液的pH值对复合物稳定性的影响Fig.1 Time-dependent effect of in vitro SGF pH on the stability of the complex
由图1可知,体外模拟胃液pH值变化对复合物稳定性的影响较明显。这可能是由于燕麦β-葡聚糖在酸性环境下易发生水解[9]以及低pH值导致β-葡聚糖构象发生变化引起的[23]。随着孵育时间的变化,复合物逐渐解离,稳定性逐渐减弱。随着胃液pH值增大,复合物稳定性逐渐增大。如在30 min时,pH值为4时复合物稳定性变化量是pH值为1.5时的3.44倍;在180 min时,前者是后者的2.79倍。说明pH值增大使得复合物的稳定性降低,即燕麦β-葡聚糖-EGCG复合物中随着pH值的降低,复合物稳定性越高。参照之前的研究[16],复合物两者之间主要由于氢键作用相结合。在酸性条件下,氢离子浓度较高,有机物多以分子形式存在,分子形式有利于氢键的形成,所以在pH值越低的情况下越容易形成氢键,复合物越稳定。由于空腹下胃液的pH值为1.5左右,且进食会使得胃液的pH值增大[24]。可判断在禁食状态下复合物在胃液中相对进食状态而言较稳定。此外,在孵育的前30 min,复合物稳定性变化最大,变化量均超过总变化量的50%以上。即在作用前30 min,模拟胃液对复合物稳定性影响最为显著。物质在胃液中停留的时间一般为90 min左右[25],但停留时间也会因条件发生改变。通过缩短复合物在胃液中停留的时间,可以减少复合物中EGCG的损失。由图2可知,体外模拟肠液中pH值变化对复合物稳定性的影响较明显。随着时间的延长,复合物稳定性降低,即解离的EGCG量逐渐增大。随着模拟肠液pH值增大,复合物稳定性逐渐降低。如在30 min时,pH值为8时复合物稳定性变化量是pH值为5时的2.48倍;在180 min时,前者是后者的2.02倍。由于儿茶素类在偏碱性条件下不稳定[26],这可能是导致复合物稳定性降低的原因之一。由于进食会使得肠液pH值增大[24],由此可推测在禁食状态下复合物在肠液中的稳定性较高。

图2 体外模拟肠液的pH值对复合物稳定性的影响Fig.2 Time-dependent effect of in vitro SIF pH on the stability of the complex
2.2 复合物质量浓度对其在体外模拟胃肠液中稳定性的影响

图3 体外模拟胃液中复合物质量浓度对复合物稳定性的影响Fig.3 Time-dependent effect of the concentration of the complex on its stability in SGF in vitro
由图3可知,体外模拟胃液中复合物质量浓度变化对复合物稳定性的影响显著,其原因可能是燕麦β-葡聚糖在酸性环境下容易发生部分水解[24],复合物质量浓度的提高,使得未发生水解的燕麦β-葡聚糖提高,由氢键与EGCG复合,复合物稳定性随之提高。随着孵育时间的变化,复合物逐渐解离,稳定性逐渐降低;随着复合物质量浓度增加,复合物稳定性逐渐增大。如在30 min时,质量浓度为0.5 mg/mL时复合物稳定性变化量是质量浓度为1.0 mg/mL时复合物变化量的3.22倍;在180 min时,前者是后者的3.17倍。因此,增大复合物在模拟胃液中的含量,可以增大复合物在胃液中的稳定性。在孵育的前30 min,复合物稳定性变化量最大,变化量均超过总变化量的50%以上,减少复合物在胃液中的停留速度,有利于复合物的保留。孵育180 min后,复合物质量浓度高于0.8 mg/mL时,复合物稳定性大于80%,复合物得到较大程度的保存。适当提高复合物摄入量,对于其在胃液中的稳定性有积极的影响。
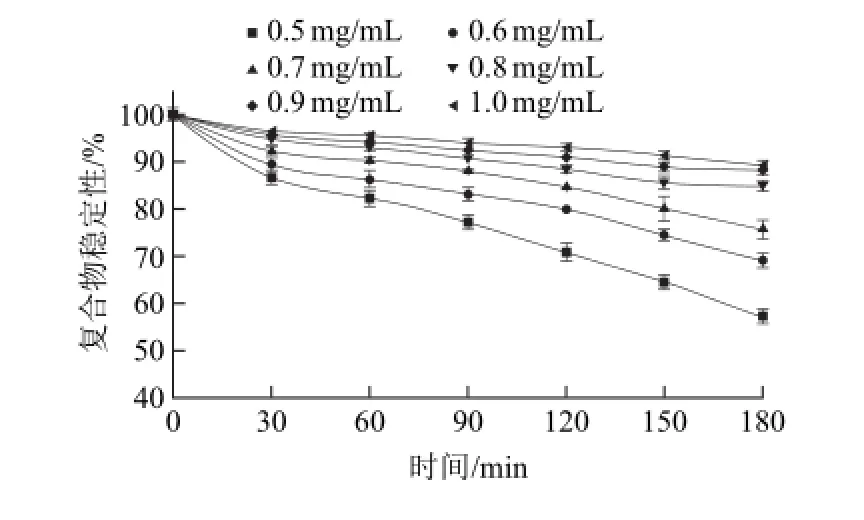
图4 体外模拟肠液中复合物质量浓度对复合物稳定性的影响Fig.4 Time-dependent effect of the concentration of the complex on its stability in SIF in vitro
由图4可知,体外模拟肠液中复合物质量浓度变化对复合物稳定性的影响显著。随着孵育时间的变化,复合物逐渐解离,稳定性逐渐降低;随着复合物质量浓度增加,复合物稳定性逐渐增大。如在30 min时,质量浓度为0.5 mg/mL时复合物稳定性变化量是质量浓度是1.0 mg/mL时复合物变化量的3.79倍;在180 min时,前者是后者的4.04倍。说明复合物的稳定性随着复合物质量浓度增大而增大。此外,同模拟胃液中相似,复合物质量浓度高于0.8 mg/mL时,复合物稳定性大于80%,复合物得到较大程度的保留,故适当提高复合物摄入量,对于其在肠液中的稳定性有积极的影响。
3 结 论
通过对复合物在体外模拟胃肠液中的稳定性进行研究。得出以下结论:1)pH值对复合物稳定性的影响:在模拟胃液和肠液中,随pH值的升高,复合物稳定性逐渐降低。在孵育前期,复合物稳定性变化最显著,孵育前30 min,稳定性变化量均超过总变化量的50%以上。对比模拟胃液和模拟肠液,模拟胃液对复合物稳定性影响大于模拟肠液。2)复合物质量浓度对复合物稳定性的影响:在模拟胃液和肠液中,随复合物质量浓度的升高,复合物稳定性逐渐增大。复合物质量浓度高于0.8 mg/mL时,复合物稳定性在孵育时间内均可达到80%,复合物质量浓度的提高,使得其在模拟胃肠液中的稳定性提高。研究表明在模拟胃肠液中pH值和复合物质量浓度是影响复合物稳定性的重要因素,这为将来研探讨β-葡聚糖-EGCG复合物的体内生物学作用提供一定的参考。
[1] PEREZ-JIMENEZ J, ARRANZ S, TABERNERO M, et al. Updated methodology to determine antioxidant capacity in plant foods, oils and beverages: extraction, measurement and expression of results[J]. Food Research International, 2008, 41(3): 274-285.
[2] HANLIN R L, HRMOVA M, HARBERTSON J F, et al. Condensed tannins and grape cell wall interactions and their impact on tannins extractability into wine[J]. Australian Journal of Grape and Wine Research, 2010, 16(1): 173-188.
[3] VIDAL S, FRANCIS L, WILLIAMS P, et al. The mouth-feel properties of polysaccharides and anthocyanins in a wine like medium[J]. Food Chemistry, 2004, 85(4): 519-525.
[4] KAMMERER J, KAMMERER D R, JENSEN U, et al. Interaction of apple polyphenols in a multi-compound system upon adsorption onto a food-grade resin[J]. Journal of Food Engineering, 2010, 96(4): 544-554.
[5] 周梦怡, 高延东, 张建法. β-葡聚糖在胃肠道方面的生理学功能[J].食品工业科技, 2013, 34(18): 366-374.
[6] KALOGEROPOULOS N, YANNAKOPOULOU K, GIOXARI A, et al. Polyphenol characterization and encapsulation in β-cyclodextrin of a flavonoid-rich Hypericum perforatum (St John’s wort) extract[J]. LWT-Food Science and Technology, 2010, 43(6): 882-889.
[7] 申瑞玲, 王英, 董吉林. 燕麦膳食纤维对胃肠道消化吸收功能影响[J]. 粮食与油脂, 2011, 24(2): 7-9.
[8] 吴绍函, 沈群, 谭斌, 等. 燕麦β-葡聚糖对肠道的保健作用研究进展[J].食品工业科技, 2012, 33(17): 388-394.
[9] 管骁, 姚惠源, 李景军, 等. 燕麦β-葡聚糖研究进展[J]. 食品科学, 2007, 28(8): 90-93.
[10] 全知怎, 苏俭生. EGCG与肿瘤细胞Wnt信号转导通路的研究进展[J].口腔颌面外科杂志, 2011, 21(3): 219-222.
[11] KIM H, HIRAISHI A, TSUCHIYA K, et al. (-)-Epigallocatechin gallate suppresses the differentiation of 3T3-L1 preadipocytes through transcription factors FoxO1 and SREBP1c[J]. Cytotechnology, 2010, 62(3): 245-255.
[12] TAI K K, TRUONG D D. (-)-Epigallocatechin-3-gallate (EGCG), a green tea polyphenol, reduces dichlorodiphenyl- trichloroethane (DDT)-induced cell death in dopaminergic SHSY-5Y cell[J]. Neuroscience Letters, 2010, 482(3): 183-187.
[13] MONOBE M, EMA K, TOKUDA Y, et al. Enhancement of phagocytic activity of macrophage-like cells by pyrogallol-type green tea polyphenols through caspase signaling pathways[J]. Cytotechnology, 2010, 62(3): 201-203.
[14] 张鑫, 马丽苹, 张芸, 等. 茶叶儿茶素对肠道微生态的调节作用[J].食品科学, 2013, 34(5): 232-237.
[15] 蒋洁琳, 温旭烨, 胡雅琼, 等. 表没食子儿茶素没食子酸酯(EGCG)对癌症细胞信号传导链的影响[J]. 食品科学, 2012, 33(9): 319-325.
[16] GAO R P, LIU H, PENG Z et, al. Adsorption of (-)-epigallocatechin-3-gallate (EGCG) onto oat β-glucan[J]. Food Chemistry, 2012, 132(4): 1936-1943.
[17] WU Z, MING J, GAO R P, et al. Characterization and antioxidant activity of the complex of tea polyphenols and oat β-glucan[J]. Journal of Agricultural and Food Chemistry, 2011, 59(19): 10737-10746.
[18] 何小解, 卢向阳, 易著文, 等. 模拟人体胃肠道环境对儿茶素稳定性的影响[J]. 湖南农业大学学报: 自然科学版, 2005, 31(5): 527-529.
[19] 肖俊松, 袁英髦, 张爱雪, 等. 茶叶中茶多酚和生物碱的测定及聚类和线性判别分析[J]. 食品科学, 2010, 31(22): 343-348.
[20] 马雅钦, 高瑞萍, 崔峻, 等. 消化道中燕麦β-葡聚糖对EGCG吸附作用的体外研究[J]. 食品与发酵工业, 2013, 39(3): 138-142.
[21] TOSH S M, WOOD P J, WANG Q, et al. Structural characteristics and rheological properties of partially hydrolyzed oat β-glucan: the effects of molecular weight and hydrolysis method[J]. Carbohydrate Polymers, 2004, 55(4): 425-436.
[22] HUSSAIN F, ARAYNE M S, SULTANA N. Interactions between sparfloxacin and antacids-dissolution and adsorption studies[J]. Pakistan Journal of Pharmaceutical Sciences, 2006, 19(1): 16-21.
[23] 汪海波, 刘大川, 汪海婴, 等. 燕麦β-葡聚糖的分子链高级结构及溶液行为研究[J]. 食品科学, 2008, 29(10): 80-84.
[24] OMEN A G, HACK A, MINEKUS M, et al. Comparison of five in vitro digestion models to study the bioaccessibility of soil contaminants[J]. Environmental Science & Technology, 2002, 36(15): 3326-3334.
[25] ANN L, DAUGHERTY, RANDALL J. Mrsnytranscellular uptake mechanisms of the intestinal epithelial barrier part one[J]. Pharmaceutical Science & Technology Today, 1999, 2(4): 144-151.
[26] LUCK G, LIAO H, MURRAY N J, et al. Polyphenols, astringency and proline-rich proteins[J]. Phytochemistry, 1994, 37(2): 357-371.
in vitro Stability of the Complex of EGCG and Oat β-Glucan in Simulated Gastrointestinaltract Fluid
MA Ya-qin1, GAO Rui-ping1,2, LIU Jia1, ZHAO Guo-hua1,3,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. School of Public Health, Zunyi Medical University, Zunyi 563000, China; 3. Chongqing Key Laboratory of Agricultural Products Processing, Chongqing 400715, China)
In this study, the stability of epigallocatechin gallate (EGCG)-oat β-glucan complex in simulated gastric (SGF) and intestinal (SIF) fluids was investigated.The complex was prepared by vacuum freeze-drying method. The effect of different concentrations of EGCG-oat β-glucan complex and different pH levels of SGF and SIF on its stability was investigated. Results showed that the complex was more stable at lower pH levels in both SGF and SIF. It could be stabilized during fasting because food ingestion results in higher pH levels in the gastrointestinal fluid. This complex at higher concentrations had better stability in both SGF and SIF, reaching above 80% after being incubated for 180 min at 0.8 mg/L. This indicates that the stability of the complex in the gastrointestinal fluid can be improved by appropriately increasing its concentration.
oat β-glucan; EGCG; complex; simulated gastrointestinal fluid; stability
TS201.2
A
1002-6630(2014)03-0033-04
10.7506/spkx1002-6630-201403007
2013-01-13
国家自然科学基金项目(31171654)
马雅钦(1990—),男,硕士研究生,研究方向为食品安全与质量控制。E-mail:mayaqin1990@126.com
*通信作者:赵国华(1971—),男,教授,博士,研究方向为非消化性碳水化合物化学与营养。E-mail:zhaoguohua1971@163.com

