响应面法优化链霉菌A0901产几丁质酶抑制剂的发酵条件
陈志斌,张洪斌*,胡雪芹,张宇琪
(合肥工业大学医学工程学院制药工程系,安徽 合肥 230009)
响应面法优化链霉菌A0901产几丁质酶抑制剂的发酵条件
陈志斌,张洪斌*,胡雪芹,张宇琪
(合肥工业大学医学工程学院制药工程系,安徽 合肥 230009)
用响应面法优化链霉菌A0901产几丁质酶抑制剂的发酵条件,以提高几丁质酶抑制剂的产率。利用单因素试验筛选出最佳碳源为可溶性淀粉、氮源为KNO3。采用两水平Plackett-Burman法筛选出对产几丁质酶抑制剂有重要影响的3个因素:可溶性淀粉、ZnCl2和培养温度,通过最陡爬坡试验逼近最佳响应面区域,最后通过中心组合试验设计,利用SAS软件进行回归分析,得到最佳发酵培养条件:可溶性淀粉3.76 g/100 mL、NaCl 0.05 g/100 mL、KNO30.1 g/100 mL、K2HPO4·3H2O 0.05 g/100 mL、MgSO4·7H2O 0.04 g/100 mL、ZnCl20.024 g/100 mL、FeSO4·7H2O 0.001 g/100 mL、初始pH 6、温度28.54 ℃、转速250 r/min。在最优培养条件下,发酵液对几丁质酶的抑制率达到67.58%,较原发酵培养基的几丁质酶抑制率提高36.8%。
几丁质酶抑制剂;食品保鲜;响应面法;发酵条件
几丁质是节肢动物外骨骼、真菌细胞壁、细胞隔膜及线虫卵壳的主要组分[1],几丁质酶由于其分解几丁质的作用而在节肢动物和真菌的生长及发育过程起重要作用。几丁质酶抑制剂能特异性地抑制几丁质酶活性,阻止昆虫幼虫和蛹的蜕皮以及真菌子母细胞的分离而起到杀虫和抗真菌作用[2-3],因此在食品保鲜和生物杀虫剂方面具有重要的应用前景。哺乳动物机体不存在几丁质代谢系统,故以几丁质酶作为靶标的几丁质酶抑制剂作为生物杀虫剂和抗真菌药物具有对人畜无害和不污染环境的优点,在农业、环保、医药、食品等行业具有巨大潜在价值[4]。因此,以几丁质酶为靶标的新型生物杀虫剂、食品保鲜剂,成为国内外关注的新热点。
长期以来,日本和英国等国一直在进行几丁质酶抑制化合物的探索性研究,并对已发现化合物的活性机理、合成路线及相关领域进行了深入研究[5-7]。国内也有少量几丁质酶抑制化合物的研究报告,但还处于起步阶段。至今已报道的几丁质酶抑制剂主要有:Allosamidin衍生物[8]、Argifin[9-10]、Argadin[11]、Styloguanidines[12]、CI-4[13]、FPS-1[14]、psammaplin A[15]等。但是,由于生产成本高、活性低、不易合成等原因,始终没有应用于工业生产。本实验室发现一种产几丁质酶抑制剂的微生物,但发酵产率不高[16]。本研究将在单因素试验的基础上,利用响应面法[17]对几丁质酶抑制剂产生菌的发酵条件进行优化,通过综合考察和评价获得最佳的发酵条件,以提高发酵产率。
1 材料与方法
1.1 菌株与培养基
链霉菌A0901,系本实验室筛选、保存。
斜面培养基(g/100 mL):可溶性淀粉2、蛋白胨1、NaCl 0.05、琼脂2。
种子及发酵培养基(g/100 mL):可溶性淀粉2、NaCl 0.05、K2HPO4·3H2O 0.05、KNO30.1、MgSO4·7H2O 0.05、ZnCl20.05、FeSO4·7H2O 0.001、pH 7.2、121 ℃灭菌20 min。
1.2 仪器与设备
SPX-250型生化培养箱 上海跃进医疗器械厂;KQ-500型超声波清洗器 昆山市超声仪器有限公司;ZHWY-2102型恒温培养振荡器 上海智城分析仪器制造有限公司;YP5002型电子天平 上海越平科学仪器有限公司;WD800型微波炉 佛山市格兰仕微波炉电器有限公司;电子万用炉 天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 单因素试验筛选最优碳源和氮源
分别用葡萄糖、蔗糖、乳糖、纤维素、几丁质5种碳源替换发酵培养基中的可溶性淀粉,各碳源添加量均为2 g/100 mL,其他条件不变,考察不同碳源对链霉菌A0901产几丁质酶抑制剂的影响;在确定最佳碳源的基础上,再分别用KNO3、NaNO3、NH4NO3、(NH4)2SO44种无机氮源和酵母膏、蛋白胨、脲素3种有机氮源等量替换发酵培养基中的KNO3,其他条件不变,测定不同氮源对链霉菌A0901产几丁质酶抑制剂的影响。每组实验均重复3次。
1.3.2 响应曲面法对发酵条件优化
根据单因素试验结果,设计Plackett-Burman试验,对10个因素进行考察,每个因子取高(+1)和低(-1)2个水平,获得显著影响因素。采用Box-Behnken响应面试验设计[21]确定显著因子的最优水平,以几丁质酶抑制率为响应值设计三因素三水平共15个试验组的响应面分析试验,其中3个为零点,12个为析因点,零点实验重复3次,以估计误差。数据用SAS 9.0程序分析确定最优发酵条件。
1.3.3 几丁质酶活力抑制评价
以N-乙酰-D-氨基葡萄糖的生成速率测定酶活性大小。50 ℃、1 h产生1 μmol/L N-乙酰-D-氨基葡萄糖所需的酶量为一个酶活力单位,即1 U[18]。在酶反应体系中加入待测液,测定剩余酶活力,以灭活后的体系和原酶反应体系作为对照,根据酶活力是否下降以及下降的程度来判定抑制性。几丁质酶抑制物的抑制活性可以用抑制率来计算。
测试组1:500 μL胶体几丁质加入500 μL酶液和1 000 μL pH6.0磷酸缓冲液,在45 ℃进行酶促反应1 h后沸水浴10 min,后冰浴再加入1500 μL DNS溶液,置沸水浴20 min后冰浴并定容至25 mL,离心收集上清液。
对照组1:500 μL胶体几丁质加入1 000 μL pH 6.0磷酸缓冲液沸水浴灭活2 min,再加入500 μL酶液沸水浴10 min,冰浴后加入1500 μL DNS溶液,置沸水浴20 min后冰浴,用蒸馏水定容至25 mL,离心收集上清液。
测试组2:500 μL胶体几丁质加入500 μL酶液和1 000 μL待测发酵液,在45 ℃进行酶促反应1 h后沸水浴10 min,后冰浴再加入1 500 μL DNS溶液,再置沸水浴20 min后冰浴并定容至25 mL,离心收集上清液。
对照组2:500 μL胶体几丁质加入1 000 μL 待测发酵液沸水浴灭活2 min,再加入500 μL酶液沸水浴10 min,冰浴后加入1 500 μL DNS溶液,置沸水浴20 min后冰浴,用蒸馏水定容至25 mL,离心收集上清液。
在540 nm波长下,利用紫外分光光度计测量各组实验吸光度,测试组1与对照组1的吸光度差值为ΔA1,测试组2与对照组2的吸光度差值为△A2,按以下公式计算抑制率。

2 结果与分析
2.1 单因素试验筛选最优碳源和氮源
2.1.1 碳源对几丁质酶抑制剂产量的影响
取不同碳源的发酵液测定其对几丁质酶的抑制活性,结果见表1。以可溶性淀粉为碳源时,发酵液对几丁质酶的抑制率最高,表明以可溶性淀粉为碳源时几丁质酶抑制剂的产量最高。

表1 不同碳源条件下A0901链霉菌发酵液对几丁质酶活性的抑制率测定Table 1 Effects of various carbon sources on the chitinase inhibitory activity by fermented broth
2.1.2 氮源对几丁质酶抑制剂产量的影响
不同氮源对链霉菌A0901产几丁质酶抑制剂的影响见表2。利用无机氮源时的几丁质酶抑制剂单位产率最好。

表2 不同氮源条件下A0901链霉菌发酵液对活性菌株发酵液抑制性的影响Table 2 Effects of various nitrogen sources on the chitinase inhibitory activity by fermented broth

表3 Plackett-Burman试验设计及结果Table 3 Plackett-Burman design and corresponding experimental results
2.2 Plackett-Burman设计筛选重要影响因素

表4 Plackett-Burman设计的各因素水平及效应评价Table 4 Factor levels and effect estimates for Plackett-Burman design
选用试验次数N=12的Plackett-Burman试验设计及结果见表3。采用SAS 9.0[19]进行各因素主效应分析结果见表4,对供试菌株产酶有显著影响的因素依次为:可溶性淀粉>培养温度>ZnCl2。其中可溶性淀粉对产几丁质酶抑制剂呈现正效应,ZnCl2和培养温度则呈现出负效应。这3个显著因素对产抑制剂的影响可用以下方程表示:Y=45.58+2.625X1-2.0133X6-2.503X9。方程的决定系数R2=99.91%,表明该回归方程拟合良好。由显著因子效应可看出,要提高几丁质酶抑制剂产量,应适当提高可溶性淀粉质量浓度,降低ZnCl2质量浓度和培养温度。其他因子影响不大,不做进一步处理。
2.3 最陡爬坡试验选择最大响应区域
响应面拟合方程只有在考察的临近区域里才能充分近似真实情况,故应先逼近最大产抑制剂区域后再建立有效的拟合方程。根据Fractional Factorial Design法筛选出的显著因子效应大小设计它们的步长,进行最陡爬坡试验设计[20],寻找最大产抑制剂区。实验设计及结果如表5所示,最大产抑制剂区在第5次试验附近,故以试验5的条件为响应面试验因素水平的中心点。
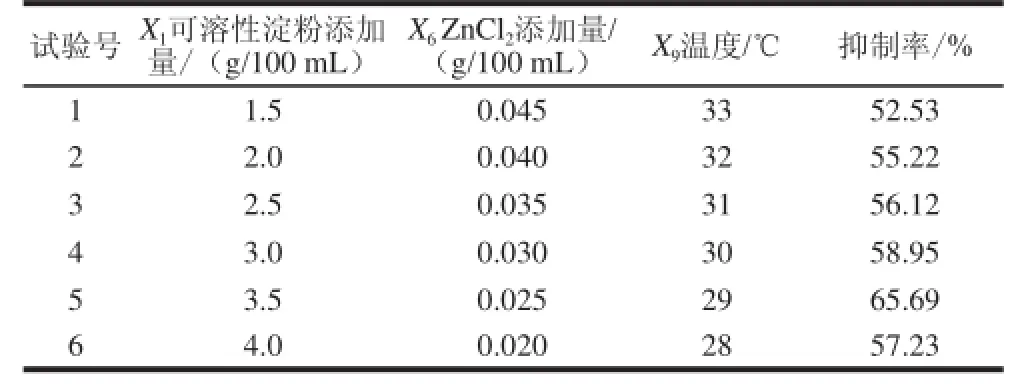
表5 最陡爬坡试验设计及结果Table 5 Steepest ascent experimental design and corresponding results
2.4 中心组合试验确定最佳组合
采用Box-Behnken响应面试验设计[21]确定显著因子的最优水平,以几丁质酶抑制率为响应值设计三因素三水平共15个试验组的响应面分析试验,其中3个为零点,12个为析因点,零点实验重复3次,以估计误差,试验设计方案与结果见表6。每组试验重复3次,数据均为平均值。

表6 Box-Behnken试验设计与结果Table 6 Box-Behnken experimental design and corresponding results
通过SAS 9.0软件对表6结果进行回归分析,回归方程的方差分析结果见表7。该试验拟合的回归方程为:
Y1= 67.026 67+3.177 5X1-3.086 25X2-1.563 75X3-5.329 583X12+0.135X1X2-4.505X1X3-7.087 083X22+1.612 5X2X3-4.542 083X32。
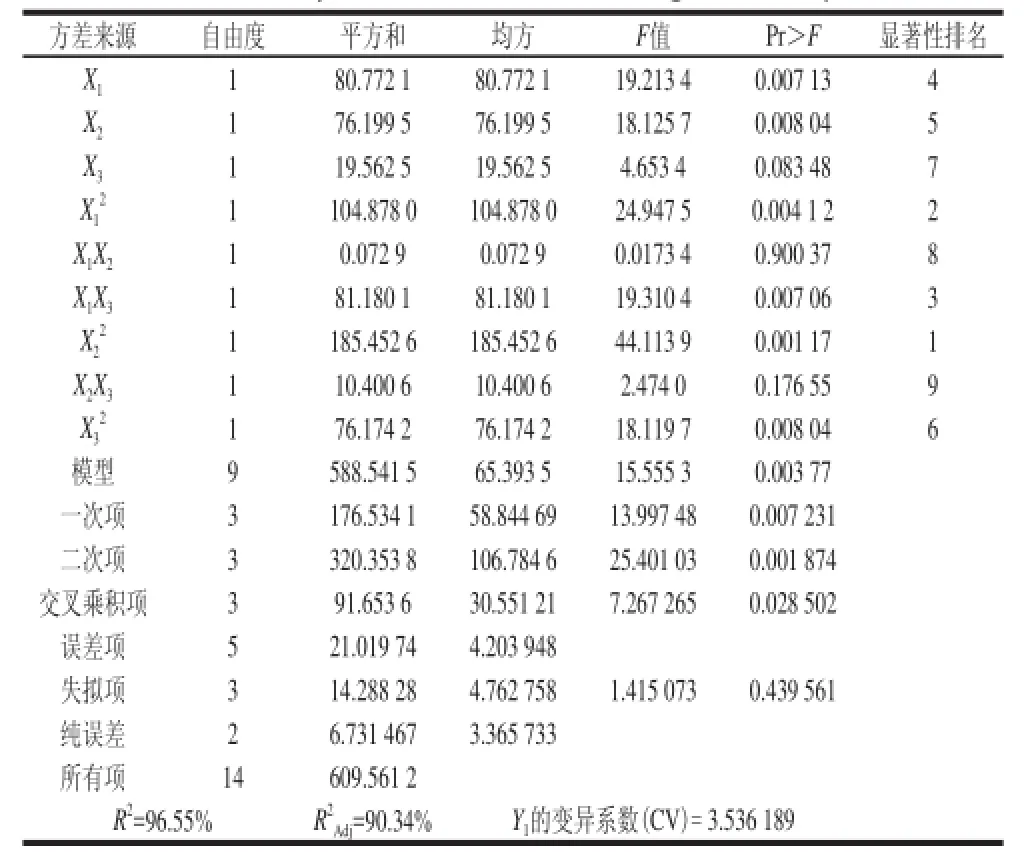
表7 回归方程的方差分析Table 7 Analysis of variance for the regression equation
由表7可知,模型在α=0.01水平上回归显著;失拟项P>0.1,失拟检验不显著,说明未知因素对实验结果干扰很小,实验数据与模型符合情况较好。一次项和平方项对响应值也有显著的影响。同时,复相关系数的平方(R2)较高,表明方程拟合较好;Y1的变异系数较低,说明实验操作可信。综上说明回归方程给菌株产几丁质酶抑制剂提供了一个合适的培养基模型。
2.5 响应面分析及最佳培养条件确定
通过回归方程拟合绘制响应面分析图形,考察各拟合的响应面曲线的形状,响应面分析图形如图1所示。


图1 各因素及其相互作用对抑制剂影响的响应面和等高线图Fig.1 Response surface and contour plots showing the effects of various factors and their interaction on the production of chitinase inhibitor
由图1响应面立体分析图可直观地看出X1、X2、X3存在极值点,对Y1进行岭嵴分析得到极大值所对应的各主要因素X1、X2、X3的编码值分别为0.490 2、-0.265 7、-0.462 4,即碳源、ZnCl2和发酵温度的最佳值分别为3.755 1、0.023 7 g/100 mL、28.54 ℃,此时发酵液的几丁质酶抑制剂活性最高,单位抑制活性达到68.576 9%。因而,所得的最佳发酵条件组合为:可溶性淀粉3.76 g/100 mL、NaCl 0.05 g/100 mL、KNO30.1 g/100 mL、K2HPO4·3H2O 0.05 g/100 mL、MgSO4·7H2O 0.04 g/100 mL、ZnCl20.024 g/100 mL、FeSO4·7H2O 0.001 g/100 mL、初始pH 6、培养温度28.54 ℃、转速250 r/min。
2.6 回归模型的验证
以此方法获得的最佳发酵条件组合进行发酵验证实验,得到的发酵液具有几丁质酶单位抑制活性为67.58%,模型值与实验值的相对偏差为1.47%,由此可见该模型可以较好地预测发酵情况,说明此响应面法优化获得的发酵条件组合是可行、有效的。
3 结 论
采用响应面分析法对几丁质酶抑制剂的发酵条件进行优化,首先运用Plackett-Burman 法确定出可溶性淀粉、ZnCl2和发酵温度为重要影响因素;然后通过最陡爬坡试验逐步改变三者的水平,逼近最佳响应面区域;最后采用Box-Behnken试验设计和SAS 9.0软件分析确定出主要因素的最优条件,得到最佳发酵培养条件为:可溶性淀粉3.76 g/100 mL、NaCl 0.05 g/100 mL、KNO30.1 g/100 mL、K2HPO4·3H2O 0.05 g/100 mL、MgSO4·7H2O 0.04 g/100 mL、ZnCl20.024 g/100 mL、FeSO4·7H2O 0.001 g/100 mL、初始pH 6、温度28.54 ℃、转速250 r/min。在此条件下发酵液对几丁质酶的抑制率达到67.58%,较原发酵培养基的几丁质酶抑制率提高36.8%。
[1] MERZENDOFER H, ZIMOCH L. Chitin metabolism in insects: structure, function and regulation of chitin synthases and chitinases[J]. Journal of Experimental Biology, 2003, 206: 4393-4398.
[2] SAKUDA S, ISOGAI A, MATSUMOTO S, et al. Search for microbial insect growth regulators. II. Allosamidin, a novel insect chitinase inhibitor[J]. The Journal of Antibiotics, 1987, 40: 296-300.
[3] SAKUDA S, NISHIMOTO Y, OHI M, et al. Effects of demethyallosamidin, a potent yeast chitinase inhibitor, on the cell division of yeast[J]. Agricultural and Biological Chemistry, 1990, 54(5): 223-227.
[4] ZHU Zeyang, ZHENG T, HOMER R J, et al. Acidic mammalian chitinase in asthmatic Th2 inflammation and IL-13 pathway activation[J]. Science, 2004, 304(567): 1678-1682.
[5] FRANCESCO V R, DOUGLAS R H, ROLF G B, et al. Crystal structures of allosamidin derivatives in complex with human macrophage chitinase[J]. The Journal of Biochemistry, 2003, 278(22): 20110-20116.
[6] CHRISTINA L R, ALEXANDER W S, RAMON H G, et al. Natural product-guided discovery of a fungal chitinase inhibitor[J]. The Journal of Biochemistry, 2010, 17: 1275-1281.
[7] TOMOYASU H, TOSHIAKI S and SATOSHI O. Recent development of two chitinase inhibitors, Argifin and Argadin, produced by soil microorganisms[J]. Proceedings of the Japan Academy, Ser B, 2010, 86(2): 85-101.
[8] SAKUDA S, ISOGAI A, MATSUMOTO S, et al. The structure of Allosamidin, a novel insect chitinase inhibitor, produced by Streptomyces sp.[J]. Tetrahedron Letters, 1986, 27(22): 2475-2478.
[9] ŌMURA S, ARIA N, YAMAGUCHI Y, et al. Argifi n, a new chitinase inhibitor, produced by Gliocladium sp. FTD20668 I. Taxonomy, fermentation, and biological activities[J]. The Journal of Antibiotics, 2000, 53(6): 603-608.
[10] ARIA N, SHIOMI K, IWAI Y, et al. Argifi n, a new chitinase inhibitor, produced by Gliocladium sp. FTD20668 II. Isolation, physicochemical properties, and structure elucidation[J]. The Journal of Antibiotics, 2000, 53(6): 609-614.
[11] ARAI N, SHIOMI K, YAMAGUCHI Y, et al. Argadin, a new chitinase inhibitor, produced by Clonostachys sp. FO-7314[J]. Chemical and Pharmaceutical Bulletin, 2000, 48 (10): 1442-1446.
[12] KATO T, SHIZURI Y, IZUMIDA H, et al. Styloguanidines, new chitinase inhibitors from the marine sponge Stylotella aurantium[J], Tetrahedron Letters, 1995, 36(12): 2133-2136.
[13] IZUMIDA H, IMAMURA N, SANO H. A novel chitinase inhibitor from a marine bacterium, Pseudomonase sp.[J]. The Journal of Antibiotics, 1996, 49(1): 76-80.
[14] NITODA T, USUKI H, KANZAKI H, et al. A potent insect chitinase inhibitor of fungal origin[J]. Zeitschrift Fur Naturforschung, 2003, 58: 891-894.
[15] TABUDRAVU J N, EIJSINK V G H, GOODAY G W, et al. Psammaplin A, a chitinase inhibitor isolated from the Fijian marine sponge Aplysinella rhax[J]. Bioorganic & Medicinal Chemistry, 2002, 10(4): 1123-1128.
[16] 张洪斌, 刘明艳, 田玉敬, 等. 微生物来源的昆虫几丁质酶抑制剂的筛选与分离纯化[J]. 食品科学, 2010, 31(23): 271-275.
[17] 王永菲, 王成国. 响应面法的理论与应用[J]. 中央民族大学学报, 2005, 14(3): 236-240.
[18] PATEL A K, SINGH V K, YADAV R P, et al. Purification and characterization of a new chitinase from latex of Ipomoea carnea[J]. Process Biochemistry, 2010, 45: 675-681.
[19] 芮广虎, 胡雪芹,殷坤, 等. 响应面法优化短短芽孢杆菌FM4B的发酵培养基[J]. 食品科学, 2012, 33(15): 257- 261.
[20] 李静文, 路福平, 别松涛, 等.响应面试验设计优化脱氢酶发酵培养基[J]. 生物技术, 2009, 19(2): 73-76.
[21] 陈桂光, 邵利, 潘丽霞, 等. 响应面分析优化壳聚糖酶产生菌的发酵条件[J]. 食品科学, 2008, 29(10): 380- 383.
Optimization of Fermentation Conditions for Chitinase Inhibitor Production by Streptomyces sp. A0901 Using Response Surface Analysis
CHEN Zhi-bin, ZHANG Hong-bin*, HU Xue-qin, ZHANG Yu-qi
(Department of Pharmaceutical Engineering, School of Medical Engineering, Hefei University of Technology, Hefei 230009, China)
Purpose: To optimize the fermentation conditions for chitinase inhibitor production by Streptomyces sp A0901 by applying response surface analysis. Methods: Firstly, the optimum carbon source and nitrogen source were confi rmed as soluble starch and potassium nitrate respectively based on the results of single-factor experiments. Then, a two-level Plackett-Burman factorial design was used to evaluate the infl uence of seven factors including medium components and fermentation conditions on the production of chitinase inhibitor. Among them, three important factors including soluble starch, ZnCl2and incubation temperature were screened. Further, the steepest ascent path was utilized to determine the optimal region for chitinase inhibitor production.Results: The optimal medium composition and fermentation conditions were determined by central composite design and SAS regression analysis to be 3.76 g of soluble starch, 0.05 g of NaCl, 0.1 g of KNO3, 0.05 g of K2HPO4·3H2O, 0.04 g of MgSO4·7H2O, 0.024 g of ZnCl2, and 0.001 g of FeSO4·7H2O per 100 mL of culture medium with an initial pH of 6 and fermentation at 28.54at a shaker speed of 250 r/min. Conclusions: Under the optimized culture conditions, the inhibition of chitinase by fermented broth of Streptomyces sp. A0901 reached 67.58%, 36.8% higher than before the optimization.
chitinase inhibitor; food preservation; response surface methodology; fermentation conditions
TS201.3
A
1002-6630(2014)03-0139-05
10.7506/spkx1002-6630-201403028
2013-01-05
安徽省国际科技合作项目(08080703017);国家级大学生创业训练项目(201210359077)
陈志斌(1987—),男,硕士研究生,研究方向为生物制药。E-mail:jimmychen2010@163.com
*通信作者:张洪斌(1970—),男,教授,博士,研究方向为生物制药与酶工程。E-mail:zhb5678@163.com

