万珂对脑缺血再灌注损伤的作用
薛 晶 李 丽 李 淞 戈亚平 牛晓立 付铁娟
(吉林省人民医院神经内科,吉林 长春 130021)
近年来研究发现蛋白酶体抑制剂可通过多种机制调控细胞周期、细胞分化、抗原提呈、氧化应激、炎症反应和凋亡等〔1~3〕。最近有研究发现蛋白酶体抑制剂还有明确的抑制炎症反应的作用,而脑缺血再灌注后脑组织局部过度的炎症反应是造成再灌注损伤的主要原因之一〔4,5〕。本实验欲将其用于脑缺血再灌注方面的研究,探讨其是否有脑保护作用。
1 材料与方法
1.1实验动物模型及取材 选用雄性Wistar大鼠30只, 体重280~300 g,随机分为假手术组、生理盐水组、万珂组各10只。参照Zea-Longa线栓法〔6〕制作大鼠大脑中动脉缺血模型,脑缺血2 h再灌注即刻给予万珂0.2 mg/kg尾静脉注射,对照组以等量生理盐水尾静脉注射,再灌注后24 h取材。每组5只大鼠麻醉灌注固定、取材,取视交叉后脑组织2 mm厚层面制作石蜡切片,连续切取同一层面5张切片,切片厚5 μm,用于检测神经细胞凋亡。每组另外5只动物麻醉后将鼠脑切去嗅脑、额极、小脑和部分低位脑干,剩余部分从前向后切成2 mm厚的脑片,放于2%TTC磷酸盐缓冲液水浴30 min,正常组织为红色,梗死组织为白色,用10%甲醛磷酸缓冲液固定。
1.2检测方法 TUNEL法检测神经细胞凋亡,每只大鼠5张切片显微镜下选相同部位计数细胞核呈褐色的凋亡细胞,Motic Images Advanced 3.2 图像分析系统测出各脑片正反面梗死面积取平均值,根据梗死面积和切片厚度计算出梗死体积占全脑体积的百分比。
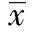
2 结 果
2.1脑梗死体积 假手术组无梗死现象。TTC染色生理盐水组及万珂组均可见大脑中动脉供血区梗死灶,梗死体积百分比分别为(31.908±0.814)%和(24.086±0.823)%,两者比较万珂组梗死体积明显缩小(t=15.10,P<0.01)。
2.2细胞凋亡 假手术组偶见凋亡细胞〔(2.98±0.37)个〕,生理盐水组〔(150.95±3.95)个〕及万珂组〔(31.24±2.52)个〕见大量细胞核呈褐色的凋亡细胞,但万珂组凋亡细胞明显减少,与其他两组指标比较差异有统计学意义(P<0.05)。
3 讨 论
万珂具有分子量小、水溶性、高度选择性、能穿透细胞膜、不能透过血脑屏障等特点〔7〕。本研究发现万珂可抑制脑缺血再灌注后后缺血半暗带的细胞凋亡,从而减少脑梗死体积,对脑缺血再灌注损伤具有保护作用。但万珂主要因可以明显诱导多发性骨髓瘤细胞凋亡〔8,9〕而被批准广泛用于临床。
目前相关的研究表明蛋白酶体抑制剂的应用导致细胞凋亡或避免凋亡有赖于不同的细胞及细胞的不同增殖阶段,并且蛋白酶体抑制剂对正常细胞及肿瘤细胞诱导凋亡的作用剂量有明显差异〔10〕。肿瘤细胞较正常细胞对PS-341敏感,且增殖活跃的细胞较静止期细胞敏感。Drexler等〔11〕的体外实验证实蛋白酶体抑制剂对于增殖期的血管内皮细胞诱导凋亡的剂量是静止期的340倍,推测对于处于活跃增殖期的细胞蛋白酶体抑制剂主要诱导细胞凋亡,对于已经分化并且处于非分裂期的细胞蛋白酶体抑制剂无明显诱导细胞凋亡的作用,表明蛋白酶体抑制剂很可能对肿瘤细胞具有选择性,是一种能选择性诱导肿瘤细胞凋亡而对正常细胞不损伤或损伤较少的抗肿瘤剂。另有实验证实在前脑缺血中,降低蛋白酶体活性有助于对缺血核心区保护,可能因为脑缺血核心区有用的蛋白被降解,而蛋白酶体抑制剂正好可阻止这一过程,显现出神经保护作用〔12〕。有研究〔13〕报道,脑组织中微小管的分解可诱导细胞凋亡或坏死,蛋白酶体抑制剂可阻止体内体外组织的华勒氏变性,稳定轴突中微管的细胞骨架,减轻凋亡,可能因为脑缺血半暗带内早期有大量的细胞骨架被蛋白酶体水解,蛋白酶体抑制剂正好可对此产生拮抗,对脑缺血损伤有保护作用。
正常细胞中促凋亡和抗凋亡蛋白及其活性应当是保持平衡的,当短寿的促凋亡蛋白如P53、Bax、P27由于短暂的蛋白酶体活性抑制而被推迟降解时,它们的绝对水平和活性就会增加;相反一些抗凋亡蛋白如Bcl-2,因有较长的半衰期,它们的水平和活性一般不会明显受影响,这可能也是研究中发现应用蛋白酶体抑制剂不仅能诱导细胞凋亡,还可以抑制细胞凋亡的原因,故蛋白酶体抑制剂可能是个双刃剑,如何合理有效地利用是亟需攻关的课题,蛋白酶体抑制剂有脑保护作用,深入研究其与缺血性脑损伤之间的关系,有可能为临床上更有效地干预缺血性脑损伤提供新的策略。
4 参考文献
1Yamamoto Y, Gaynor RB.Therapeutic potential of inhibition of the NF-kappaB pathway in the treatment of inflammation and cancer〔J〕.J Clin Invest, 2001;107(2):135-42.
2Huang L, Chen CH.Proteasome regulators: activators and inhibitors〔J〕.Curr Med Chem, 2009;16(8):931-9.
3Lightcap ES, McCormack TA, Pien CS,etal.Proteasome inhibition measurements: clinical application 〔J〕.Clin Chem,2000;46(5):673-83.
4Zheng Z, Yenari MA.Post-ischemic inflammation: molecular mechanisms and therapeu-tic implications〔J〕.Neurol Res, 2004;26(8):884-92.
5Danton GH, Dietrich WD.Inflammatory mechanisms after ischemia and stroke〔J〕.J Neuropathol Exp Neurol, 2003;62(2):127-36.
6Longa EZ, Weinstein PR, Carlson S,etal.Reversible middle cerebral artery occlusion without craniectomy in the rats〔J〕.Stroke, 1989;20(1):84-91.
7Orlowski RZ, Stinchcombe TE, Mitchell BS,etal.PhaseⅠtrial of the proteasome inhibitor PS-341 in patients with refractory hematologic malignancies〔J〕.J Clin Oncol, 2002;20(22):4420-7.
8Orlowski RZ, Zeger EL.Targeting the proteasome as a therapeutic strategy against haematological malignancies〔J〕.Expert Opin Invest Drugs,2006;15(2):117-30.
9Orlowski RZ, Kuhn DJ.Proteasome inhibitors in cancer therapy: lessons from the first decade 〔J〕.Clin Cancer Res, 2008;14(6):1649-57.
10Fenteany G, Schreiber SL.Lactacystin, proteasome function, and cell fate〔J〕.J Biol Chem,1998;273(15):8545-8.
11Drexler HC, Risau W, Konerding MA.Inhibition of proteasome function induces programmed cell death in proliferating endothelial cells〔J〕.FASEB J, 2000;14(1):65-77.
12Phillips JB, Williams AJ, Adams J,etal.Proteasome inhibitor PS519 reduces infarction and attenuates leukocyte infiltration in a rat model of focal cerebral ischemia〔J〕.Stroke, 2000;31(7):1686-93.
13Lipton P.Ischemic cell death in brain neurons〔J〕.Physiol Rev, 1999;79(4): 1431-568.

