威海近海海葵附生异养菌的分离和多样性分析
董雪敏,丛培云*(威海市产品质量监督检验所,山东威海264209)
威海近海海葵附生异养菌的分离和多样性分析
董雪敏,丛培云*
(威海市产品质量监督检验所,山东威海264209)
对绿海葵的共附生异养菌群进行研究。从海葵的表面和匀浆液中分离到60株异养菌株,采用16S rRNA基因序列分析和部分生理生化试验,确定其中56株菌的种属情况。另外,对该类菌株所产胞外酶的情况以及与弧菌的拮抗情况进行测定。结果表明:这些可培养菌株的群落结构多样性较为丰富,其中的16株菌为假交替单胞菌属及其相关类群;其他菌株主要分布在其他19个属中。其中,17株菌可产胞外蛋白水解酶;20株菌可产胞外脂肪酶;菌株NQ8对一些弧菌具有较强的拮抗作用。
绿海葵;细菌多样性;16S rRNA基因;系统发育;鉴定
共附生细菌可能在清除宿主代谢废物[1]和为宿主提供生物活性物质[2-3]等方面扮演着重要角色。细菌-宿主关系生物学使得许多研究者对于研究共附生海洋微生物作为天然生物制品的来源产生相当大的兴趣[4]。海绵共附生菌产生的很多抗菌物质已经被分离到了,这说明共附生菌对宿主可能具有保护作用。一些情况下,细菌产生抗菌物质也被证明是与其宿主有关的。
因为海洋共附生微生物的重要价值,国内外学者开展了不少相关研究,但还处于初级阶段。国内关于海葵共附生细菌的研究报告很少,YANG B L等[5-6]都在海葵中发现了具有抗菌活性的细菌。谢新强等[7]指出从海葵、贻贝等分离到的活性菌株数高于其他动物。国外关于海葵共附生微生物的研究主要集中于共生藻类,共附生细菌未见报道。本研究采用16S rRNA基因序列分析来调查威海近海海葵共附生可培养细菌的生物多样性,并对这些菌株产生胞外酶和拮抗物质的情况进行初步分析。
1 材料与方法
1.1 材料与试剂
样品采集:实验所用海葵Anthopleura midori(刺胞动物门,珊瑚虫纲,海葵目,绿海葵)于2008年4月份从威海近海(中国山东,纬度37.533 1°N;经度122.061 9°E)潮间带采集。采集的海葵保存至装有海水的标本袋中,密封,防止海葵与空气直接接触并迅速带回实验室,并于超净工作台中及时处理。
2216培养基(海生细菌的增菌培养):青岛海博生物技术有限公司;PCR试剂盒:日本东洋纺株式会社上海子公司;吐温80、胰蛋白酶和大豆琼脂培养基等试剂由实验室提供。
1.2 仪器与设备
MLS-3750型高压灭菌锅:日本SANYO公司;BPX-162型恒温培养箱:上海博迅公司;高速冷冻离心机、LS-D202型金属浴:美国Thermo公司;Tanon-3500凝胶成像仪:上海天能科技有限公司;超净工作台:苏州安泰空气技术有限公司;PTC-200型PCR仪:美国伯乐公司;DYY-6c型DNA电泳仪:北京六一仪器厂;HH-1型水浴锅:常州国华电器有限公司;HQ-60漩涡混合器:北京同正生物技术发展公司;DELTA 320pH计:梅特勒-特立多仪器有限公司;IS-RDS3型恒温振荡器:美国精骐有限公司;DW-86L-626型超低温冰箱:青岛海尔集团;SIGMA1-14型常温离心机:德国森马公司;JY92-II型超声波粉碎机:宁波新芝生物科技股份有限公司;Gene Quant 100紫外分光光度计:美国GE公司。
1.3 方法
1.3.1 海葵共附生异养细菌的分离
对海葵进行无菌处理,即称质量后用无菌海水反复清洗。将海葵表面直接在培养基上涂布以获得其表面的细菌,暂时以BM、HK和JS标记。解剖海葵得到1 cm2体腔壁,用无菌海水冲洗海葵体腔(洗去体腔内的颗粒物质),将其研磨成浆,用无菌海水按照10-1~10-6的比例进行梯度稀释,以NQ标记。在2216E固体培养基上涂布均匀,28℃下培养至菌株长出。
1.3.2 PCR测序和系统发育分析
将菌株转接入分离培养基中于恒定光源的恒温培养箱中28℃培养过夜。取一环单菌落悬浮于50 μL无菌去离子水中,100℃水浴加热5 min,离心,取上清液作为PCR模板DNA。扩增正向引物27F对应于E.coli16S rDNA序列的第8~27个碱基位置,反向引物1492R对应于E.coli 16SrDNA的第1 492~1 510个碱基位置,其序列分别为5′-AGAGTTTGATC(C/A)TGGCTCAG-3′和5′-TACGG(C/T)TACCTTGTTACGACTT-3′。100 μL PCR反应体系组成为:1×PCR缓冲液,1.5 mmol/L MgC12,4×dNTP混合物各200 μmol/L,引物各0.5 μmol/L,TaqDNA聚合酶1 μL(5 U/μL),2 μL DNA原液。PCR反应条件为:96℃预变性5 min;94℃变性1 min,50℃复性1 min,72℃延伸2 min,30个循环;最后72℃温育7 min。
PCR扩增产物经电泳检测后,直接交由上海桑尼生物科技有限公司进行纯化和序列测定。所有的16S rRNA基因序列长度在1000bp左右,已提交到GenBank并获得GenBank收录号。运用Blast程序与数据库中已存在的细菌16S rRNA基因序列进行相似性比较分析;序列的比对及系统发育分析采用MEGA(4.0)软件。
1.3.3 生理生化特性
(1)盐度耐受性试验
细菌分别培养在NaCl质量分数为0、1%、3%、5%、7%、9%和11%的胰蛋白胨大豆琼脂(tryptic soy agar,TSA)培养基上。在28℃培养5 d后,以形成菌落的情况指示该菌的耐盐性。
(2)胞外蛋白酶的测定
胞外蛋白酶的试验可以显示菌株是否生产这类酶,并能初步显示其产酶能力。将脱脂牛奶以终体积分数5%加入灭菌的2216E培养基中。接种后,在28℃培养5 d,通过菌落周围形成的由于蛋白质颗粒被水解而清晰可见的透明环来判断菌株是否产胞外蛋白酶,透明环的直径反映其产酶能力。
(3)胞外脂肪酶的测定
吐温是含有不同链长的水溶性饱和脂肪酸溶液。10%的吐温80单独灭菌,然后以终体积分数1%加入灭菌的2216E培养基中,添加0.01%(w/v)CaCl2·2H2O。接种后,在25℃培养7 d,通过菌落周围形成的明显晶体(由于吐温被水解而形成的不溶性钙盐)判断菌株是否产脂酶。
(4)拮抗菌的筛选
利用琼脂扩散法和双层琼脂法[8]来测定菌株的抗菌活性。接种后,在28℃培养48 h,通过菌落周围因指示菌无法生长而留下的透明圈来确定该菌株产生了抗菌物质。测量菌落的直径(Dc)和抑菌圈的直径(Di),用Di/Dc的比值来确定抗菌能力的大小。供试菌有:E.coli,Staphylococcus aureus,Vibrio anguillarum,Vibrio aestuarianus,Vibrio alginolyticus,Vibrio campbellii,Vibrio carchariae,Vibrio cincinnatiensisi,Vibrio costiola,Vibrio damsela,Vibrio diazotrophicus,Vibrio fisheri,Vibrio fluvialis,Vibrio furnissi,Vibrio gazogenes,Vibrio harveyi,Vibrio vulnificus,Vibrio mediterranei,Vibriomimicus,Vibrionatriegens,Vibrionereis,Vibrio orientalis,Vibrio parahaemolyticus,Vibrio pelagia,Vibrioproteolyticus,Vibriosplendidus,Vibriotubiashii,Vibrio vulnificus,Vibrio logei,Vibrio hollisae,Vibrio parahaemolyticus。
2 结果与分析
2.1 海葵共附生异养细菌的分离
通过以上实验,总共分离得到60株细菌。其中,31株是从海葵的体腔壁分离到的,29株是从体表分离到的。
2.2 16S rRNA基因序列分析
测定和分析了56株菌的16S rRNA基因序列信息,另外4株菌经形态观察和生理生化试验鉴定属于Pseudoalteromonas属,结果见表1。其中,28条基因序列来自分离自体腔壁的细菌,其余的来自海葵体表细菌。所有序列被提交给GenBank,收录号分别是FJ211070,FJ205736,FJ205738,FJ205739,FJ205740-FJ205752,EU939692-EU939694,EU 939696-EU939715和FJ810051-FJ810055。
一般认为,16S rDNA序列同源性>99%,可以认为属于同一个种;16SrDNA序列同源性<98%,可以认为属于不同的种;同源性<95%,可以认为属于不同的属[9]。16S rRNA基因序列分析表明这些菌株具有很高的多样性,分别属于8个目(Alteromonadales,Vibrionates,Peseudomonadales,Oceanospirillales,Rhodobacterales,Bacillales,Actinomycetales,Flavobacteriales),11个科(Colwelliaceae,Alteromonadaceae,Vibrionaceae,Moraxellaceae,Pseudomonadaceae,Hahellaceae,Rhodobacteraceae,Bacillaceae,Staphylococcaceae,Micrococcineae,Flavobacteriaseae),21个属(Colwellia,Vibrio,Acinetobacter,Pseudomonas,Endozoicomonas,Roseovarius,Paracoccus,Loktanella,Leisingera,Sulfitobacter,Bacillus,Staphylococcus,Plantibacter,Microbacterium,Micrococcus,Joostella,Psychroserpens,Cellulophaga,Krokinobacter,Polaribacter,Psychrobacter)。
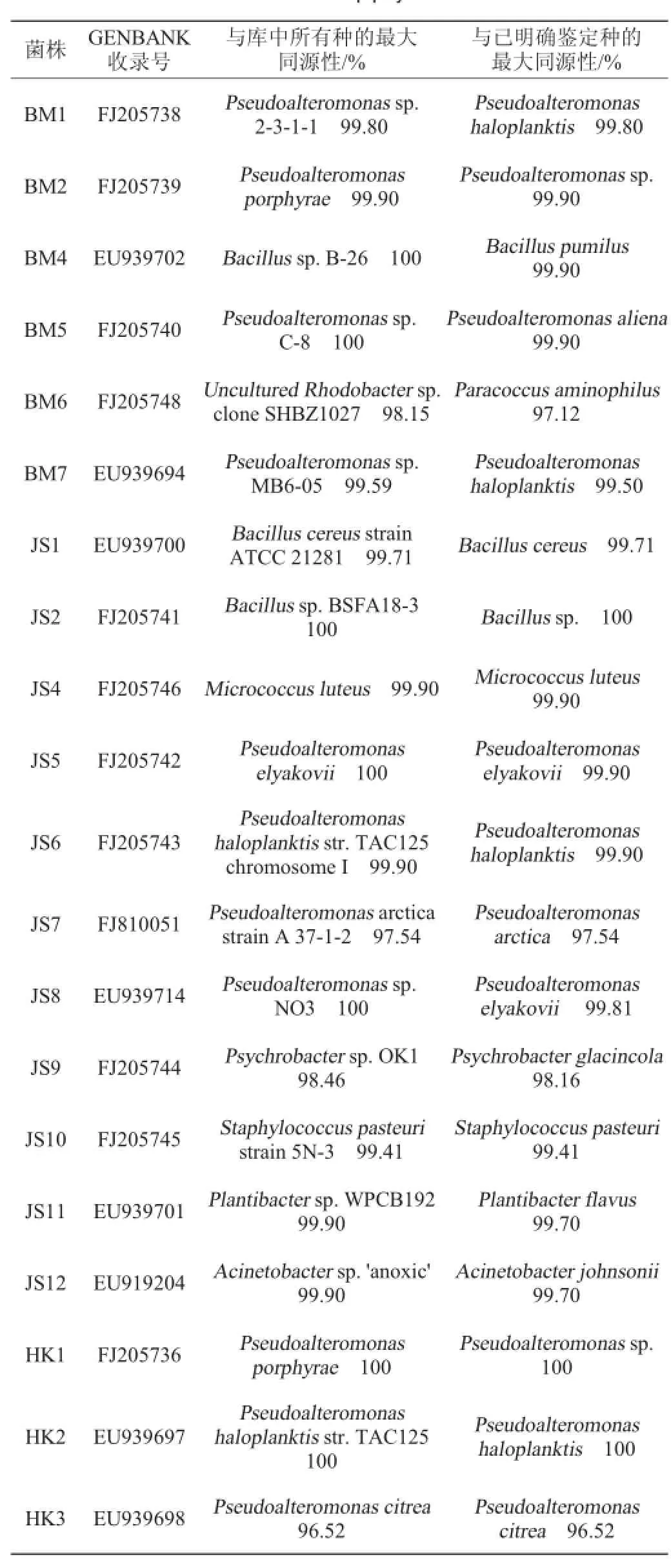
表1 56株海葵附生细菌的16S rRNA部分序列的鉴定结果Table 1 Partial sequence 16S rRNA identification results of 56 strains anemones epiphytic bacteria

续表

续表
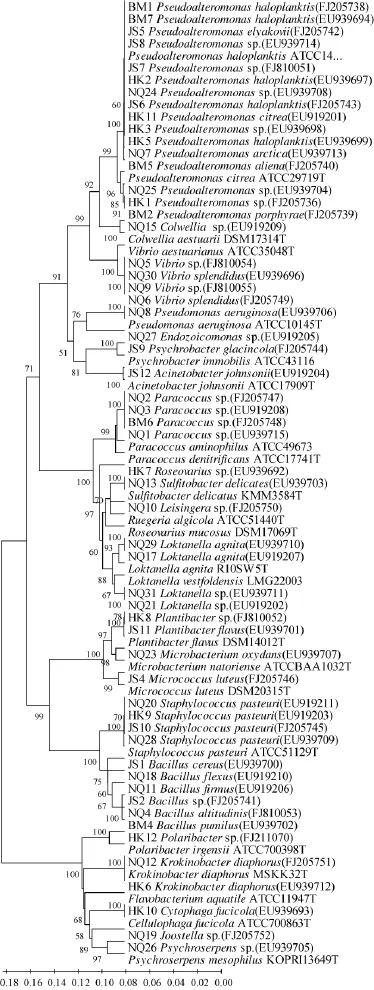
图1 细菌部分的系统发育进化树Fig.1 Phylogenetic tree of bacterium part
依据16S rRNA基因序列分析,得到了56株菌的系统发育分析树(见图1)。
根据16S rDNA序列分析的结果,32株菌可以鉴定到种的水平,另外24株能被鉴定到属的水平。结果显示28.6%的菌株(16株)属于Pseudoalteromonas和近缘的属,其中,13株菌来自海葵体表。所以Pseudoalteromonas属的菌是海葵体表的优势菌种。第二大菌群是Rhodobacterales,11株菌(19.6%)经鉴定属于这个属,其中9株菌是从体腔壁分离到的。这显示Rhodobacterales属菌是海葵体腔壁的优势菌。与已明确鉴定种的最大同源性<97%的菌株可以被认为是潜在的新种[10],根据16S rRNA基因序列,发现7株菌,NQ2、NQ3、NQ10、NQ19、NQ21、BM6和HK3可能是潜在的新种。
2.3 盐度耐受性实验结果
经测试,有30株菌不能在无盐的培养基上生长,有16株可以在无盐情况下生长。另外有7株菌(HK10,NQ1,NQ2,NQ15,NQ29,NQ30,NQ31)在任何盐度测试培养基上都不生长,在除琼脂外同样配方的液态培养基中,也不生长。分析其原因可能是海水中复杂的离子成分对于它们的生长是必需的。大多数菌株在3%盐度下生长状况最好,但是有15株菌例外。菌株BM2,BM5,HK1,HK3,HK7,HK12,NQ5最适盐度分别在5%~7%;而菌株HK8,HK9,JS2,JS11,JS12,NQ2,NQ3,NQ20,NQ22的最适盐度在0~2%。
2.4 胞外酶类的测定
经测定,17株菌产胞外蛋白酶,20株菌能够产生胞外脂肪酶,结果见表2。其中,6株菌(NQ4,NQ5,NQ6,NQ8,NQ14,JS2)产酶能力较高,它们的Dt/Dc比值超过4。这6株菌中,其中5株来自海葵体腔壁,这些菌株可能有助于帮助寄主消化食物中的蛋白。

表2 胞外酶测试结果Table 2 Determination result of extracellular enzyme
2.5 拮抗菌的筛选
经筛选,菌株NQ8对许多供试菌有明显的拮抗作用。试验结果表明NQ8对Vibrio aestuarianus(Dt/Dc=11.01),Vibrio anguillarum(10.95)和Vibrio harveyi(10.05)有较强的拮抗作用。另外,NQ8也拮抗E.coli(3.00),Staphylococcus aureus(4.30),Vibrio gazogelles(4.09)和Vibrio parahaemolyticus(7.88)。弧菌属细菌能够引起许多水产养殖动物的病害,使水产养殖业蒙受巨大损失,因此弧菌拮抗菌在水产养殖业有着巨大的应用潜力。
3 结论
本实验结束后,从威海近海海葵附生微生物中获得具有较大价值的许多菌株。菌株HK12很可能是Polaribacter属的新种,它与已明确鉴定的Polaribacter franzmannii有最高同源性(96.82%)。Polaribacter属建于1998年,该属的菌种都来自海洋,并且大部分是从极地海域分离出的[11-14]。Flavobacteriaceae科包括许多海洋菌株,被称为是系统发育树上的“海洋的进化枝”。菌株NQ5被鉴定为Vibriosp,与库中已明确鉴定菌株的比对结果显示NQ5与Vibrio splendidus(ATCC 33125T)同源性最高,达到96.86%。Vibrio属是1854年建立的,该属有30多个种,其中至少有12株是致病菌[15]。菌株HK3与Pseudoalteromonas arctica有96.52%的同源性。Pseudoalteromonas建立于1995年[16],是Alteromonadales-Pseudoalteromonadaceae门重要的海洋菌属。
许多生物学家认识到共附生细菌是有价值的生物资源。他们研究过海绵、海参、鱼类、虾类等的共附生细菌[17-20]。本研究展示了海葵的价值,海葵共附生细菌有很高的多样性,并且包括许多新的菌种。当然,其他动物甚至整个海洋都是物种资源的宝藏。
[1]WILKINSON C R.Microbial associations in sponges.I.Ecology,physiologyand microbial populationsofcoral reefsponges[J].Mar Biol,1978, 49(2):161-167.
[2]UNSON M D,HOLLAND N D,FAULKNER D J.A brominated secondary metabolite synthesized by the cyanobacterial symbiont of a marine sponge and accumulation of the crystalline metabolite in the sponge tissue[J].Mar Biol,1994,119(1):1-11.
[3]HENTSCHEL U,SCHMID M,WAGNER M,et al.Isolation and phylogenetic analysis of bacteria with antimicrobial activities from the Mediterranean spongesAplysina aerophobaandAplysina cavernicola[J]. FEMS Microbiol Ecol,2001,35(3):305-312.
[4]PIEL J.Metabolites from symbiotic bacteria[J].Nat Prod Rep,2004,21 (4):519-538.
[5]YANG B L,WANG Y Y,LI H,et al.Study on antimicrobial activity of symbiotic and epiphyte microorganisms on marine organisms[C]//5th Younth Annual Academic Meeting,2005.
[6]ZHENG Z H,CHEN L X,HUANG Y J,et al.Antimicrobial activity of symbiotic and epiphyte microorganisms on marine organisms in intertidal zone of Xiamen[J].Journal of Oceanography in Taiwan Strait, 1998,4:12-15.
[7]谢新强,林海鹏,阎冰,等.海洋动物共附生微生物抗B16肿瘤细胞活性菌株的筛选[J].中国海洋药物,2006,25(6):26-30.
[8]马悦欣,于作镇,于书渤,等.大连海区潮间带海藻附生细菌的抗真菌活性[J].大连海洋大学学报,2005,22(1):11-15.
[9]DEVEREUX R,HE S H,DOYLE C L,et al.Diversity and origin of Desulfovibrio species:phylogenetic definition of a family[J].J Bacteriol, 1990,172(7):3609-3619.
[10]FRY N K,WARWICK S,SAUNDERS N A,et a1.The use of 16S ribosomal RNA analyses to investigate the phylogeny of the family Legionellaceae[J].J Gen Microbiol,1991,137(5):1215-1222.
[11]URAKAMI T,ARAKI H,OYANAGI H,et al.Paracoccus aminophilus sp.nov.andParacoccus aminovoranssp.nov.,which utilize N, N-dimethylformamide[J].Int J Syst Bacteriol,1990,40(3):287-291.
[12]LABRENZ M,COLLINS M D,LAWSON P A,et al.Roseovarius toleransgen.nov.,sp.nov.,a budding bacterium with variable bacteriochlorophyll a production from hypersaline Ekho Lake[J].Int J Syst Bacteriol,1999,49(1):137-147.
[13]GOSINK J J,WOESE C R,STALEY J T.Polaribacter gen.nov.,with three new species,P.irgensiisp.nov.,P.franzmanniisp.nov.andP.filamentussp.nov.,gas vacuolate polar marine bacteria of the Cytophaga-Flavobacterium-Bacteroides group and reclassification of‘Flectobacillusglomeratus’asPolaribacter glomeratuscomb.nov[J].Int J Syst Bacteriol,1998,48(1):223-235.
[14]QUAN Z X,XIAO Y P,ROH S W,et al.Joostella marina gen.nov.,sp. nov.,a novel member of the family Flavobacteriaceae isolated from the East Sea[J].Int J Syst Evol Microbiol,2008,58(6):1388-1392.
[15]CHAKRABORTY S,NAIR G B,SHINODA S.PathogenicVibriosin the natural aquatic environment[J].Rev Environ Health,1997,12(2): 63-80.
[16]GAUTHIER G,GAUTHIER M,CHRISTEn R.Phylogenetic analysis of the generaAlteromonas,Shewanella,andMoritellausing genes coding forsmall-subunitrRNAsequencesanddivisionofthegenusAlteromonas into two genera,Alteromonas(emended)andPseudoalteromonasgen. nov.,and proposal of twelve new species combinations[J].Int J Syst Bacteriol,1995,45(4):755-761.
[17]郭秀春,郑立,王小如.酰基高丝氨酸内酯类化合物诱导细菌NJ6-3-1抗菌物质代谢的研究[J].时珍国医国药,2012(6):1350-1353.
[18]WILKINSON C R.Immunological evidence for the Precambrian origin of bacterial symbioses in marine sponges[J].Proc R Soc Lond B,1984, 220(1221):509-518.
[19]VACELET J,BOURY-ESNAULT N,FIALA-MEDIONI A,et al.Carnivorous sponges[J].Nature(Lond.),373(6512):333-335.
[20]向怡卉,苏秀榕,董明敏,等.海参细菌的分离鉴定和生长特性研究[J].中国食品学报,2006,6(1):25-29.
Isolation and diversity analysis of symbiotic heterotrophic bacteria of green sea anemone in Weihai offshore
DONG Xuemin,CONG Peiyun*
(Weihai Product Quality Supervision and Testing Institute,Weihai 264209,China)
In this paper,the total symbiotic heterotrophic bacteria of the green sea anemone was studied.From the surface of the sea anemone and homogenate,60 heterotrophic bacterial strains were isolated by 16S rRNA gene sequence analysis and some physiological and biochemical test,to determine the genus of 56 strains.In addition,the production of extracellular enzyme andVibrioantagonism situation were determined as well.Results showed that the structure diversity of the culture strains community was relatively abundant,16 strains werePseudoalteromonasand related species,other strains were mainly distributed in 19 genuses.Among them,17 strains could produce extracellular proteolytic enzyme;20 strains could produce extracellular lipase;and strains NQ8 had strong antagonism to someVibrio.
green sea anemones;bacterial diversity;16S rRNA genes;phylogene;identification
Q93
A
0254-5071(2014)07-0135-06
10.11882/j.issn.0254-5071.2014.07.031
2014-05-20
董雪敏(1985-),女,助理工程师,本科,研究方向为海洋食品开发利用和质量标准制定。
*通讯作者:丛培云(1962-),男,研究员,本科,研究方向为食品检验。

