血必净对脓毒症大鼠肠道炎症因子表达的影响
杨 玭 黄中伟 刘 春
1 江苏省南通市急救中心 226001; 2 江苏省南通大学附属医院急诊科; 3 江苏省南通大学实验动物中心
严重脓毒症是指脓毒症伴低血压或低灌注和至少一种器官功能障碍[1]。脓毒症的本质是炎症介质的失控释放和炎症反应紊乱[2]。肠道是人体内最大的“内毒素库”和“贮菌所”,机体发生脓毒症时,为保护心、脑等重要器官,全身血液被重新分配,胃肠血流减少,引起肠黏膜缺血,肠道屏障功能受损[3],肠腔内毒素和细菌向肠道外移位可引发肠道局部或全身性不可控制的炎症反应,可以认为胃肠道是SIRS的触发器或始动器,是脓毒症的“中心器官”。在炎症因子复杂的连锁反应中TNF-α和PAF可能起着重要作用。TNF-α是炎症反应过程中出现最早的炎性介质,PAF是迄今发现的最强的血小板聚集诱导剂,通过和细胞膜表面的Pafr结合发挥生物学作用,本实验通过构建脓毒症动物模型,诱导TNF-α、PAF、Pafr表达变化,应用血必净干预治疗,分析脓毒症肠道炎症因子表达规律并探讨血必净对脓毒症大鼠肠道保护作用及可能机制。
1 材料与方法
1.1 动物模型的建立与分组 健康雄性SD大鼠72只,体重(250±20)g(南通大学实验动物中心提供),随机分成3组,即对照组、模型组、治疗组,各组又按术后6h、12h、24h和48h时间点分成亚组,每亚组6只大鼠。脓毒症动物模型采用盲肠结扎穿孔致腹腔感染的方法。3%戊巴比妥钠腹腔注射(40mg/kg)麻醉后,在腹部下方正中切开2cm,逐层分离,探查盲肠,将盲端游离,生理盐水湿润后取出,在远端1/2处结扎,留约直径0.5cm的线环,用18号针头贯通肠道穿刺2次,挤出粪便于腹腔内,回纳,逐层缝合,术后在皮下注射生理盐水10ml/只抗休克。对照组开腹翻动盲肠后关腹,皮下补液。治疗组术前3d起腹腔注射血必净2ml/只,q12h,持续至各亚组实验结束。对照组与模型组给予等量生理盐水。
1.2 标本采集与组织匀浆制备 制模后于6h、12h、24h、48h再次麻醉后腹主动脉抽血,分离血清,距回盲部5cm处取回肠3cm两段,一段置于-80℃冰箱冻存用于制备匀浆,一段放入Ep管中,置于液氮中速冻后,保存于-80℃冰箱,留做RNA提取备用。
1.3 ELISA测定血浆PAF、肠组织匀浆 TNFαPAF ELISA检测试剂盒(上海西唐生物有限公司),TNF-αELISA检测试剂盒(R&D Systems),严格按试剂盒说明书操作。
1.4 RT-PCR法半定量测定Pafr mRNA水平引物由生工生物工程(上海)有限公司合成。(1)RNA提取:采用TRIzol法提取大鼠肠组织中RNA。(2)逆转录:以RNA作为模板,采用Oligo(dt)或随机引物利用逆转录酶反转录成cDNA。(3)PCR扩增:反应体系为20μl:SYBR Green Master Mix 10μl、引物上1μl、引物下1μl、cDNA1μl、补灭菌双蒸水7μl。反应条件:95℃下预变性4min,94℃下变性15s,60℃下退火20s,72℃延伸20s并读取荧光值,45次循环,循环后设置55~90℃每隔0.3℃读荧光值生成熔解曲线。
1.5 统计学分析 数据分析采用PASS13.0统计软件包进行处理,两组间比较用t检验,多组间比较用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 模型组大鼠麻醉苏醒后精神萎靡,随时间推移出现寒战、腹围增加、腹泻,开腹可见浑浊腹水、肠组织粘连、盲肠结扎端发黑肿胀明显、表面有脓苔。治疗组较同时间点模型组症状轻,各时间点大鼠均无死亡发生。
2.2 血浆血小板活化因子(PAF)含量测定 6h时间点开始模型组较对照组血浆PAF含量明显上升(P<0.05),并在模型组内随时间先上升至24h后回落;治疗组在6h、12h、24h、48h血浆PAF含量较模型组有明显下降(P<0.05)。数据详见表1。
表1 三组大鼠各时间点血浆PAF值比较(ng/L,±s)

表1 三组大鼠各时间点血浆PAF值比较(ng/L,±s)
注:与对照组各时间点比较,*P<0.05,与模型组各时间点比较,#P<0.05。
?
2.3 肠组织匀浆中肿瘤坏死因子-α(TNF-α)含量测定 6h时间点,三组肠组织TNF-α无明显变化(P>0.05)。12h时间点开始模型组较对照组肠组织TNF-α含量明显上升(P<0.05),并在模型组内呈先上升至24h后回落;治疗组在12h、24h、48h肠组织TNF-α含量较模型组有明显下降(P<0.05)。数据详见表2。
表2 三组大鼠各时间点肠组织匀浆TNF-α值比较(ng/L,±s)

表2 三组大鼠各时间点肠组织匀浆TNF-α值比较(ng/L,±s)
注:与对照组各时间点比较,*P<0.05,与模型组各时间点比较,#P<0.05。
?
2.4 肠组织Pafr基因表达 6h时间点开始模型组较对照组肠组织Pafr基因表达明显下降(P<0.05),并呈进行性回升;治疗组在6h、12h、24h肠组织Pafr基因表达较模型组明显升高(P<0.05),治疗组在48h肠组织Pafr基因表达与模型组差异不显著(P>0.05),数据详见表3。
表3 三组大鼠各时间点肠组织匀浆Pafr的mRNA表达百分比(%,±s)
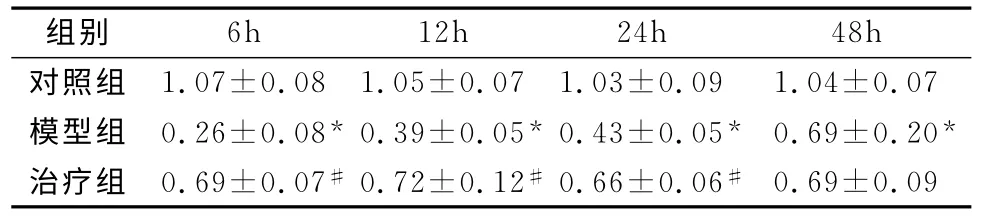
表3 三组大鼠各时间点肠组织匀浆Pafr的mRNA表达百分比(%,±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
?
3 讨论
目前认为革兰氏阴性菌感染和内毒素生成、炎症通路和凝血通路被激活、基因多态性以及信号传导等机制参与了脓毒症的发生、发展过程,炎症介质的失控释放和炎症反应紊乱是脓毒症的本质[2]。本实验运用CLP法制备脓毒症模型,由于盲肠的结扎穿孔,造成腹腔的混合细菌感染,接着细菌内毒素移位进入血液循环,导致全身性炎症反应[4]。结果显示,模型组与治疗组大鼠在制模后有明显的脓毒症表现,出现发热、腹胀、腹泻等器官功能障碍,模拟了临床上严重脓毒症的发病过程。
在正常的免疫应答中,各种相关的细胞因子协调和谐,炎症介质失衡在脓毒症的病理生理过程中起决定性作用[5~7]。在脓毒症机体,LPS能促进上皮细胞凋亡、疏松紧密连接促进细菌移位,损伤肠黏膜屏障,并可激发炎症介质如TNF-α、IL-6等连锁反应,引起全身器官的损伤[3]。TNF-α是炎症反应过程中出现最早、最重要的炎性介质,在造成机体损伤的同时激活炎症效应细胞释放更多的炎症因子如IL-1β、IL-6、IL-8等,使炎症信号产生“级联放大”作用[8]。本研究中脓毒症模型组大鼠TNF-α随时间点逐渐升高至24h后回落。
研究认为PAF在诸多参与胃肠黏膜损害的炎症介质中可能起到“中心放大”的介导作用,是迄今发现的最强的血小板聚集诱导剂。它通过和细胞膜表面的Pafr结合发挥生物作用,具有使血小板聚集、中性粒细胞聚集、中性粒细胞脱颗粒等作用。本实验诱发肠组织产生内源性PAF。PAF很可能是内毒素作用的主要效应因子。本实验中对照组血浆中可检测到PAF,肠组织中检测到Pafr,且水平不随时间推移而变化,提示正常机体内存在PAF及组在6h、12h、24h明显上升,提示血必净不是通过下调Pafr的表达来减弱PAF的生物效应,可能是通过抑制PAF的生成,或是抑制PAF与其受体的结合来减弱PAF的生物效应,从而抑制白细胞活化和其他炎症细胞的释放,最终达到保护微循环的功能。Pafr的表达。模型组大鼠血浆PAF和肠组织Pafr的表达是动态变化的。PAF明显高于对照组且随时间点先升高后回落,与肠组织中TNF-α的表达一致,提示二者参与了脓毒症的发生发展。
本实验同时从受体基因表达角度观察脓毒症时大鼠肠Pafr基因表达的情况。模型组与对照组在相同时间点比较,6h模型组的Pafr水平显著低于对照组,后各时间点逐渐回升,说明模型组肠组织的Pafr表达在脓毒症早期即降低,这与此前有学者在大鼠脑缺血再灌注损伤模型中Pafr表达降低是一致的。由于本实验未在脓毒症早早期设时间点观测,因此无法了解到Pafr表达在何时间点开始下降。本实验中模型组Pafr先下降后逐渐回升,与PAF的表达趋势相反,提示内源性的PAF升高与Pafr表达水平下降可能属于一种反应性负反馈调节。同时实验结果显示PAF在24h处达高峰,而其受体在6h处达低值,峰值的不一致性提示Pafr的表达不是受PAF单因素影响,是受多种机制调控的综合作用。由于本实验采用大鼠脓毒症模型无法精确分析Pafr表达变化的影响因素,只能从整体上对该模型条件下Pafr表达变化作出评价,但其结果更能反映生物体的实际情况,可为以后的深入研究提供思路。
血必净注射液是王今达教授以“细菌、内毒素、炎症介质并治”的理论为指导,反复筛选精炼出的静脉制剂。现代药理研究证明,活血化淤能改善微循环,减少血小板黏附和聚集,保护血管内皮细胞,减少炎性渗出,使抗炎和促炎反应趋向平衡,从而有效减少致炎因子对机体的损伤[9]。本实验用血必净干预治疗脓毒症大鼠后,PAF、TNF-α指标较模型组降低,提示脓毒症时血必净能有效拮抗内毒素,抑制炎症因子的释放,保护血管内皮细胞,从而发挥对脓毒症肠道的保护作用。治疗组的Pafr表达较模型
[1] Levy MM,Fink MP,Marshall JC,et al.2001SCCM/ESICM/ACCP/ATS/SIS international sepsis definitions conference〔J〕.Crit Care Med,2003,31(4):1250-1256.
[2] Nguyen HB,Rivers EP,Abrahamian FM,et al.Severe sepsis and septic shock:review of the literature and emergency department management guidelines〔J〕.Ann Emerg Med,2006,48:28-54.
[3] Wischmeyer PE,Kahana M,Wolfson R,et al.Glutamine reduces cytokine release,organ damage,and mortality in a rat model of endotoxemia〔J〕.Shock,2001,16:398-402.
[4] 王东强,田永超,张书荷,等.血必净联合连翘注射液对脓毒症大鼠影响的肝基因芯片研究〔J〕.中华劳动卫生职业病杂志,2011,29(6):417-420.
[5] Osuchowski MF,Welch K,Siddiqui J,et al.Circulating cytokine/inhibitor profiles reshape the understanding of the SIRS/CARS continuum in sepsis and predict mortality〔J〕.J Immunol,2006,177:1967-1974.
[6] Osuchowski MF,Welch K,Yang H,et al.Chronic sepsis mortality characterized by an individualized inflammatory response〔J〕.J Immunol,2007,179:623-630.
[7] Xiao H,Siddiqui J,Remick DG.Mechanisms of mortality in early and late sepsis〔J〕.Infect Immun,2006,74:5227-5235.
[8] Suzuki K,Nakaji S,Yamada M,et al.Systemic inflammatory response to exhaustive exercise.Cytokine kinetics〔J〕.Exerc Immunol Rev,2002,8:6-48.
[9] 李志军,孙元莹,吴元良,等.血必净注射液防治家兔应激性脏器损伤的研究〔J〕.中国危重病急救医学,2006,18(2):105.

