应用旋转灌注式生物反应系统体外构建组织工程神经的研究*
朱 慧,薛成斌,徐 茜,,顾晓松,顾剑辉
(1南通大学附属医院;2南通大学江苏省神经再生重点实验室,江苏226001)
·再生医学·
应用旋转灌注式生物反应系统体外构建组织工程神经的研究*
朱 慧1,2**,薛成斌2,徐 茜1,2,顾晓松2,顾剑辉1
(1南通大学附属医院;2南通大学江苏省神经再生重点实验室,江苏226001)
目的:模拟微重力建立体外构建组织工程神经的方法,评价微重力环境对支持细胞生长的影响。方法:将皮肤前体细胞诱导分化的施万细胞作为支持细胞,联合壳聚糖神经导管、聚乳酸乙醇酸共聚物纤维支架,利用旋转灌注式生物反应系统体外培养,对照组为传统的静止培养。培养不同时间点取样,利用结晶紫染色,免疫荧光细胞化学染色,CCK-8细胞活力检测,扫描电子显微镜等方法观察支持细胞的生长状况。结果:体外培养7天后CCK-8细胞活力检测提示贴附在导管和纤维支架表面的细胞数量最多、活力最好,应用旋转灌注式生物反应系统体外培养较对照组高出约2倍,随后在14天、21天时略有下降;结晶紫染色及扫描电子显微镜观察显示7天时,与对照组相比,实验组支持细胞呈立体生长,分泌大量细胞外基质,生长状态更好;S100荧光免疫细胞化学染色显示微重力环境下施万细胞的标志物未发生改变。结论:模拟微重力环境较传统静止培养能更高效、优质地在体外构建组织工程神经。
周围神经;组织工程;体外构建;生物反应器;皮肤源性前体细胞
1 材料和方法
1.1 材料 新生SD大鼠,SPF级(南通大学实验动物中心)。DMEM低糖培养基,F-12,Fungizone,B27,N2(Invitrogen公司),bFGF,EGF,层粘连蛋白,多聚赖氨酸(Collaborative公司),胎牛血清(Hyclone公司),XI型胶原酶,胰蛋白酶,Forskolin,兔S100多克隆抗体(Sigma公司),Heregulin-1β(R&D Systems公司),CCK-8试剂盒(Donjindo公司),Alexa Fluor488标记的羊抗兔IgG(Life Technology公司),余试剂均为分析级。旋转灌注式细胞培养系统(RCMW)(Synthecon公司)。支架材料由壳聚糖神经导管(南通大学神经再生重点实验室)和聚乳酸乙醇酸(PLGA)纤维(南通华利康医疗器械有限公司)。
1.2 方法
1.2.1 体外构建:分离培养新生SD大鼠SKPs,定向诱导为分化SKP-SCs并进行体外扩增[9]。将SKPSCs细胞悬液与支架材料放入注满完全培养基的旋转培养容器,细胞最终密度为106/mL,置37℃5% CO2培养箱中培养,转速为10r/min,使细胞与支架材料充分接触,贴附24小时后调整微重力生物反应器旋转速度,使支架材料悬浮于培养液中;对照组支架材料中注入密度为106/mL的细胞悬液,培养24h后将支架材料移入新鲜培养基中继续培养。
1.2.2 效果评价:培养第1、2、3、4、7、14、21天后分别取样观察组织工程神经内细胞的生长状态。部分样本移至24孔板内,每孔加2mL含N2,Heregulin-1β和Forskolin的DMEM/F12(3∶1)和200μL CCK-8,37℃继续培养2 h,酶标仪450 nm下测定其光密度值。每个组设3个复孔,实验重复3次。将培养7天各组的组织工程神经用0.01mol/L PBS浸洗3次,4%多聚甲醛固定30min,0.01 mol/L PBS浸洗3次,部分样本加入结晶紫染10min,自来水浸洗,直至导管支架无色,细胞呈蓝紫色;部分样本封闭液37℃孵育30min,一抗兔S100多克隆抗体(1∶400),4℃孵育过夜,0.01 mol/L PBS浸洗3次,Alexa FluorR488标记的羊抗兔IgG(1∶400),37℃孵育1h,0.01 mol/L PBS浸洗3次,倒置显微镜(OLYMPUS IX 51)下观察并采集图像;部分样本浸入预冷的4%戊二醛溶液前固定,1%锇酸后固定,梯度乙醇脱水,叔丁醇置换,冷冻干燥,镀膜,扫描电镜(JEM-T300,JEOL Inc.,Japan)观察移植物内支持细胞的生长状态。
1.3 统计学处理 应用IBM SPSS 22.0统计软件将数据进行单因素方差分析,所得结果以均数±标准差表示,P<0.05为差异有统计学意义。
2 结 果
2.1 CCK-8法检测细胞活力 SKP-SCs与支架材料在RCMW系统中培养和传统静止培养7天内细胞活力均逐渐提高,7天后略有下降。在RCMW系统中培养3天后细胞活力显著优于传统静止培养(图1)。

图1 CCK-8法检测细胞在RCMW系统中培养及传统静止培养过程中细胞活力及增殖状况
2.2 结晶紫染色观察 SKP-SCs与支架材料在RCMW系统中培养7天后可见壳聚糖导管内面贴附大量双极或三极细胞,且成团聚集生长,数量明显多于传统静止培养(图2)。
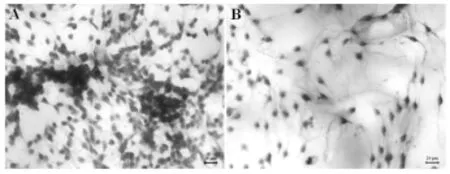
图2 体外培养7天的组织工程化神经结晶紫染色后的组织学观察结果
2.3 免疫细胞化学染色观察 在RCMW系统中培养7天后的神经导管内壁和PLGA纤维支架表面均匀贴附大量S100阳性的细胞,细胞数量优于对照组,提示在RCMW系统中培养支持细胞性质保持稳定(图3)。
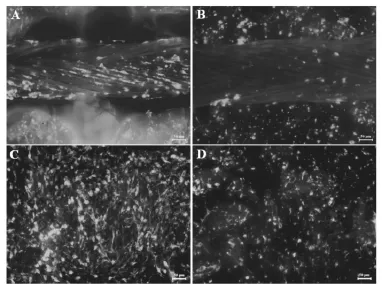
图3 培养7天的组织工程化神经抗S100抗体免疫荧光化学染色的观察结果
2.4 扫描电镜观察 在RCMW系统中培养7天后,与传统静止培养相比,神经导管内壁和PLGA纤维支架表面均匀贴附大量细胞,细胞形态更立体,细胞分泌大量细胞外基质(图4)。
3 讨 论
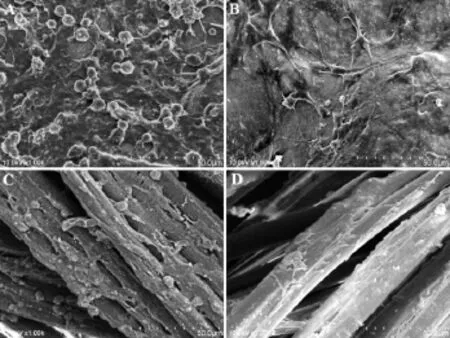
图4 培养7天的组织工程化神经扫描电镜的观察结果
构建细胞型组织工程化神经通常采用体外静置培养或先桥接神经移植物后注射支持细胞悬液的方法,存在着细胞流失,细胞状态未知、归属难于把握等诸多不可控因素。旋转式细胞培养系统(RCCS)近年来在组织工程基础研究领域得到了广泛的应用[9-10],在此基础上旋转灌注式细胞培养系统(RCMW)持续绕水平轴旋转,使细胞和载体处于悬浮状态并能够持续不断的更换支持细胞生长所需的培养基和气体,创造更加利于细胞存活的三维立体环境,有利于支持细胞维持空间分布,促进体外增殖和细胞间的物质交换。本研究利用RCMW系统能够在短时间内构建含大量支持细胞的组织工程化神经,较传统的静止培养,既缩短了培养时间又达到了较好的细胞贴附效果和生长状态。本研究通过对RCMW系统各种培养条件的进一步摸索,如细胞悬液的最佳密度,最适宜的转速以及最佳换液时间等确定了统一的培养体系,通过规范各操作步骤,获得了一种标准化制备组织工程化神经的方法,为应用该系统实现多种细胞多层贴附培养[11]提供了实验依据。
[1]Gu X,Ding F,Williams DF.Neural tissue engineering options for peripheral nerve regeneration[J].Biomaterials, 2014,35(24):6143-6156.
[2]Gu X,Ding F,Yang Y,et al.Construction of tissue engineered nerve grafts and their application in peripheral nerve regeneration[J].Prog Neurobiol,2011,93(2):204-230.
[3]Toma JG,Akhavan M,Fernandes KJ,et al.Isolation of multipotent adult stem cells from the dermis of mammalian skin[J].Nat Cell Biol,2001,3(9):778-784.
[4]Fernandes KJ,Kobayashi NR,Gallagher CJ,et al.Analysis of the neurogenic potential of multipotent skin-derived precursors[J].Exp Neurol,2006,201(1):32-48.
[5]Guo W,Miao C,Liu S,et al.Efficient differentiation of insulin-producing cells from skin-derived stem cells[J].Cell Prolif,2009,42(1):49-62.[6]Lavoie JF,Biernaskie JA,Chen Y,et al.Skin-derived precursors differentiate into skeletogenic cell types and contribute to bone repair[J].Stem Cells Dev,2009,18(6):893-906.
[7]Kang HK,Min SK,Jung SY,et al.The potential of mouse skin-derived precursors to differentiate into mesenchymal and neural lineages and their application to osteogenic induction in vivo[J].Int J Mol Med,2011,28(6):1001-1011.
[8]Steinbach SK,El-Mounayri O,Dacosta RS,et al.Directed differentiation of skin-derived precursors into functional vascular smooth muscle cells[J].Arterioscler Thromb Vasc Biol,2011,31(12):2938-2948.
[9]Li S,Ma Z,Niu Z,et al.NASA-approved rotary bioreactor enhances proliferation and osteogenesis of human periodontal ligament stem cells[J].Stem Cells Dev,2009,18(9):1273-1282.
[10]Marsano A,Wendt D,Raiteri R,et al.Use of hydrodynamic forces to engineer cartilaginous tissues resembling the nonuniform structure and function of meniscus[J].Biomaterials, 2006,27(35):5927-5934.
[11]Tang X,Xue C,Wang Y,et al.Bridging peripheral nerve defects with a tissue engineered nerve graft composed of an in vitro cultured nerve equivalent and a silk fibroin-based scaffold[J].Biomaterials,2012,33(15):3860-3867.
Study on the construction of tissue engineering nerves in vitro by perfusion rotary cell culture system(RCCS)
ZHU Hui1,2,XUE Chengbin2,XU Xi1,2,GU Xiaosong2,GU Jianhui1
(1The Affiliated Hospital of Nantong University;2Jiangsu Key Laboratory of Neuroregeneration,Nantong University,Jiangsu 226001)
Objective:To establish a method for construction of tissue engineered nerve in vitro mimicking microgravity.Methods:As seed cells,Schwann cells(SCs)differentiated from skin derived precursors(SKPs)were cultured with chitosan nerve conduit and polylactic glycolic acid (PLGA)copolymer fiber scaffold by using a perfusion rotary bioreactor systems in vitro.Traditional static culture was the control group.The crystal violet staining,immunofluorescence staining, CCK-8 cell viability testing and scanning electron microscopy were applied for evaluating the growth of seed cells at different time points.Results:7 days after culture,the number and viability of seed cells approached the peak in both groups, while they were approximately twice as much in the perfusion RCCS as in the control group.Then they decreased slightly at 14 days and 21 days after culture in both groups.Crystal violet staining and scanning electron microscopy showed that the experimental group showed a three-dimensional growth of the seed cells at 7 days after culture,which secreted considerable extracellular matrix,compared with the control group.The immunofluorescence staining showed that it did not change the Schwann cell’s marker S100 cultured under a microgravity environment.Conclusions:The construction of tissue engineering nerves in vitro was more efficient with higher quality in the RCMW than the traditional static culture.
peripheral nerve;tissue engineering;construction in vitro;bioreactor;skin derived precursor
Q819
A
国家863主题资助项目(2012AA020502);国家973计划子课题资助项目(2014CB542202);国家自然科学基金资助项目(81130080,81402447)。
2014-07-28
1006-2440(2014)04-0307-04
**[作者简介]朱慧,女,汉族,江苏江阴人,生于1985年1月,在读博士,助理研究员,研究方向:周围神经损伤的分子机制。 通信作者:顾剑辉,13809081785@163.com
近年来,由于车祸、锐器等外伤而造成周围神经挤压、牵拉、挫裂损伤的病例逐年增多[1]。对于长距离的周围神经缺损,临床以自体神经修复为主要治疗手段,但是由于自体神经来源有限,且造成供区局部神经功能障碍等缺点,研究人员试图寻找替代自体神经修复的方法。目前,运用含支持细胞的组织工程化神经修复长距离周围神经缺损已经成为研究热点。因此本研究利用旋转灌注式细胞培养体系(RCMW)系统进行组织工程化神经的体外构建。考虑到施万细胞的来源有限,可以通过对多能细胞进
行诱导分化获得大量的施万细胞。因此,在众多备选干细胞中,易分离、易培养、易分化成为挑选支持细胞的重要条件[2]。2001年,研究人员在人及大、小鼠皮肤真皮层成功获得的一种多潜能细胞,即皮肤源性前体细胞(SKPs)[3]。SKPs来源于神经嵴,能够向外周神经元、施万细胞、脂肪细胞、胰岛素细胞、软骨细胞等分化[4-8]。由于皮肤组织容易获得,本研究选用大鼠SKPs诱导分化的施万细胞(SKP-SCs)作为构建组织工程化神经的支持细胞,以壳聚糖导管联合PLGA纤维作为支架材料,应用RCMW系统体外构建组织工程化神经。此系统在神经组织工程基础研究领域的应用未见报道。本研究旨在寻找合适的支持细胞和体外构建方法,同时为最终制备快速化、标准化、产业化组织工程神经,实现临床神经缺损治疗提供理论基础。

