BAG2对蛋白酶体抑制剂诱导人甲状腺癌细胞凋亡作用影响的观察
王玉林 王彪 孟欣 巴颖
1.大连医科大学附属第一医院普外科,辽宁 大连 116011;2.中国医科大学基础医学院生物化学与分子生物学教研室,辽宁 沈阳 110001;3.大连医科大学附属第一医院内分泌科,辽宁 大连 116011
BAG2对蛋白酶体抑制剂诱导人甲状腺癌细胞凋亡作用影响的观察
王玉林1 王彪2 孟欣2 巴颖3
1.大连医科大学附属第一医院普外科,辽宁 大连 116011;2.中国医科大学基础医学院生物化学与分子生物学教研室,辽宁 沈阳 110001;3.大连医科大学附属第一医院内分泌科,辽宁 大连 116011
背景与目的:蛋白酶体抑制剂对不同组织来源的肿瘤均有抑制其增长和促进细胞凋亡的作用,其作用机制可能与Bcl-2相关抗凋亡基因2(Bcl-2-associated athanogene 2,BAG2)有关,本研究探讨BAG2在蛋白酶体抑制剂诱导甲状腺癌细胞凋亡中的作用。方法:选取人甲状腺未分化癌细胞系ARO、FRO、KTC1、KTC2、KTC3、8305C和8505C,分别设培养液处理空白对照组、蛋白酶体抑制剂MG132处理组;利用实时定量逆转录聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测各组细胞BAG2 mRNA表达及MG132诱导其表达的时效性;利用蛋白质印迹法(Western blot)检测各组细胞BAG2蛋白表达。结果:MTT结果显示,FRO和KTC2细胞系对蛋白酶体抑制剂最为敏感,与空白对照组相比,MG132能不同程度的增加各种细胞BAG2 mRNA及蛋白的表达水平(P<0.01),在FRO和KTC2细胞中,BAG2 mRNA水平较对照组增加20~25倍,蛋白质的表达水平也显著增加;时间效应实验中,敏感的FRO细胞BAG2 mRNA水平增加快,没有延迟期;并且增加的最高水平显著高于非敏感的ARO细胞(P<0.01)。结论:BAG2是由蛋白酶体抑制作用诱导产生的新型分子,在蛋白酶体抑制剂诱导的甲状腺癌细胞的死亡中起着促凋亡作用。
Bcl-2相关抗凋亡基因2;蛋白酶体抑制剂;凋亡;甲状腺肿瘤
蛋白酶体抑制剂对不同组织来源的肿瘤(包括实体肿瘤和血液恶性肿瘤)均有抑制其增长和促进细胞凋亡的作用[1]。尽管在临床前期和临床中获得了蛋白酶体抑制剂治疗肿瘤的一些证据,但这些药物诱导细胞凋亡的机制仍不十分清楚。因此,进一步探讨这些药物作用的分子机制必将给优化临床应用带来益处。
近年来研究发现,人Bcl-2相关抗凋亡基因(Bcl-2-associated athanogene,BAG)家族成员有6种(BAG1~6),在酵母菌、无脊椎动物、其他哺乳动物和植物中均发现其同源蛋白[2]。所有BAG蛋白,羧端附近均含有保守的BAG结构域,而氨基端大不相同[2-4]。BAG3作为能与HSP70组成复合物的蛋白被发现,是一种抗凋亡基因[5-6],是应用蛋白酶体抑制剂中影响凋亡效应的一类破坏因子[7]。但BAG家族中其他成员在肿瘤中的作用,国内外少有报道,为此,本研究检测蛋白酶体抑制剂MG132对不同人甲状腺未分化癌细胞系中BAG2的影响,旨在探讨BAG2在蛋白酶体抑制剂诱导甲状腺癌细胞凋亡中的作用。
1 材料和方法
1.1 细胞株及其培养
人甲状腺未分化癌细胞系ARO、FRO、KTC1、KTC2、KTC3由日本长崎大学大学院生物医学研究科山下俊一先生赠予。8305C和8505C细胞系购自美国标准生物品收藏中心(American Type Culture Collection,ATCC)。这7种甲状腺未分化癌细胞系是常见并广为应用研究的细胞系,恶性度高,细胞增殖及侵袭力强。所有细胞均于含10%胎牛血清DMEM1640 (购自Sigma公司)培养基、37 ℃、CO2体积分数为5%、饱和湿度下培养,2~3 d传代1次,选用对数生长期细胞进行实验。
1.2 细胞分组及干预处理
设立培养液处理空白对照组、蛋白酶体抑制剂处理组,分别向各组细胞中加入蛋白酶体抑制剂MG132(2 μmol/L,使用浓度参考张海燕等[8]的研究)和培养液,作用8 h;选取未分化甲状腺癌细胞系ARO和FRO,分别代表对蛋白酶体抑制剂耐药和敏感的细胞。分别向各组细胞中加MG132(2 μmol/L),分别作用1、2、4、8、12、16、24和48 h。
1.3 四氮唑蓝法行细胞生存分析
将细胞接种于96孔板(1×104/孔),次日将各组细胞培养液更换成含2%胎牛血清培养液,并分别加入蛋白酶体抑制剂MG132培养24 h。参照文献[9],每孔加培养液180 μL和5 mg/mL MTT(购自Sigma公司)20 μL,继续培养4 h,加150 μL二甲基亚砜(购自Sigma公司),摇床震摇15 min,置酶标仪(Ascent Software Version 2.4)测492 nm处的吸光度值(A值),细胞生长抑制率(IR) =(A空白对照组-A实验组)/A空白对照组×100%。
1.4 实时定量逆转录聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测各组细胞BAG2 mRNA表达
收集各组细胞,参照文献[10],采用异硫氰酸肌法提取总RNA,用Oligo(dT) 12-18和SuperscriptⅡ进行逆转录,用双标记荧光探针混合物(SYBR Green PCR Master mix)在ABI prism7000自动序列分析系统中采用qRT-PCR进行分析,每组重复3次。BAG2基因引物特异序列顺义链:5′-CTTTGAGAGAAGCAGCAACTG-3′,反义链:5′-TGACACTTCAACGGTGAGAG-3′。β-actin作为内参照,其引物特异序列顺义链:5′-GAGACCTTCAACACCCCAGCC-3′,反义链:5′-GGATCTTCATGAGGTAGTCAG-3′。BAG2扩增结果用β-actin进行标化。
1.5 蛋白质印迹法(Western blot)检测BAG2蛋白表达
收集各组细胞,用含有蛋白酶抑制剂的裂解缓冲液(20 mmol/L Tris-HCl;150 mmol/L NaCl;2 mmol/L EDTA;1% Triton X-100)裂解破碎离心后,用BCA蛋白分析试剂盒对上清蛋白进行定量。以20 μg等量的蛋白上样,
用12%SDS-聚丙烯酰胺凝胶电泳和电转移法转至硝酸纤维素膜上,以5%脱脂奶粉TBST封闭后,依次进行一抗鼠抗人BAG2(购自美国Alexis Biochemicals公司)4 ℃温育过夜,辣根过氧化物酶标记的二抗室温温育1 h,进行ECL化学发光显像。以鼠抗人γ-tubulin单克隆抗体(购自中国Sigma-Aldrich公司)作为内参照,应用NIH IMAGE 1.4软件进行计算机图像分析;以γ-tubulin标化后各实验组与对照组蛋白A值的比值作为产物相对含量。
1.6 SiRNA敲低BAG2表达检测MG132作用
B A G 2特异性s i R N A序列C C A U CAAGCUAUUAGAGCAUU用于敲低BAG2表达,与已知基因无同源的siRNA序列CCGU A U C G U A A G C A G U A C U最为对照。LipofectamineTM2000(Invitrogen,CA,USA)作为载体,依手册进行。转染FRO细胞系,MG132作用后检测凋亡细胞比率。
1.7 统计学处理
2 结 果
2.1 不同甲状腺癌细胞对蛋白酶体抑制剂MG132的敏感性
通过MTT法检测发现,作用24 h后ARO和8305C细胞系几乎无变化,其细胞死亡是有限的,即使高浓度蛋白酶体抑制剂作用下,细胞死亡率仍低于30%,提示其对蛋白酶体抑制剂完全不敏感;FRO和KTC2细胞系IC50范围为0.5~1 μmol/L,提示其反应最敏感;KTC1和KTC3细胞系IC50值于药物浓度较高水平,为1~2.0 μmol/L,对蛋白酶体抑制剂呈中度敏感(图1)。
2.2 蛋白酶体抑制剂对甲状腺未分化癌细胞中BAG2 mRNA表达的影响
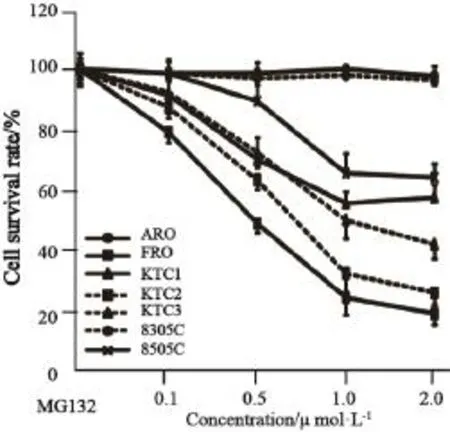
图1 蛋白酶体抑制剂MG132作用24 h对各种甲状腺癌细胞的不同杀伤作用Fig. 1 Killing effect of proteasome inhibitor MG132 for thyroid cancer cell lines within 24 h
实时定量PCR检测结果表明:蛋白酶体抑制剂MG132(2 μmol/L)作用于甲状腺未分化癌细胞8 h后,BAG2 mRNA表达水平均不同程度明显高于空白对照组(P<0.01)。在FRO和KTC2细胞中,BAG2 mRNA水平较对照组增加20~25倍,而在其他细胞中,观察到BAG2 mRNA水平仅增加3~10倍(图2A)。
2.3 蛋白酶体抑制剂对甲状腺未分化癌细胞中BAG2 蛋白合成的影响
Western blot检测结果显示,与观察到的BAG2 mRNA的不同诱导作用相一致,BAG2蛋白的表达在FRO和KTC2中显著增加,但是在ARO、8305C和8505C中仅有轻微的增加(图2B)。
2.4 蛋白酶体抑制剂诱导甲状腺未分化癌细胞中BAG2 mRNA的时效分析
实时定量RT-PCR检测结果表明,在MG132敏感的FRO细胞中,BAG2 mRNA水平的增加起始没有明显的时间间隔,早在1 h时,BAG2表达即显著增加,作用8 h达到高峰;作用16 h后,由于大量细胞死亡BAG2的表达逐渐下降(图2A)。MG132耐药的ARO细胞中,BAG2 mRNA开始蓄积前有8~16 h的延后,作用8 h首次观察到BAG2的显著增加,24~48 h达到顶峰(图2B)。另外,与FRO细胞组相比,ARO细胞中BAG2 mRNA诱导的最高水平较前者显著升高(P<0.01,图3)。
2.4 敲低BAG2表达后MG132作用结果
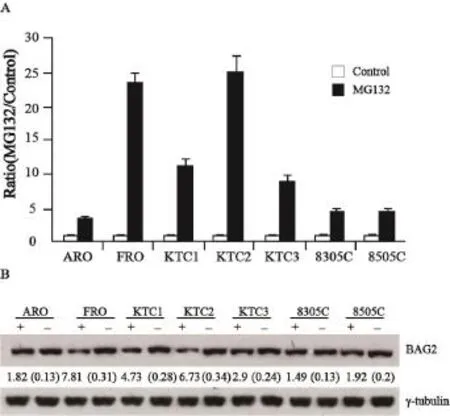
图2 MG132上调甲状腺未分化癌细胞中BAG2 mRNA及蛋白的表达Fig. 2 Upregulation of BAG2 in various type of cancer cells treated with MG132
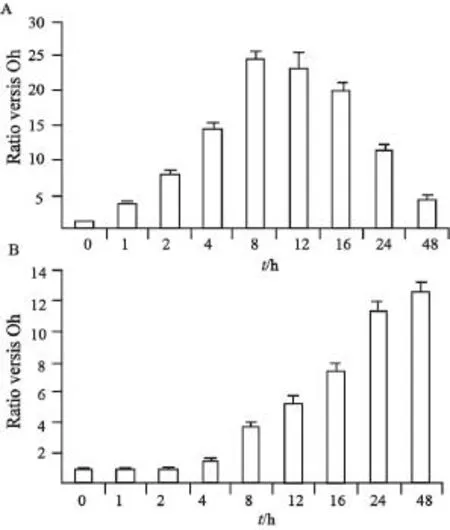
图3 MG132上调甲状腺未分化癌细胞中BAG2 mRNA的时效分析Fig. 3 Time course of induction of BAG2 transcription by MG132
SiRAN转染FRO细胞系后,BAG2蛋白表达水平显著降低,MG132诱导凋亡结果显示,转染导致BAG2蛋白表达下调在一定程度上延迟并抑制了MG132的凋亡诱导作用(P<0.01,图4)。
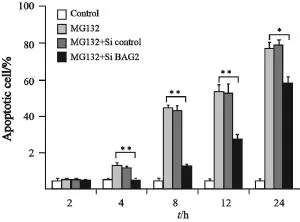
图4 敲低BAG2后MG132凋亡诱导作用研究Fig. 4 Down-regulation of BAG2 delayed and partially suppressed MG132-induced cell death
3 讨 论
BAG2蛋白是BAG家族中的成员之一。近来,有文献报道BAG2与热休克蛋白70-C端相互影响蛋白(carboxyl terminus of heat shock protein 70-interacting protein,CHIP)的羧基端相互作用[11-12],HSP70相关的遍在蛋白连接酶通过与细胞质的分子伴侣蛋白相关的泛素错误折叠蛋白参与泛素蛋白酶体系统[13]。BAG2通过CHIP以分子伴侣蛋白依赖的调节机制来抑制错误折叠蛋白的泛素化[11-12],提示BAG2在调节蛋白酶体介导的伴侣蛋白底物的降解中起着内源的作用。目前,除了知晓BAG2可以抑制CHIP的作用外,对BAG2的诱导作用及其正常功能了解甚少。本研究首次报道了蛋白酶体抑制剂对BAG2的诱导作用,并且这种诱导作用与其对甲状腺未分化癌的不同杀伤作用有关。
本研究先前的研究证实不同的甲状腺未分化癌细胞系对蛋白酶体抑制剂诱导的细胞凋亡具有不同的敏感性:FRO和KTC2对蛋白酶体抑制剂是最敏感的,而ARO和8305C是最耐药的[14]。本研究结果发现,在敏感的FRO和KTC2细胞中,MG132对BAG2基因的诱导作用无论是mRNA水平还是蛋白水平均明显高于其他耐药细胞。提示在对蛋白酶体抑制剂敏感的细胞中,BAG2更易被诱导上调;上调的BAG2可能
加强蛋白酶体抑制剂对肿瘤细胞的杀伤作用,起到促进细胞凋亡的作用。
时效分析中,我们选取了最为敏感的FRO和耐药的ARO细胞系作为代表进行分析,在蛋白酶体抑制剂诱导甲状腺未分化癌细胞中BAG2的时效分析实验中发现,在敏感的FRO细胞中,BAG2上调快、幅度大;而耐药的ARO细胞中,BAG2上调延迟、幅度小。与我们先前研究的结果密切相关[14],即蛋白酶体抑制剂对FRO细胞起效快,细胞凋亡率高;而对耐药的ARO细胞起效慢,细胞凋亡率低。这可能提示BAG2在诱导甲状腺未分化癌细胞凋亡中与蛋白酶体抑制剂起协同作用。
本研究应用SiRNA技术下调FRO细胞系中BAG2的表达,继续用MG132处理后发现,MG132的凋亡诱导作用被延迟并在一定程度上被抑制,这一结果提示BAG2在细胞凋亡中与MG132发挥着协同作用。
总之,本研究首次发现蛋白酶体抑制剂可以诱导甲状腺未分化癌细胞中BAG2的生成;BAG2的上调使得细胞对蛋白酶体抑制剂更为敏感,提示BAG2在应答蛋白酶体抑制剂中可能具有促进凋亡的作用。为此,进一步探讨BAG2的促凋亡作用机制可能促进我们理解BAG家族蛋白的作用,为更好的优化应用蛋白酶体抑制剂治疗肿瘤提供理论依据。
[1]ADAMS K W, COOPER G M. Rapid turnover of mcl-1 couples translation to cell survival and apoptosis[J]. J Biol Chem, 2007, 282(9): 6192–6200.
[2]TAKAYAMA S, REED J C. Molecular chaperone targeting and regulation by BAG family proteins[J]. Nat Cell Biol, 2001, 3(10): 237–241.
[3]KALIA L V, KALIA S K, CHAU H, et al. Ubiquitinylation of α-synuclein by carboxyl terminus Hsp70-interacting protein (CHIP) is regulated by Bcl-2-associated athanogene 5 (BAG5)[J]. PLoS One, 2011, 6(2): e14695.
[4]WOOD J, PRING M, EVESON J W, et al. Co-overexpression of Bag-1 and heat shock protein 70 in human epidermal squamous cell carcinoma: Bag-1-mediated resistance to 5-fluorouracil-induced apoptosis[J]. Br J Cancer, 2011, 104(9): 1459-1471.
[5]ROSATI A, GRAZIANO V, DE LAURENZI V, et al. BAG3: a multifaceted protein that regulates major cell pathways[J]. Cell Death Dis, 2011, 2: e141.
[6]SUZUKI M, IWASAKI M, SUGIO A, et al. BAG3 (Bcl-2-associated athanogene 3) interacts with MMP-2 to positively regulate invasion by ovarian carcinoma cells[J]. Cancer Lett, 2011, 303(1): 65-71.
[7]张海燕, 高雁艳, 刘宝琴, 等. Bcl-2相关抗凋亡基因3对蛋白酶体抑制剂抗肿瘤作用影响的观察[J]. 中华肿瘤防治杂志, 2009, 16(21): 1621-1624.
[8]张海燕, 都镇先, 邓娓娓, 等. 蛋白酶体抑制剂对甲状腺未分化癌细胞凋亡影响及其机制的探讨[J]. 中华肿瘤防治杂志, 2013, 2: 106-109.
[9]WANG H Q, NAKAYA Y, DU Z, et al. Interaction of presenilins with FKBP38 promotes apoptosis by reducing mitochondrial Bcl-2 [J]. Hum Mol Genet, 2005, 14(13): 1889-1902.
[10]WANG H Q, DU Z X, ZHANG H Y, et al. Different induction of GRP78 and CHOP as a predictor of sensitivity to proteasome inhibitors in thyroid cancer cells[J]. Endocrinology, 2007, 148(7): 3258-3270.
[11]ARNDT V, DANIEL C, NASTAINCZYK W, et al. BAG-2 acts as an inhibitor of the chaperone-associated ubiquitin ligase CHIP[J]. Mol Biol Cell, 2005, 16(12): 5891-5900.
[12]DAI Q, QIAN S B, LI H H, et al. Regulation of the cytoplasmic quality control protein degradation pathway by BAG2[J]. J Biol Chem, 2005, 280(46): 38673–38681.
[13]CONNELL P, BALLINGER C A, JIANG J, et al. The cochaperone CHIP regulates protein triage decisions mediated by heat-shock proteins[J]. Nat Cell Biol, 2001, 3(1): 93-96.
[14]都镇先, 刘宝琴, 张海燕, 等. 蛋白酶体抑制剂诱导甲状腺癌细胞凋亡机制的初步研究[J]. 中华肿瘤防治杂志, 2010, 17(2): 85-88.
Induction of BAG2 in proteasome inhibitor-induced apoptosis in human thyroid carcinoma cells
WANG Yu-lin1,WANG Biao2, MENG Xin2,BA Ying3(1. Department of General Surgery, First Af fi liated Hospital of Dalian Medical University, Dalian Liaoning 116011, China; 2. Department of Biochemistry and Molecular Biology, China Medical University, Shenyang Liaoning 110001, China; 3. Department of Endocrinology, First Af fi liated Hospital of Dalian Medical University, Dalian Liaoning 116011, China)
Background and purpose:For neoplasms with different sources, proteasome inhibitors can inhibit their growth and promote the cell apoptosis. Its mechanism may be associated with Bcl-2-associated athanogene 2 (BAG2). We aimed to investigate the involvement of in thyroid cancer cell death induced by proteasome inhibitors.Methods:A panel of thyroid cancer cells (ARO, FRO, KTC1, KTC2, KTC3, 8305C and 8505C) were treated with vehicle or proteasome inhibitor MG132; BAG2 mRNA and protein levels were analyzed using quantitative real-time polymerase chain reaction (qRT-PCR) and Western blot, respectively.Results:MTT results indicated that FRO and KTC2 cell lines were the most sensitive to proteasome inhibitors. MG132 induced BAG2 mRNA and protein expression in the panel of thyroid cancer cells with various degree (P<0.01), for FRO and KTC2 cell line, the BAG2 mRNA level was increased in 20 to 25 times, meanwhile the protein expression level also increased signi fi cantly; Sensitive FRO cells demonstrated quicker induction of BAG2 compared with insensitive ARO cells. Moreover, the extents of BAG2 induction in FRO cells were higher than that in ARO cells.Conclusion:BAG2 is a novel molecule induced by proteasome inhibitor, which might function as a proapoptotic molecule in thyroid cancer cell death mediated by proteasome inhibitor.
Bcl-2-associated athanogene 2; Proteasome inhibitor; Apoptosis; Thyroid cancer
10.3969/j.issn.1007-3969.2014.05.005
R736.1
A
1007-3639(2014)05-0349-05
2014-01-10
2014-03-20)
巴颖 E-mail:baying12676@126.com

