尿酸对人肾小管上皮细胞HK-2纤维化相关调控因子的影响
陈继承,康 洁,高碧珍,廖凌虹,丁珊珊
尿酸对人肾小管上皮细胞HK-2纤维化相关调控因子的影响
陈继承,康 洁,高碧珍,廖凌虹,丁珊珊
目的观察不同浓度尿酸对人肾小管上皮细胞(HK-2)相关纤维化调控因子的影响,探讨建立尿酸诱导的人肾小管上皮细胞纤维化模型,为尿酸性肾纤维化疾病的研究提供细胞模型。方法以不同浓度的尿酸刺激 HK-2细胞6,12,24,36h,MTT检测细胞活性抑制率;Real-Time PCR检测TGF-β1、CTGF、α-SMA mRNA的表达,观察尿酸对HK-2细胞的促纤维化作用;26mg/dL浓度尿酸刺激HK-2细胞24h,免疫组织化学检测TGF-β1、CTGF、α-SMA蛋白的改变。结果尿酸刺激后细胞活性抑制率与对照组比较明显升高(P<0.05),呈时间依赖性;尿酸刺激后TGF-β1、CTGF、α-SMA的表达量与对照组比较明显增加(P<0.05),并呈剂量依赖性;尿酸刺激后TGF-β1、CTGF、α-SMA蛋白的表达量与对照组比较明显增加(P<0.05)。结论尿酸可抑制 HK-2细胞增殖;采用尿酸诱导HK-2细胞,可建立肾纤维化的细胞模型。
尿酸;上皮细胞;肾小管;纤维化;免疫组织化学;聚合酶链反应
随着生活水平提高,高尿酸血症的发病率逐年递增。当尿酸长期沉积于肾脏,可造成肾实质损害,最终导致肾纤维化。目前肾纤维化动物模型较多,而细胞模型较少,建立合适的肾纤维化细胞模型,对进一步研究高尿酸血症所致的肾纤维化的机制和防治,具有积极的意义。在高尿酸血症最终导致肾间质纤维化的过程中有多种纤维化因子,如转移生长因子 β1(transforming growth factor-β1,TGF-β1)、结缔组织生长因子(connective tissue growth factor,CTGF)、α平滑肌肌动蛋白(αsmooth activator protein,α-SMA)参与其中。本实验拟观察不同浓度尿酸对肾小管上皮细胞相关纤维化调控因子表达水平的影响,探讨建立肾纤维化的细胞模型。
1 材料与方法
1.1 材料
1.1.1 细胞及试剂 人肾小管上皮细胞(HK-2细胞,美国 ATCC 细胞库)。尿酸 (批号:STBC0525V,美国Sigma公司);MTT(批号:M2128,美国Sigma公司);胎牛血清(批号:911585,美国Gibco公司);Trizol RNA抽提试剂(批号:9108,日本TaKaRa公司);SYBR Green PCR Master mix(批号:RR420A,日本TaKaRa公司);逆转录试剂盒(批号:FSQ-201,日本 TOYOBO公司);TGF-β1、CTGF、α-SMA、β-肌动蛋白(β-actin)引物(上海生工生物 工 程 有 限 公 司);兔 抗 人 TGF-β1、CTGF、α-SMA抗体(批号:bs-0103R,北京博士德公司)。
1.1.2 仪器 CO2培养箱(150型,美国 Thermo公司);洁净工作台(SW-CJ-1FD型,苏州安泰空气技术有限公司);倒置荧光相差显微镜(Ti-S型,日本尼康公司);实时荧光定量PCR仪(epgradient型,德国Eppendorf公司);连续波长多功能酶标仪(Infinite M200F200型,奥地利TECAN公司)。
1.2 方法
1.2.1 HK-2细胞培养 细胞置于含10%胎牛血清、100U/mL 青霉素和 100μg/mL 链霉素的RPMI 1640培养基中培养,每2~3d换液1次,至细胞生长达80%汇合后进行传代。实验所用的细胞均为第3~5代细胞。取汇合达80%的细胞经胰酶消化制成细胞悬液,继续培养24h后,换无血清培养液培养24h,使细胞同步处于G0期。
取培养后同步处于G0期的HK-2细胞,按继续培养条件的不同分为4组:(1)对照组:仅使用RPMI 1640;(2)U1组:RPMI 1640+10mg/dL尿酸;(3)U2组:RPMI 1640+21mg/dL尿酸;(4)U3组:RPMI 1640+26mg/dL尿酸。每组均培养4瓶细胞。上述细胞在不同培养液中分别培养6,12,24,36h,到达相应时间后用胰酶消化,离心后抽提总RNA。每个时间段均重复6次。
1.2.2 MTT法检测细胞增殖 常规消化收集处于对数生长期的 HK-2细胞,按每孔104接种于96孔培养板,培养24h后,换成无血清培养液继续培养24h,使细胞同步于G0期,按上述分组情况各加入200μL培养基。另设空白对照孔:只加完全培养基(不加细胞,用于调零)。每种浓度设9个复孔。分别继续培养6,12,24,36h后,每孔去原培养液后加入100μL(0.5mg/mL)MTT,37℃孵育4h,弃除MTT,然后每孔加入150μL二甲基亚砜(DMSO),振荡约10min,溶解形成的结晶,在492nm波长处,用酶标仪检测OD值,空白对照孔调零。以上各组实验均重复3次,取平均值。

1.2.3 HK-2细胞总RNA抽提及cDNA制备 应用Trizol试剂抽提细胞总RNA,采用紫外分光光度计测定其浓度。按照逆转录试剂盒说明进行逆转录,制备cDNA。反应体系如下:2μg模板RNA,65℃热变性5min,立即置于冰上冷却,加入4μL的5×RT Master Mix,加入 Nuclease-free Water至终体积20μL。反应参数如下:37℃15min→52℃5min→98℃5min。-20℃保存备用。
1.2.4 Real-time PCR 扩 增 TGF-β1、CTGF、α-SMA、β-actin基因引物序列见表1。采用看家基因β-actin进行标化。取同一个cDNA为模板进行TGF-β1、CTGF、α-SMA、β-actin的 PCR 反应。反应体系如下:2μL cDNA,12.5μL 2×SYBR Green PCR Master mix试剂,0.5μL引物,加超纯水至终体积25μL。反应参数如下:95℃30s→95℃5s→60℃30s,40个循环,得出各反应的扩增曲线和Ct值。采用相对定量2-△△Ct法比较各基因的表达差异[1]。以对照组表达量为1,2-△△Ct值即为尿酸干预后较对照组基因表达的倍数。

表1 引物序列Tab 1 Primer sequences
1.2.5 细胞免疫组织化学 将清洁灭菌盖玻片置于6孔板中,每孔接种细胞悬液(105/mL)2mL,培养24h后,换成无血清培养液继续培养24h,然后将细胞分成对照组和含26mg/dL尿酸组,继续培养24h。取出细胞爬片,用PBS漂洗,2min×3次。4%多聚甲醛室温固定20min后进行细胞免疫化学检测。简要染色步骤如下:0.5%TritionX-100室温处理20min,PBS漂洗后,3%H2O2室温孵育10min
2 结 果
2.1 尿酸对HK-2细胞增殖的影响 不同浓度的尿酸(0,10,21,26mg/dL)刺激 HK-2细胞6,12,24,36h后,与对照组比较,尿酸刺激后细胞活性抑制率均有明显上升。其中在同一作用时间下,随着尿酸浓度增加,细胞活性抑制率呈剂量依赖性逐步增加;在同一浓度作用下,随着作用时间增加,中高浓度细胞活性抑制率呈时间依赖性逐步增加,低浓度先增高后降低。可见尿酸对HK-2细胞的作用呈剂量依赖性(图1)。灭活内源性过氧化酶活性,PBS漂洗,柠檬酸高温抗原修复,正常山羊血清孵育20min封闭非特异结合位点,兔抗人TGF-β1、CTGF、α-SMA抗体工作液4℃过夜,PBS漂洗后相继与二抗及SABC试剂各孵育20min,PBS漂洗,DAB显色和苏木素复染,乙醇梯度脱水后中性树胶封片。显微镜观察细胞形态并随机选取3个视野拍照,应用Image-Pro Plus软件测量区域内积分光密度平均值。

图1 尿酸对HK-2细胞增殖的影响Fig 1 The influence of uric acid in HK -2cell proliferation
2.2 尿酸对 HK-2细胞 TGF-β1、CTGF、α-SMA mRNA表达的影响
2.2.1 尿酸对 HK-2细胞 TGF-β1mRNA 表达的影响 不同浓度尿酸刺激6,12,24h后,各组HK-2细胞TGF-β1mRNA表达持续上调;36h后表达有所降低,但仍高于对照组。24h时中高浓度作用差别有统计学意义(vs其他组,P<0.05),其他时间段不同浓度之间作用差别无统计学意义(P>0.05,表2)。
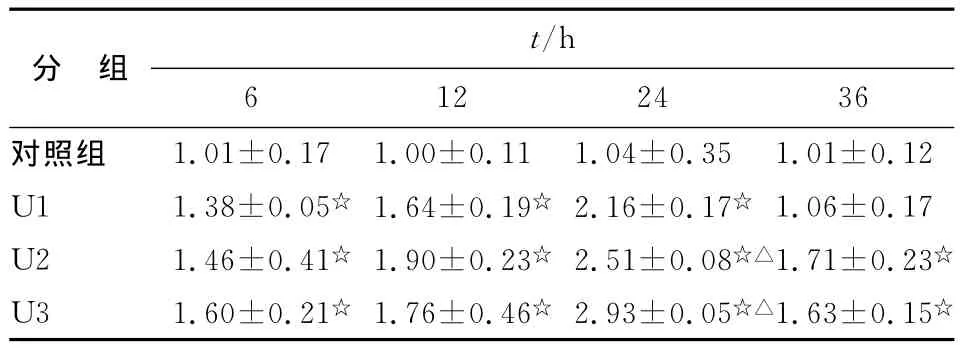
表2 尿酸对 HK-2细胞 TGF-β1mRNA 表达的影响(2-△△Ct)Tab 2 The effect of uric acid on HK-2cells expression of TGF-β1mRNA(2-△△Ct)
2.2.2 尿酸对HK-2细胞CTGF mRNA表达的影响 不同浓度尿酸培养不同时间后的各组HK-2细胞CTGF mRNA表达水平均高于对照组;随时间增加,CTGF mRNA表达先增高后降低;24h时高浓度作用差别有统计学意义(vs中低浓度,P<0.05),其他时间段不同浓度之间作用差别无统计学意义(P>0.05,表3)。

表3 尿酸对HK-2细胞CTGF mRNA表达的影响(2-△△Ct)Tab 3 The effect of uric acid on HK-2cells expression of CTGF mRNA(2-△△Ct)
2.2.3 尿酸对 HK-2细胞α-SMA mRNA 表达的影响 不同浓度尿酸刺激不同时间后的各组HK-2细胞α-SMA mRNA表达水平均高于正常组;随着时间增加,中低浓度(10,21mg/dL)α-SMA mRNA表达随时间增加而升高,而高浓度(26mg/dL)随时间增加而先升高后降低;24h时高浓度作用差别有统计学意义(vs中低浓度,P<0.05),其他时间段不同浓度之间作用差别无统计学意义(P>0.05,表4)。
2.3 26mg/dL 尿 酸 对 HK-2 细 胞 TGF-β1、CTGF、α-SMA蛋白表达的影响 TGF-β1、CTGF、α-SMA均表达于细胞胞质中。26mg/dL尿酸培养24h后 TGF-β1、CTGF、α-SMA 蛋白表达水平显著增高(vs对照组,P<0.01,表5,图2)。

表4 尿酸对 HK-2细胞α-SMA mRNA表达的影响(2-△△Ct)Tab 4 The effect of uric acid on HK-2cells expression of α-SMA mRNA(2-△△Ct)

表5 26mg/dL尿酸对 HK-2细胞 TGF-β1、CTGF、α-SMA蛋白表达的影响(IOD)Tab 5 The effect of uric acid on HK-2cells expression of TGF-β1,CTGF,α-SMA protein(IOD)

图2 各组 TGF-β1、CTGF、α-SMA 蛋白表达的比较( ×400)Fig 2 The comparison of TGF-β1,CTGF,α-SMA protein expression( ×400)
3 讨 论
肾间质纤维化是各类肾脏疾病进入终末期肾衰的共同途径,在肾脏疾病的预后转归中起着重要作用[2]。近年来,肾间质纤维化日益得到众多研究者的重视。肾纤维化主要与间质成纤维细胞的增生及细胞外基质的过度堆积有关。Strutz等于1995年首先证实肾小管上皮细胞能够转化为间质成纤维细胞,是肾间质纤维化发生机制之一[3-4]。许多细胞因子参与肾纤维化,其中TGF-β1是众多因子中最关键的促纤维化因子[5],参与肾小管上皮细胞转分化的各个环节。CTGF是TGF-β1引起的即刻早期基因表达的产物,是TGF-β1促纤维化活性的下游信号分子之一。研究表明,CTGF通过促进肾小管上皮细胞向肌成纤维细胞转化,参与肾纤维化的形成[6]。肌成纤维细胞是肾间质中合成细胞外基质的主要细胞,特异性的表达α-SMA。杨丽霞等研究证实,正常的HK-2细胞不表达α-SMA,而在向肌成纤维细胞转化的过程中高度表达α-SMA[7]。因此α-SMA表达的增多是肾小管上皮细胞向肌成纤维细胞转化的指示性标志物。
尿酸主要经肾脏排泄。当尿酸长期在肾小管间质内沉积,将导致肾小管上皮细胞损伤、激发炎症反应,最终发生肾小管间质纤维化、肾小球硬化等病变。一些离体实验研究证实,尿酸可促进人肾小管上皮细胞尿酸盐转运子、细胞间黏附分子-1、纤维化相关因子和基质成分的表达[8-10]。
目前肾纤维化细胞模型较少,主要采用TGF-β诱导建立。本研究采用4倍生理浓度尿酸依次进行0.8,0.4倍稀释,刺激体外培养的 HK-2细胞不同时间(6,12,24,36h),以模拟高尿酸环境。结果显示,尿酸能抑制HK-2细胞活性,通过上调纤维化相关因子(TGF-β1、CTGF、α-SMA)的表达,促进HK-2细胞向肌成纤维细胞转分化,导致肾间质纤维化。因此,笔者认为采用26mg/dL浓度的尿酸干预HK-2细胞24h,可以建立肾纤维化的细胞模型。该模型的建立,将对高尿酸血症导致的肾纤维化的产生机制和药物的防治研究提供实验平台。
[1]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[2]Eddy A A.Molecular basis of renal fibrosis[J].Pediatric nephrology,2000,15(3-4):290-301.
[3]Strutz F,Okada H,Lo CW,etal.Identification and characterization of a fibroblast marker:FSP1[J].JCellBiology,1995,130(2):393-406.
[4]Kalluri R,Neilson E G.Epithelial-mesenchymal transition and its implications for fibrosis[J].JClinicalInvestigation,2003,112(12):1776-1784.
[5]Wang Y,Zhang Z,Shen H,etal.TGF-β1/Smad7signaling stimulates renal tubulointerstitial fibrosis induced by AAI[J].JReceptorsandSignalTransduction,2008,28(4):413-428.
[6]陈继贵,邰智慧,刘 坤,等.肾间质纤维化中结缔组织生长因子(CTGF)与肾小管上皮细胞表型转化的关系[J].中国实验诊断学,2010,14(1):69-71.
[7]杨丽霞,李 彧,王 谦,等.姜黄素对TGF-β1诱导人肾小管上皮细胞转分化及分泌细胞外基质成分的影响[J].中国中西医结合肾病杂志,2008,9(12):1040-1043.
[8]付正菊,王 霞,李长贵,等.尿酸对肾小管上皮细胞人尿酸盐转运子基因表达的影响[J].中国免疫学杂志,2009,25(6):560.
[9]郭吉雷,李 晶,陈 明.尿酸对肾小管上皮细胞sICAM-1表达的影响及其机制探讨[J].山东医药,2013,53(9):26-28.
[10]姚 灿.尿酸,尿素对HK-2细胞凋亡,纤维化相关因子表达的影响及前列地尔的干预研究[D].长沙:中南大学,2011.
(编辑:张慧茹)
Effect of Uric Acid on Expression of Fibrosis-related Regulatory Factors in HK-2 Cells
CHEN Jicheng,KANG Jie,GAO Bizhen,LIAO Linghong,DING Shanshan
Fujian University of TCM,College of Integrated Traditional Chinese and Western Medicine,Fuzhou 350122,China
ObjectiveTo observe the effect of different concentrations of uric acid(UA)on expression of fibrosis-related regulatory factors in human renal tubular epithelial cells(HK-2),and to establish UA-induced fibrosis model in HK-2cells for study of renal fibrosis diseases.MethodsHK-2cells were exposed to increasing concentrations of UA for 6h,12h,24h,36h,respectively,and the cell viability was determined by MTT assay. Real-Time PCR were employed to investigate the mRNA expression of TGF-β1,CTGF,andα-SMA. The protein levels of TGF-β1,CTGF,andα-SMA were evaluated by immunohistochemistry on HK-2cells exposed to UA for 24h.. ResultsMTT assay showed that UA could induce marked decrease of cell viability in a time-dependent manner as compared with the untreated control cells(P<0.05). The mRNA levels of TGF-β1,CTGF andα-SMA were increased time-dependently when HK-2cells were treated with with UA(P<0.05). The protein levels of TGF-β1,CTGF and α-SMA were increased significantly in HK-2cells treated with 26mg/dL UA for 24h(P<0.05).ConclusionUA could inhibit HK-2cell proliferation and the cells model of renal fibrosis could be established by UA induction.
uric acid;epithelial cells;kidney tubules;fibrosis;immunohistochemistry;polymerase chain reaction
R322.61;R329.24;R341.32;R392.11;R446.1;R589.7
A
1672-4194(2014)01-0025-04
2013-10-27
福建省自然科学基金(2011J01208),福建省教育厅A类科技重点项目(JA11129)
福建中医药大学 中西医结合学院,福州 350122
陈继承(1988-),男,福建中医药大学2012级硕士研究生
高碧珍.Email:gbz688@163.com

