免疫层析试纸技术及其在食品安全检测中的应用
李建武,宋春美,刘 芳,吴淑燕,李浩林,刘 程,邱 实,曾海娟,吴 嫚,刘 箐,*
免疫层析试纸技术及其在食品安全检测中的应用
李建武1,宋春美1,刘 芳2,吴淑燕1,李浩林3,刘 程3,邱 实1,曾海娟1,吴 嫚1,刘 箐1,*
(1.上海理工大学医疗器械与食品学院,上海 200093;2.甘肃出入境检验检疫局国际旅行卫生保健中心,甘肃 兰州 700030;3.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
免疫层析试纸因其使用方便,耗时少,结果稳定,价格相对低廉,可适用现场和家庭检测,在临床诊断等领域得到了有效普及。近年来,随着食品安全事故频发,该技术在食品安全检测中得到快速广泛的应用。本文从免疫层析试纸技术的简介、研究、应用进展等方面进行综述,并对其发展前景 进行评述,以期 为免疫层析 试纸技 术的未来发展及应用提供参考。
免疫层析试纸;食品安全;检测;应用
1 免疫层析试纸技术简介
免疫层析技术是2 0世纪80年代初在发达国家先兴起的一种快速检测技术,其原理是在毛细管层析作用下,抗原和抗体在硝酸纤维素膜上特异性结合。而免疫层析试纸条就是在免疫层析技术基础上,用胶体金、磁性纳米材料、乳胶微球、稀土纳米材料、量子点、荧光素等材料标记,肉眼或者在紫外或红外光的激发条件下,能够 呈现出抗体和抗原特异性结合的颜色或者荧光区域。免疫层析试纸条在不断的创新和发展,不仅出现了各式各样的标记材料,也研发了多种光电联合检测仪器;从之前检测结果只能靠肉眼判定的半定量检测到现在的仪器直接定量读取,不仅提高了检测灵敏度,也减少了对弱阳性检测结果的重新判定。
近来食品安全事件时有发生,如2013年新西兰奶粉事件,在奶粉中发现肉毒杆菌、双氰胺、三聚氰胺;2013年台湾的毒淀粉事件,淀粉中含有顺丁烯二酸,1 名体质量60 kg的成年人1 年吃下20 片含有毒淀粉的鸡排,就可能不孕或影响肾脏功能;2011年河南的瘦肉精事件,采用违禁动物药品“瘦肉精”饲养生猪,而且有毒猪肉流入济源双汇食品有限公司。这些食品的安全事件已经严重危害到了人体健康,要保证食品质量与安全,必须放弃先前操作繁琐、耗时长、成本高的物理、化学等检测方法,利用生物学特异性识别方法,快速、精确、灵敏、较高选择性的检测出食品中的食源性致病菌、农兽药残留、违禁添加剂、生物毒素、重金属离子等对人体有害的物质。现代食品安全检测的生物技术有DNA探针、聚合酶链式反应(polymerase chain reaction,PCR)、生物芯片、免疫层析试纸及酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)等技术,免疫层析试纸技术相对其他生物检测技术而言,具有能快速检测、灵敏、成本相对低廉、结果稳定、操作方便,可进行现场检测的优点。本文主要从免疫标记材料、试纸条式样多元化、学科交叉等方面,阐述了免疫层析试纸技术在食品安全检测中的研究、应用新进展。
免疫层析试纸主要由样品垫、结合垫、硝酸纤维素(nitrocellulose,NC)膜、T线(检测线)、C线(质控线)、吸水垫、聚氯乙烯(polyvinl chloride,PVC)底板等部分组成,如图1所示。以胶体金免疫层析试纸条原理为例,根据抗体和抗原结合方式不同原理分为双抗夹心法和竞争法。双抗夹心法检测原理是当样品点到样品垫上,利用毛细管层析作用,样品中的抗原先会经过胶体金标记过的抗体的结合垫,与金标抗体特异性结合,继续层析,当遇到T线时,抗原会再次被T线上的抗体捕捉,过量的金标抗体会继续层析,被C线上抗体捕捉,所以当T线变红,C线也变红,说明是阳性;当T线不变,C线也变红,说明是阴性;当C线不变,说明试纸条失效,竞争法显色结果与之相反。
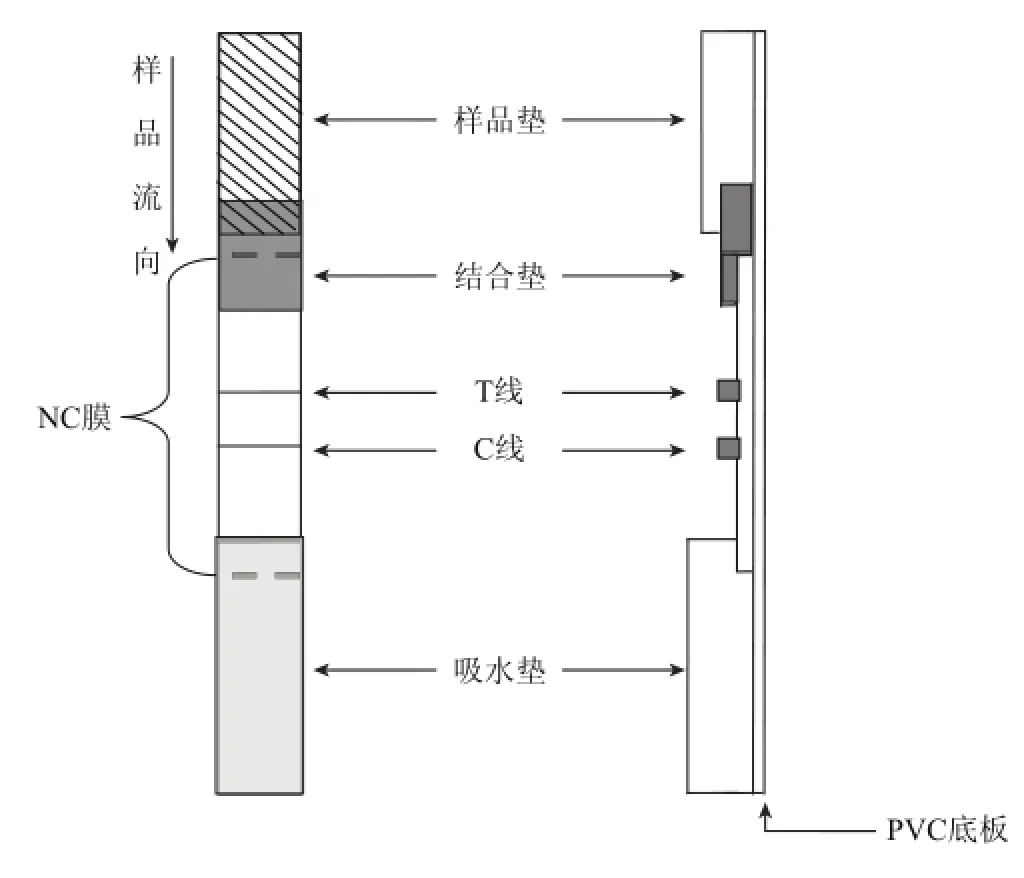
图1 免疫层析试纸条结构示意图Fig.1 Structural diagram of immunochromatographic strip
2 免疫层析试纸技术研究进展
2.1 免疫标记材料
在食品安全检测方面,如各种食源性致病菌的筛选检测,利用免疫层析试纸的快速、简便、灵敏的优点,在一些基层单位中得到广泛的应用。由免疫层析试纸示意图可知,关键技术在于标记抗体的免疫标记材料,免疫层析试纸技术随着科学技术的发展,不断的创新,出现了各式各样的标记材料,每种标记材料都有各自的优缺点,它们不会改变标记抗体的生物特性,并都能显示一定的颜色,便于观察和仪器读取。下面主要介绍胶体金、磁性纳米颗粒、乳胶微球、稀土纳米材料、量子点、荧光素。
2.1.1 胶体金
胶体金是由氯金酸(HAuCl4)在还原剂作用下,可聚合成一定大小的金颗粒,并由于静电作用成为一种稳定的胶体状态,形成带负电的疏水胶溶液,由于静电作用而成为稳定的胶体状态。胶体金在弱碱环境下带负电荷,可与蛋白质分子的正电荷基团形成牢固的结合,由于这种结合是静电结合,所以不影响蛋白质的生物特性。
用胶体金作为免疫标记材料,在免疫层析试纸技术方面是比较成熟的一项标记技术,Anfossi等[1]通过优化胶体金免疫层析技术,虽不精确但能够短时超灵敏检测牛奶中的黄曲霉M1;近来,有一些新型胶体免疫层析金技术出现,把胶体金做出柱形、三角形等其他形状,突破了传统的球形胶体金,Zhu Yingyue等[2]把胶体金颗粒做成柱形,检测抗生素(庆大霉素),能够简单、快速、灵敏地检测到0.05 ng/mL。
2.1.2 磁性纳米材料
磁性纳米颗粒是大小处在纳米级的磁性材料(代表Fe3O4),具有良好的磁导向性、生物相容性,容易制备,理化性质稳定,能与多种生物分子(酶、蛋白质等)耦合,当它与单克隆抗体耦合时,利用能与抗原的特异性结合这一特性,形成免疫磁珠。现在利用免疫磁珠技术做成免疫层析试纸在临床检验中应用比较广泛,孙建斌等[3]建立了HCG纳米磁性免疫层析试纸条,用于早孕检测,检测到底线为1 mIU/mL的HCG抗原,检测灵敏度高,并且在5 min内检测完毕。Liu Chunyan等[4]应用纳米磁性颗粒标记的免疫层析法,研制可快速半定量检测对氧磷农药残留免疫层析试纸条,最低限度检测为1.7 ng/mL。
2.1.3 乳胶微球
乳胶微球可分为彩色乳胶微球和荧光乳胶微球,彩色乳胶微球具有分散性好、粒径分布窄、色彩鲜艳等特性,在免疫层析试纸技术中得到了有效的应用,蒋韬等[5]建立口蹄疫O、Asia1分型彩色胶乳试纸条诊断方法,此免疫层析试纸条有很好的灵敏度,可检测到病毒含量为3.9×104LD50,特异性好,无交叉反应。荧光乳胶微球需要紫外激发,崔浩等[6]基于免疫竞争层析法原理,建立了莱克多巴胺的荧光胶乳颗粒免疫层析快速检测技术,用于猪肉组织中莱克多巴胺残留的检测,最低检测限为0.5 μg/mL,与其他结构类似物无交叉操作简便、稳定可靠、灵敏度高。
2.1.4 稀土纳米材料
稀土纳米材料根据斯托克斯位移方向不同,分为上转换发光材料和下转换发光材料。上转换发光材料即反斯托克斯发光材料,由于稀土金属元素(主要是镧系)掺杂于惰性氧化物材料,红外线激发下可发射不同波长的可见光,且吸收长波长光而发射短波长光,对生物组织(抗体)无损伤,无背景荧光并具有良好的光稳定性,因此在生物技术方面备受关注。雷皖秋[7]研究了上转换发光免疫层析法定量测定HBsAg的试纸条,在无偿献血者献血前血液筛检中的应用,检测血液中HBsAg灵敏度为0.5 IU/mL,敏感性为76.92%,特异性为100.00%,符合性85.00%。
下转换发光材料即斯托克斯发光材料,是自然界常见的发光现象,由高能量的光如紫外线激发产生低能量的光如可见光,中间存在能量损失。陈明山等[8]建立一种检测尿液中甲基苯丙胺物质的高灵敏度检测方法,研制出甲基苯丙胺稀土荧光试纸条,用所制备的试纸条检测尿液中的甲基苯丙胺,经紫外光激发下,肉眼和仪器判读的敏性均为100 ng/mL,与吗啡、氯胺酮、苯丙酮、可卡因等无交叉反应。
2.1.5 量子点
量子点,是一种由Ⅱ~Ⅵ族或Ⅲ~Ⅴ族元素组成、能够被激发照射产生荧光的半导体纳米颗粒,其中研究较多的主要是CdX(X=S、Se、Te)。由于量子点显著的尺寸效应和表面效应,致使它具有独特的光吸收特性,主要体现在量子点的尺寸大小可以控制发射光谱,不同尺寸的量子点被同一波长的光激发会发射出不同颜色的光。与一般荧光染料相比,量子点的激发波长很宽,被激发后能够产生窄而对称的发射光谱,其激发光谱宽而不对称,从而避免了去寻找合适波长的光源。
近年来,由于量子点荧光强度好,稳定性好,可以接受多次激发,荧光寿命长,具有较好的生物相容性,而且标记生物大分子后不影响原有的特性,这诸多优势已经引起了许多科学研究者的关注,发光量子点作为荧光标记探针生物大分子在临床检验、食品安全检测中具有巨大的潜力和应用价值。郭利宁等[9]建立的CdTe量子点免疫荧光层析试纸条检测抗CCP抗体(抗环瓜氨酸多肽)的灵敏度为97.5%,特异性为95.8%,该方法操作简单、快速,可实现床旁检测,能应用于类风湿关节炎的早期诊断。
2.1.6 荧光素
荧光素是具有荧光特性的染料,种类主要有:异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、四乙基罗丹明、四甲基异硫氰酸罗丹明、酶作用后产生荧光的物质、镧系6 类。一般荧光素价格低廉,表面不需要修饰可以直接偶联生物特性抗体,但用荧光素作为免疫标记材料在免疫层析试纸技术中应用很少,国内外也有些相关报道,宋春美等[10]用FITC标记莱克多巴胺单克隆抗体,快速检测莱克多巴胺的残留,检测试纸的最低检出限为1 μg/L,与其他动物剂类药物无交叉反应具有良好的特异性和灵敏度。
2.2 检测模式
免疫层析试纸技术根据检测需求不同,而检测模式也各色各样,可分为单检和多检。
2.2.1 单检试纸
单检是每根试纸条上面只有一条T线(检测线),一条C线(质控线)。现在的很多免疫层析试纸条都是单检,因为单检的检测结果非常准确,可靠性高,灵敏度高,假阳性少,现象比较明显,但如果大批量检测时单检与多检相比就会显得过程很复杂,浪费抗体和NC膜等材料。
2.2.2 多检试纸
多检是每根试纸条上面有两条或两条以上的T线(检测线),一条C线(质控线)。一条试纸条可以检测多种物质,提高了检测效率,节约了检测材料,但降低了检测灵敏度,当一些有害物质在稍微低些的浓度就无法检测。Guo Yirong等[11]研制出胶体金试纸条的双检,同时快速检测水样中杀虫剂卡巴呋喃和农药三唑磷,最低检测限分别是32 μg/L和4 μg/L。
2.3 试纸外型
现在免疫层析试纸条外型的不断创新,出现了各种各样的试纸条,而不同组装试纸条方式也很多,有双层析通道复合试纸条、十层析通道复合试纸条,可以同时检测出样品中含有两种或两种以上的物质。
2.3.1 双向层析试纸
为了方便加样,梁新苗等[12]设计了双向层析试纸,如图2所示,进一步节约了材料,并实现常见葫芦科病毒的检测,与传统的检测方法程序相比,操作简单,检测时间减少,检测结果特异性和灵敏度都很好。这样降低检测成本,提高了经济效益。
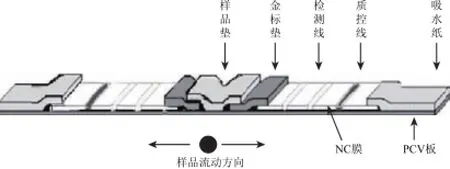
图2 双向层析试纸Fig.2 Dual channel complex chromatographic test strip
2.3.2 十通道免疫层析试纸
十通道免疫层析试纸是把十根试纸条放到一个具有10 个试纸槽的试纸盘上。在中间加样区设置了一个试纸槽的引流片,保证统一加样时,可以保证样品均匀流入各个试纸槽,从而能够同时均匀层析。Hong Wenyan等[13]设计了十通道免疫层析试纸,如图3所示,从操作方面考虑,方便了检测操作;从检测效果方面考虑,它与单通道免疫层析试纸的检测灵敏度和特异性一致,而且每个通道发生特异性的免疫反应不影响其他通道的特异性。

图3 十通道免疫层析试纸Fig.3 Ten channel complex chromatographic test strip
2.4 检测手段
用生物技术作为检测技术,在临床检验和食品安全检测方面应用比较广泛,检测手段不断创新,利用交叉学科的仪器应用,通过与光电传感器或者STM32单片机和TCS3200颜色识别器等其他仪器联用,能够从原来的定性检测到现在的定量检测。Zhang Hongcai等[14]把胶体金免疫层析试纸条与光电传感器联用,此光电型传感器检测器具有简便、快速、灵敏、特异性强的优点,能够进行定量检测,检测范围变大。程华等[15]研制了一种以STM320单片机为运算、控制核心,以颜色识别传感器TCS3200进行数据采集的检测仪,能够对多种胶体金免疫层析试纸条进行定量分析,实现了试纸条的智能检测。
3 免疫层析试纸技术应用进展
免疫层析试纸技术起先应用在临床医学诊断,主要检测疾病,如利用胶体金免疫层析法可以检测出乙型肝炎病毒表面抗原、口蹄疫病毒、禽流感病毒、传染性法氏囊病毒VP4蛋白,检测人绒毛膜促性腺激素(血清HCG)等。在食品安全检测中,发现使用免疫层析试纸技术可以迅速、精确的判断出食品中存在潜在的危害,而且这种方法简单、方便、成本低,避免使用高效液相色谱等高端昂贵仪器,起到经济环保的作用。
3.1 检测食品中食源性致病菌
由食源性致病菌引发的食品安全事件很大程度是食物被污染,产生一些致病菌导致人体食物中毒。要避免此类食品安全事件发生,就要对食品安全进行检测,而免疫层析试纸技术既迅速又廉价,必然成为未来食品安全检测技术的主流。免疫层析试纸技术能在很少的时间内准确无误检出食源性致病菌,研制出检测各种各样食源性致病菌的免疫层析试纸条,归纳如表1所示。
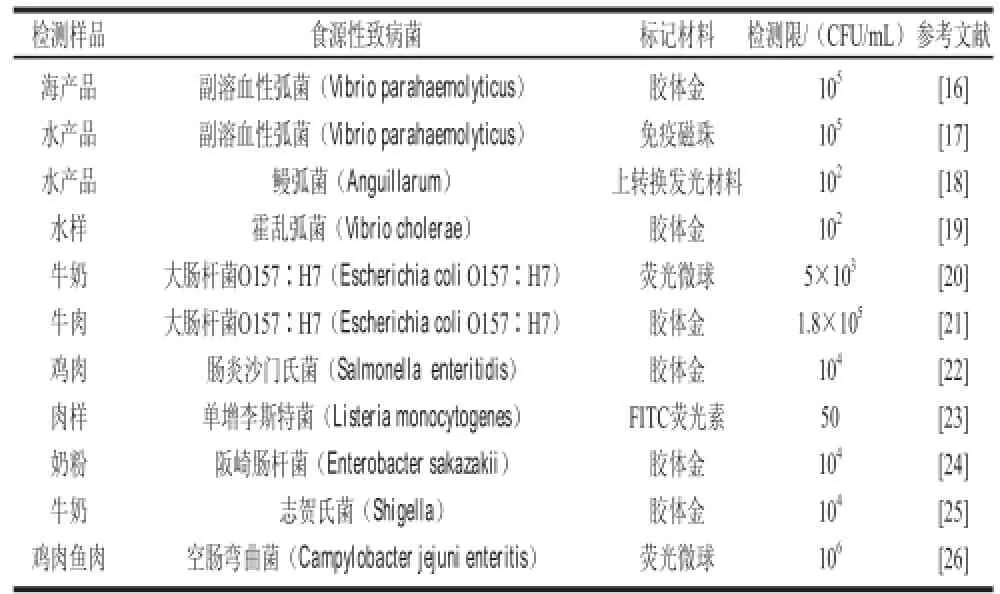
表1 免疫层析试纸条在食品中食源性致病菌检测方面的应用Table 1 Applications of immunochromatographic test strip in detection of foodborne pathogens
3.2 检测食品中农兽药残留
食品中农兽药残留一直是人类非常关心的食品安全问题之一,现在安全检测成为控制含有农兽药的食品流入市场的一个关键环节。必须严格把关,杜绝含有这类食品进到餐桌。用免疫层析试纸条方法检测农兽药残留已经相当普及,归纳如表2所示。
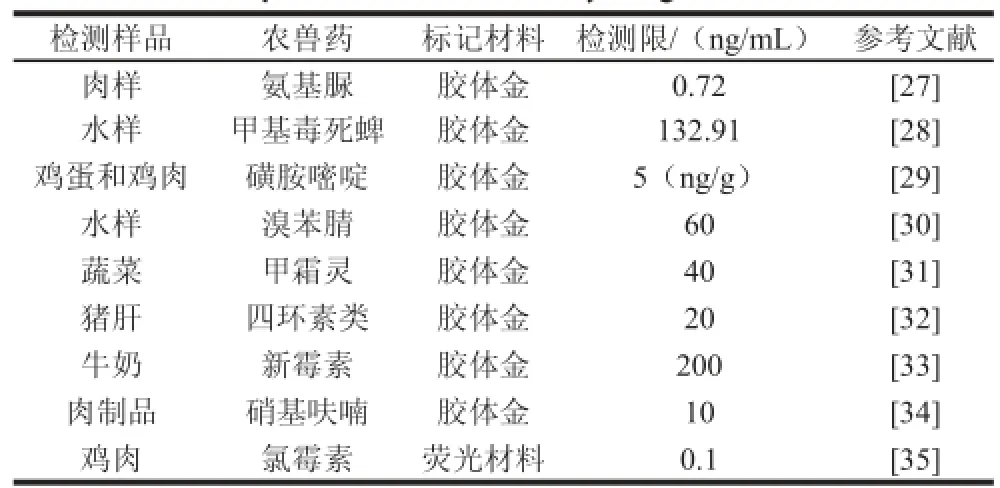
表2 免疫层析试纸条在食品中农兽药残留检测方面的应用Table 2 Applications of immunochromatographic test strip in detection of pesticide and veterinary drug residues in foods
3.3 检测食品中违禁添加剂
现在某些商家为了自身利益最大化,不断的使用违禁添加剂,如养猪的商人给猪喂瘦肉精,养鱼的使用孔雀石绿,还有一些在奶粉中添加三聚氰胺等。这就要对监管部门严格检查,而且对于以前的传统方法(高效液相色谱法)检测仪器要求高、耗时长、成本高。当前,用免疫层析试纸快速检测节约了成本和节省时间,降低了操作要求,检测效果也相当好。在检测违禁添加剂的应用中归纳如表3所示。

表3 免疫层析试纸条在食品中违禁添加剂检测方面的应用Table 3 Applications of immunochromatographic test strip in detection of prohibited additives in foods
3.4 检测食品中生物毒素
食品原料有时由于不正确的处理和贮藏,会产生一些天然毒素。有时误食会引起人类中毒甚至导致死亡。用免疫层析试纸检测生物毒素,在食品安全检测中已经被投入使用了,归纳如表4所示。

表4 免疫层析试纸条在食品中生物毒素检测方面的应用Table 4 Applications of immunochromatographic test strip in detection of biotoxins in foods
3.5 检测食品中重金属离子
对于食品中的重金属离子检测传统方法是化学滴定、原子荧光、原子吸收、原子发射、石墨炉、ICP-MS等这些都可以测定,而现在利用生物免疫层析试纸技术进行快速检测已不罕见了,归纳如表5所示。

表5 免疫层析试纸条在食品中金属离子检测方面的应用Table 5 Applications of immunochromatographic test strip in detection of metal ions in foods
4 展 望
免疫层析试纸目前存在的主要问题是定量问题,纵观免疫层析试纸在食品安全中的应用,试纸只能进行半定量的检测,相对于定性检测有了很大的突破。但是这并不能体现出成熟的免疫层析试纸技术水平,定量检测是免疫层析试纸技术的最终目标。对于灵敏度,利用新型标记材料,如量子点、稀土发光材料、上转换发光材料、荧光素等已经使得免疫层析试纸的灵敏度有了一定的提高,一些已经突破了ELISA和胶体金试纸的灵敏度;除此之外,利用免疫层析试纸检测时,配合新型生物传感器的使用,会达到放大检测信号的作用,从而提高灵敏度,同时实现检测手段的多样化。
免疫层析试纸作为快速检测领军先锋发展迅猛,依然面临着一些限制其发展的问题,如灵敏度不及仪器分析法、多元检测少、定量分析能力弱等。现今国内外免疫层析试纸条技术较成熟应用最广泛的是胶体金免疫层析试纸条,随着生物技术、纳米技术、光电技术的发展及各学科的交叉融合,会有越来越多的新型标记材料、新型抗体、新型检测模式以及新型便携化、微型化、自动化的定量检测仪器出现,用于改善现有免疫层析试纸的各项性能,使免疫层析试纸在食品安全检测领域中发挥着不可替代的作用,为食品安全事业做出更大的贡献。
[1] ANFOSSI L, BAGGIANI C, GIOVANNOLI C, et al. Optimization of a lateral flow immunoassay for the ultrasensitive detection of aflatoxin M1in milk[J]. Analytica Chimica Acta, 2013, 772: 75-80.
[2] ZHU Yingyue, QU Changlong, KUANG Hua, et al. Simple, rapid and sensitive detection of antibiotics based on the side-by-side assembly of gold nanorod probes[J]. Biosensors and Bioelectronics, 2011, 26(11): 4387-4392.
[3] 孙建斌, 雷小英, 包晗, 等. 纳米磁性颗粒标记的免疫层析法定量检测人绒毛膜促性腺激素[J]. 现代生物医学进展, 2011, 24(11): 5001-5004.
[4] LIU Chunyan, JIA Qiaojuan, YANG Chunhui,et al. Lateral flow immunochromatographic assay for sensitive pesticide detection by using Fe3O4nanoparticle aggregates as color reagents[J]. Analytical Chemistry, 2011, 83(17): 6778-6784.
[5] 蒋韬, 任维维, 梁仲, 等. 口蹄疫O, Asia1分型彩色胶乳试纸条诊断方法的建立[J]. 畜牧兽医学报, 2011, 42(6): 815-822.
[6] 崔浩, 陈耀强, 唐勇, 等. 莱克多巴胺荧光胶乳颗粒免疫层析检测法的建立[J]. 分析测试学报, 2011, 30(7): 764-768.
[7] 雷皖秋. 上转发光免疫层析法定量测定HBsAg试剂条在血液筛检中的应用[J]. 临床输血与检验, 2012, 14(2): 124-128.
[8] 陈明山, 吉琼梅, 赵芳, 等. 甲基苯丙胺稀土荧光试纸条的研制[J].中国法医学杂志, 2013, 28(4): 272-274.
[9] 郭利宁, 何红秋. 一种基于量子点检测抗CCP抗体的免疫荧光层析法[J]. 中国生物化学与分子生物学报, 2013, 29(4): 389-395.
[10] 宋春美, 职爱民, 张静, 等. 莱克多巴胺荧光试纸的初步研制及性能测定[J]. 西北农业学报, 2013, 22(6): 22-26.
[11] GUO Yirong, LIU Shaoying, GUI Wenjun,et al.Gold immunochromatographic assay for simultaneous detection of carbofuran and triazophos in water samples[J]. Analytical Biochemistry, 2009, 389(1): 32-39.
[12] 梁新苗, 边勇, 李建光, 等. 4 种葫芦科植物病毒复合胶体金免疫层析试纸条的研制[J]. 植物检疫, 2013, 27(1): 39-42.
[13] HONG Wenyan, HUANG Lihua, WANG Haoran, et al. Development of an up-converting phosphor technology-based 10-channel lateral flow assay for profiling antibodies against Yersinia pestis[J]. Journal of Microbiological Methods, 2010, 83(2): 133-140.
[14] ZHANG Hongcai, LIU Chunyan, LIU Guoyan, et al. A portable photoelectric sensor based on colloidal gold immunochromatographic strips for rapid determination of clenbuterol in pig urine[J]. Chinese Journal of Analytical Chemistry, 2012, 40(6): 852-856.
[15] 程华, 王树志, 陈晨, 等. 新型胶体金免疫层析试纸条定量分析仪的研制[J]. 分析仪器, 2013, 1(1): 7-11.
[16] GUO Ailing, SHENG Hongli, ZHANG Min, et al. Development and evaluation of a colloidal gold immunochromatography strip for rapid detection of Vibrio parahaemolyticus in food[J]. Journal of Food Quality, 2012, 35(5): 366-371.
[17] YAN Jun, LIU Yingying, WANG Yilong, et al. Effect of physiochemical property of Fe3O4particle on magnetic lateral flow immunochromatographic assay[J]. Sensors and Actuators B: Chemical, 2014, 197(1): 129-136.
[18] ZHAO Peng, WU Yuanyuan, ZHU Yihua, et al. Upconversion fluorescent strip sensor for rapid determination of Vibr io anguillarum[J]. Nanoscale, 2014, 6(7): 3804-3809.
[19] YU C Y, ANG G Y, CHUA A L, et al. Dry-reagent gold nanoparticlebased lateral flow biosensor for the simultaneous detection of Vibrio cholerae serogroups O1 and O139[J]. Journal of Microbiological Methods, 2011, 86(3): 277-282.
[20] WANG Lijun, LI Ping, YANG Youjun, et al. Development of an immunomagnetic separation-propidium monoazide-polymerase chain reaction assay with internal amplification control for rapid and sensitive detection of viable Escherichia coli O157: H7 in milk[J]. International Dairy Journal, 2014, 34(2): 280-286.
[21] JUNG B, JUNG S, KWEON C. Development of a rapid immunochromatographic strip for detection of Escherichia coli O157[J]. Journal of Food Protection, 2005, 68(10): 2140-2143.
[22] MOONGKARNDI P, RODPAI E, KANARAT S. Evaluation of an immunochromatographic assay for rapid detection of Salmonella enterica serovars Typhimurium and Enteritidis[J]. Journal of Veterinary Diagnostic Investigation, 2011, 23(4): 797-801.
[23] WANG Zhouping, MIU Tingting, XU Huan, et al. Sensitive immunoassay of Listeria monocytogenes with highly fluorescent bioconjugated silica nanoparticles probe[J]. Journal of Microbiological Methods, 2010, 83(2): 179-184.
[24] 周鹤峰, 邵敏, 李长福, 等. 阪崎肠杆菌胶体金试纸条的制备及初步应用[J]. 生物技术通报, 2013, 29(2): 172-176.
[25] XU F, WU X L, XU D, et al. Development of colloidal gold based immunochromatographic strip test for detection of Shigella spp. in milk[J]. China Dairy Industry, 2012, 40(5): 46-50.
[26] XU Di, WU Xiaoli, LI Bo, et al. Rapid detection of Campylobacter jejuni using fluorescent microspheres as label for immunochromatographic strip test[J]. Food Science and Biotechnology, 2013, 22(2): 585-591.
[27] TANG Yong, XU Jinting, WANG Wuzhou, et al. A sensitive immunochromatographic assay using colloidal gold-antibody probe for the rapid detection of semicarbazide in meat specimens[J]. European Food Research and Technology, 2011, 232(1): 9-16.
[28] HUA Xiude, QIAN Guoliang, YANG Jifei, et al. Development of an immunochromatographic assay for the rapid detection of chlorpyrifosmethyl in water samples[J]. Biosensors and Bioelectronics, 2010, 26(1): 189-194.
[29] WANG Xiliang, LI Kui, SHI Deshi, et al. Development and validation of an immunochromatographic assay for rapid detection of sulfadiazine in eggs and chickens[J]. Journal of Chromatography B, 2007, 847(2): 289-295.
[30] ZHU Jiang, CHEN Wenchao, LU Yitong, et al. Development of an immunochromatographic assay for the rapid detection of bromoxynil in water[J]. Environmental Pollution, 2008, 156(1): 136-142.
[31] 赵友全, 杨成文, 陈峰, 等. 一种新型便携式甲霜灵胶体金试纸条显色分析仪的研制[J]. 仪器仪表学报, 2009, 30(10): 2175-2180.
[32] LE Tao, YU Huan, WANG Xiliang, et al. Development and validation of an immunochromatographic test strip for rapid detection of doxycycline residues in swine muscle and liver[J]. Food and Agricultural Immunology, 2011, 22(3): 235-246.
[33] 刘淑华, 何方洋, 冯才伟, 等. 牛奶中新霉素残留胶体金免疫层析快速检测技术的研制[J]. 食品工业科技, 2013, 34(6): 73-76.
[34] L I S h u q u n, S O N G J u a n, YA N G H o n g, e t a l. A n immunochromatographic assay for rapid and direct detection of 3-amino-5-morpholino-2-oxazolidone (AMOZ) in meat and feed samples[J]. Journal of the Science of Food and Agriculture, 2013, 94(4): 760-767.
[35] BAI Zhizhong, LUO Yunbo, XU Wentao, et al. Development of a new fluorescence immunochromatography strip for detection of chloramphenicol residues in chicken muscles[J]. Journal of the Science of Food and Agriculture, 2013, 93(15): 3743-3747.
[36] YAN Panpan, TANG Qinghui, DENG Anping, et al. Ultrasensitive detection of clenbuterol by quantum dots based electrochemiluminescent immunosensor using gold nanoparticles as substrate and electron transport accelerator[J]. Sensors and Actuators B: Chemical, 2014, 191(1): 508-515.
[37] SONG Chunmei, ZHI Aimin, LIU Qingtang, et al. Rapid and sensitive detection of β-agonists using a portable fluorescence biosensor based on fluorescent nanosilica and a lateral flow test strip[J]. Biosensors and Bioelectronics, 2013, 50: 62-65.
[38] XIAO Zhili, YU Jianhua, LEI Hongtao, et al. Development of a colloidal gold labeled strip for the rapid detection of clenbuterol[J]. Modern Food Science and Technology, 2013, 8: 48.
[39] LE Tao, YAN Peifeng, XU Jian, et al. A novel colloidal goldbased lateral flow immunoassay for rapid simultaneous detection of cyromazine and melamine in foods of animal origin[J]. Food Chemistry, 2013, 138(2): 1610-1615.
[40] 山珊, 彭涛, 杨万春, 等. 胶体金免疫层析法定量检测孔雀石绿[J].食品科学, 2013, 34(16): 160-163.
[41] WANG Jia, WANG Zhuanhui, LIU Jing, et al. Nanocolloidal goldbased immuno-dip strip assay for rapid detection of Sudan red Ⅰ in food samples[J]. Food Chemistry, 2013, 136(3): 1478-1483.
[42] LIU B H, HSU Y T, LU Chuanchen, et al. Detecting aflatoxin B1in foods and feeds by using sensitive rapid enzyme-linked immunosorbent assay and gold nanoparticle immunochromatographic strip[J]. Food Control, 2013, 30(1): 184-189.
[43] WANG J H, LIU B H, HSU Y T, et al. Sensitive competitive direct enzyme-linked immunosorbent assay and gold nanoparticle immunochromatographic strip for detecting aflatoxin M1in milk[J]. Food Control, 2011, 22(6): 964-969.
[44] ANFOSSI L, GIOVANNOLI C, GIRAUDI G, et al. A lateral flow immunoassay for the rapid detection of ochratoxin A in wine and grape must[J]. Journal of Agricultural and Food Chemistry, 2012, 60(46): 11491-11497.
[45] WANG Yuankai, YAN Yaxian, JI Wenhui, et al. Rapid simultaneous quantification of zearalenone and fumonisin B1in corn and wheat by lateral flow dual immunoassay[J]. Journal of Agricultural and Food Chemistry, 2013, 61(21): 5031-5036.
[46] XING Changrui, FENG Min, HAO Changlong, et al. Visual sensor for the detection of trace Cu (Ⅱ) ions using an immunochromatographic strip[J]. Immunological Investigations, 2013, 42(3): 221-234.
[47] ZHOU Yu, LI Yangsong, MENG Xingyu, et al. Production of a monoclonal antibody and development of an immunoassay for detection of Cr (Ⅲ) in water samples[J]. Chemosphere, 2013, 93(10): 2467-2472.
[48] ZHOU Yu, LI Yansong, MENG Xingyu, et al. Development of an immunochromatographic strip and its application in the simultaneous determination of Hg (Ⅱ), Cd (Ⅱ) and Pb (Ⅱ)[J]. Sensors and Actuators B: Chemical, 2013, 183(1): 303-309.
Immunochromatographic Strip Technology and Its Application in Food Safety Detection
LI Jian-wu1, SONG Chun-mei1, LIU Fang2, WU Shu-yan1, LI Hao-lin3, LIU Cheng3, QIU Shi1, ZENG Hai-juan1, WU Man1, LIU Qing1,*
(1. School of Medical Instrument and Food Engineering, University of Shanghai for Science and T echnology, Shanghai 200093, China; 2. International Travel Health Care Center, Gansu Entry-Exit Inspection and Quarantine Bureau, Lanzhou 700030, China; 3. School of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
Immunochromatographic strip has been popularly used in clinical diagnosis and other areas because of its ease operation, less time-consuming, stable results, relative inexpensiveness and applicability for in situ and domestic testing. As food safety incidents have occurred frequently in recent years, thi s technology has been widely used in rapid food safety testing. In this paper, we overview immunochromatographic strip technology and its recent applications, and discuss its future prospects. We expect that this review will provide useful references for the future development and application of this technology.
immunochromatographic strip; food safety; detection; application
TS201.6
A
1002-6630(2014)08-0036-06
10.7506/spkx1002-6630-201408007
2014-04-11
上海市科委重点支撑项目(13430502400);甘肃省科技支撑计 划项目(1304FKCA056);
国家质检总局科技项目(GSCIQ_2010IK220)
李建武(1990—),男,硕士研究生,研究方向为食品安全检测。E-mail:812391836@qq.com
*通信作者:刘箐(1970—),男,教授,博士,研究方向为食源性致病菌致病机理及快速检测技术。E-mail:liuq@usst.edu.cn

