钨钼冶炼过程中除钒
陈星宇,肖露萍,赵中伟
(中南大学 冶金与环境学院,长沙 410083)
近年来,随着高品位优质钨钼矿物原料的减少[1],杂质含量较高的低品位矿的利用不断增加,使得杂质元素的分离问题显得日益重要,而杂质钒的分离也变得尤为重要[2]。钒作为一种化学性质与钨钼相近的元素[3],目前广泛采用的离子交换法难以将其彻底分离,故大部分钒还是进入到后续溶液并对产品质量造成影响[4]。另外,随着近百年来的工业发展,矿物资源日趋贫化,废硬质合金、高速钢和废催化剂的回收利用已经逐渐受到重视,在许多发达国家和资源匮乏的国家,废弃含钨钼资源的二次利用显得日益重要[5]。这些二次资源中除了含有钨钼外,还含有一定量的V,为了高效地回收利用这些资源,钨钒和钼钒分离的问题显得日益迫切[6]。
在水溶液中,由于钒与钨钼具有十分相似的水溶液性质,造成其难以与钨钼彻底分离,因此,其分离一直被认为是个难题。对于从钨酸盐中分离钒的报道比较少,主要是离子交换法[7]、酸沉法[8-10]等。这些方法主要是利用在较低 pH值条件下钨和钒的存在形态不同,达到分离钒的目的。但目前钨冶炼流程是基于碱法工艺,一般钨浸出液的碱含量较高,为达到分离条件必须耗用大量的酸,这势必会增加了工艺的运行成本。另外,国内外研究人员也对水溶液中钼钒分离进行了大量研究,开发了铵盐沉淀法、硫化法、萃取法和离子交换法等用来分离钼和钒,但同样存在难以克服的问题[11-16]。因此,以上方法并不是经济可行的。为此,十分有必要开发新的从钨酸盐或钼酸盐溶液中除钒的方法。
在海洋化学领域,研究发现 W、Mo、Zr、Re、Sc和V等金属元素在海水中含量很低,但它们在海底沉积物或海产动植物中却相当富集,尤其是在水合氧化物沉积层中。由此表明,水合氧化物对海水中的微量金属元素的吸附作用是很明显的。海洋化学工作者将这种元素富集现象解释为:由于海水中胶体表面的吸附作用,使一些金属元素被吸附而迁移到海底。另外,从具体数据可以看出,尤其是水合氧化铁对钒具有很好的吸附效果。尽管在一定条件下水合氧化铁对钨也有一定的吸附能力,但不及对钒的吸附。从前人的研究结果可以看出当溶液环境变化,尤其是 pH值变化时,水合氧化铁对钒的吸附能力有所变化。由此可以推测,水合氧化铁对钨钼的吸附作用也会有一定的变化。这为从钨酸盐或者钼酸盐溶液中分离钒提供了一种可能。
因此,本文作者将探索不同试剂从钨钼冶炼过程中除钒的效果,试图筛选出有效的除钒试剂,通过调节溶液环境,改变水合氧化物对钨钼钒的吸附性能,使其产生一定吸附差异,达到钨或钼与钒的有效分离。
1 实验
含钒钨酸钠溶液是由分析纯钨酸钠(Na2WO4·2H2O)和五氧化二钒(V2O5)按照m(WO3):m(V2O5)=500:1配制而成,其中WO3的浓度均为50 g/L,V2O5分别为0.1 g/L。含钒钼酸钠溶液是由分析纯钼酸钠(Na2Mo4·2H2O)和五氧化二钒(V2O5)按照 m(Mo):m(V2O5)=500:1配制而成,其中Mo的浓度为50 g/L,V2O5浓度为0.1 g/L。含钒钼酸铵溶液是处理镍钼矿获得的溶液,其中 Mo的浓度为80 g/L,V2O5浓度为0.8 g/L。取一定量的预先配制好的含钒溶液,采用 NaOH溶液或者固体Na2CO3或者是氨水作为调控剂调节反应溶液的 pH值,在磁力搅拌器的搅拌作用下,向含钒溶液中滴加一定量的除钒试剂(加入量都是以V的摩尔倍数计),反应1 h后,停止搅拌,过滤,得到滤液。采用ICP测出其中WO3(Mo)和V2O5浓度,计算除钒率和钨(钼)损率。
2 结果与讨论
2.1 水合氧化锰和水合氧化铝从钨酸钠溶液中除钒
从海洋化学中可知,一些水合氧化物(如铝氧化物,锰氧化物等)对海水中金属痕量元素具有吸附作用。首先探索水合铝氧化物和水合锰氧化物从钨酸钠溶液中对吸附除钒的效果。当采用水合铝氧化物除钒时,加入 AlCl3使其直接在钨酸钠溶液中产生新生态水合氧化铝进行除钒研究。而采用水合锰氧化物除钒时,加入KMnO4和MnSO4使其直接在钨酸钠溶液中反应生成新生态水合氧化锰进行除钒研究。
实验中,钨酸钠溶液中 WO3浓度 50 g/L、V2O5浓度0.1 g/L;铝盐和锰盐的用量分别以其产生的水合氧化物与原液中V的摩尔比为40的量加入,反应时间1 h,反应温度25 ℃。实验结果见图1。
从图1中可以看出,用铝盐进行除钒时,随着pH值的增加,除钒率逐渐增加。当溶液 pH值达到 9.0左右时,除钒率超过90%。但是随着pH值的进一步增加,除钒率反而呈现下降趋势。而对于溶液的钨损失率,则是随着溶液的 pH值增加,钨损率则是不断降低。出现这种情况的主要原因是由于水合氧化铝是一种两性化合物,随着溶液的 pH值增加时,水合氧化铝将会不断被溶解,钒与钨的吸附量将逐渐减小。因而随着溶液 pH值增加,除钒率和钨损率都不断降低。因此,当采用铝盐进行除钒时,为了达到好的除钒效果,必须将溶液pH值控制在较低水平下,同时在钨损较低的pH值范围内适当增大铝盐的用量。
随着溶液pH值的增加,除钒率也是先增加后减少,但是除钒率不高,在pH值为8.7左右,除钒率也只能达到60%左右。而随着pH值的增加,钨损率是逐渐降低的。实验结果显示,由KMnO4和MnSO4反应原位产生的新生态 MnO2对钒的吸附能力有限,导致钨钒的分离效果并不理想。
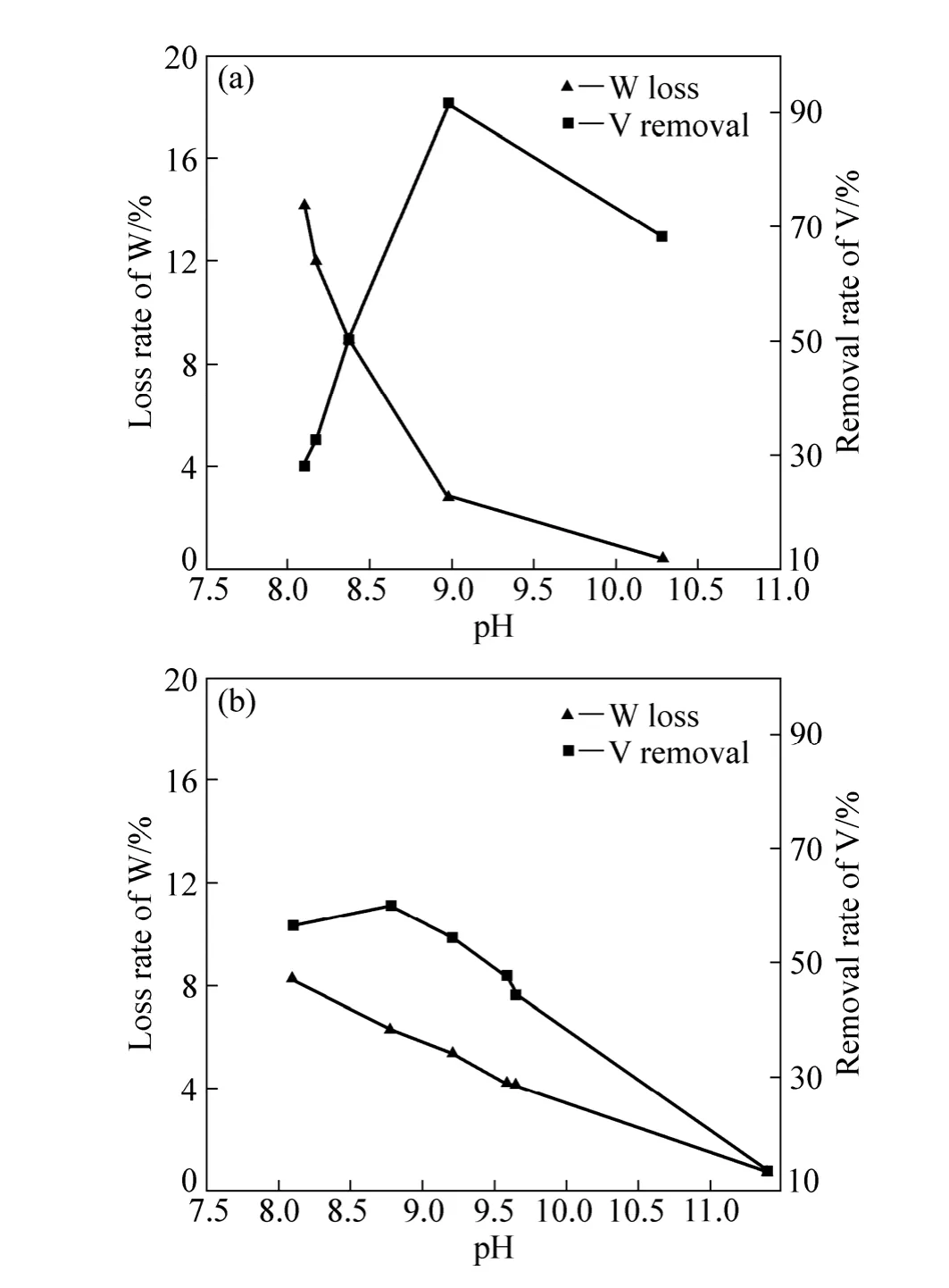
图1 铝盐和锰盐对钨损失率与除钒率的影响Fig. 1 Effects of Al (a) and Mn (b) salts on loss rate of W and removal V
2.2 不同铁盐从钨酸钠溶液中除钒
以上探索实验表明,水合氧化铝和氧化锰不是一种有效的除钒试剂。因此,有必要探索采用水合铁氧化物的除钒效果。实验中选取了 3种常见的铁盐FeCl3、Fe(NO3)3和Fe2(SO4)3分别对钨酸钠溶液进行除钒实验,实验条件如下:Fe3+浓度0.367 mol/L,反应时间1 h,温度25 ℃。
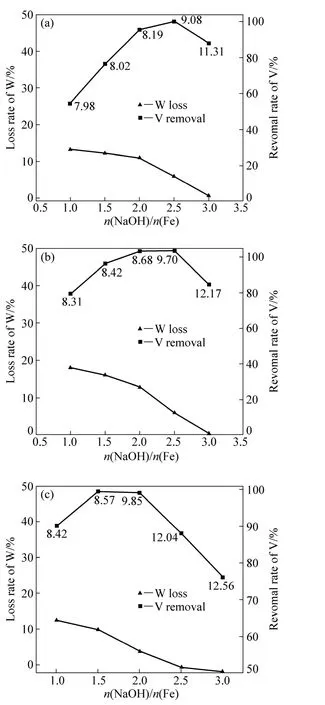
图2 不同pH值条件下FeCl3、Fe(NO3)3和FeCl3对除钒率的影响Fig. 2 Effect of FeCl3 (a), Fe(NO3)3 (b) and FeCl3 (c) on removal rate of V
图2所示为不同pH值条件下FeCl3、Fe(NO3)3和Fe2(SO4)3对除钒率和钨损率的影响。从图2中可以看出,随着NaOH与Fe摩尔比的增加,3种铁盐对pH值的影响变化基本是一致的,即随着NaOH与Fe摩尔比的增加pH值逐渐增加。从图3中还可以看出,随着NaOH与Fe摩尔比的增加,3种铁盐对钨损的影响都是逐渐减少的。因为NaOH与Fe摩尔比的增加使得溶液的pH值逐渐升高,pH值的升高有利于减少吸附剂对W的吸附,因此,钨损是逐渐下降的。当采用FeCl3除钒时,在NaOH与Fe摩尔比为2.5时达到最大,大于99%。对于Fe(NO3)3来说,除钒率在NaOH与Fe摩尔比为2.0~2.5时,达到最大(大于99%),此时,溶液对应的pH值为8.5~9.5。Fe2(SO4)3作为除钒剂时,最佳除钒率在NaOH与Fe摩尔比为1.5时得到,而此时溶液pH值在8.5~9.0之间。实验结果表明:当Fe与V摩尔比为40时,尽管铁盐不同,但只要提供了足够沉钒的铁离子,除钒率将大于99%。不同铁盐对溶液 pH值的影响不同,因此,最佳沉钒率是在不同NaOH与Fe摩尔比条件下得到的。此外,由于溶液体系终点pH值不同,造成钨损失也不同。
将图2与图1相比,可以得出在相同实验条件下,铁盐的除钒效果明显好于水合氧化铝和氧化锰的,且钨损也很低。尽管 FeCl3、Fe(NO3)3和 Fe2(SO4)3都可以作为合适的除钒剂,但综合考虑除钒率和钨损率(除钒率达到最高时,钨损率是最小),FeCl3是最合适的除钒试剂。
2.3 采用铁盐从钼酸钠溶液中除钒
鉴于新生态水合氧化铁对钨酸钠溶液的钒具有很好的除去效果,现将探索获得的最佳实验条件运用到钼酸钠体系中。主要考察反应了 pH值对除钒与钼损的影响,其中FeCl3浓度为0.367 mol/L,添加量为原液中V摩尔量的40倍,反应时间为60 min,实验结果如图3所示。
从图3中可以看出,在实验研究的pH值范围内,随着溶液pH值的增加,除钒率先略微增加。当pH值增加到9.5时,除钒率接近100%。进一步增加pH值,除钒率不断降低。特别是当pH值高于12后,除钒率快速降低。而对于溶液中钼的损失率则是随着溶液pH值的增加不断降低,钼损率最后维持在 1%左右。总体来说,pH值在7.5~10.8之间,除钒率都高于97%,而钼损失率均小于 5%。实验结果表明,在钼酸钠溶液中,水合氧化铁也是一种十分有效的除钒试剂。
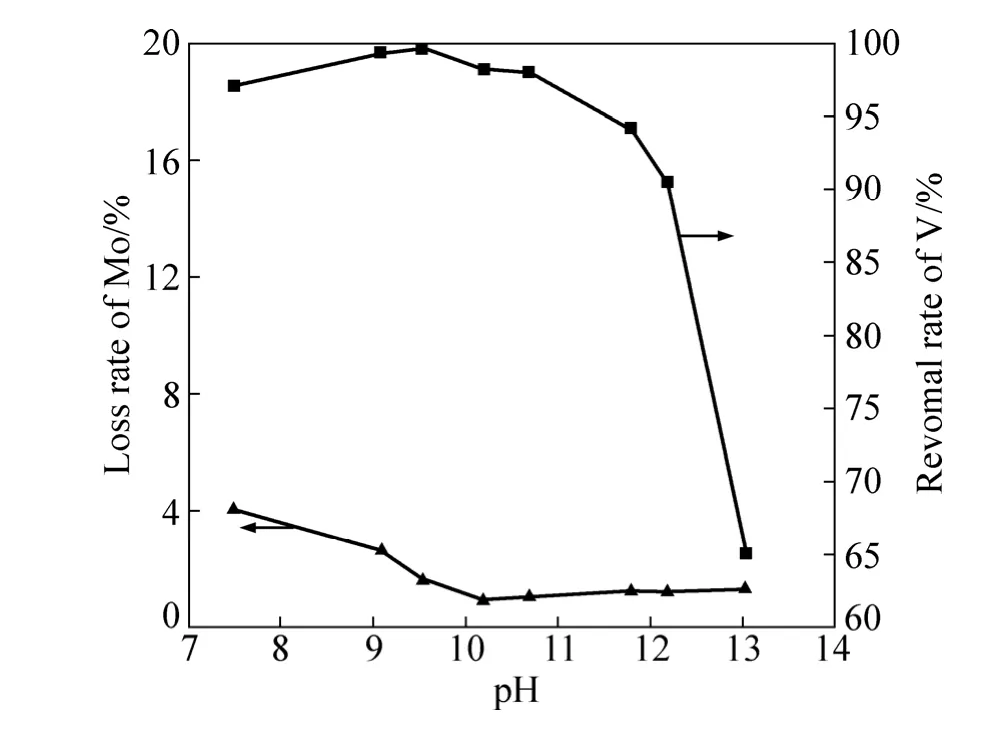
图3 pH值对钼酸钠体系除钒和钼损失的影响Fig. 3 Effect of pH value on V removal and Mo loss in Na2MoO4
2.4 采用铁盐从钼酸铵溶液中除钒
镍钼矿镍钼含量低,成分复杂,经过处理后获得的钼酸铵溶液中含有一定量的钒。现将水合氧化铁除钒法应用到处理这种含钒的钼酸铵溶液。实验中,含钒溶液中m(MMo):m(MV2O5)=100:1,ρ(Mo)=80 g/L,ρ(V2O5)=0.8 g/L,主要考察pH值和吸附剂用量对除钒与钼损的影响,实验结果如图4所示,分别为添加不同用量的除钒试剂的除钒效果。从图4(a)中可以看出,当除钒剂按V的10倍摩尔量加入时,随着溶液pH值的增加,除钒率也逐渐缓慢升高,除钒率都保持在96%以上。于此同时,溶液中的钼几乎没有损失。当除钒剂的加入量增加到20倍时,不同pH值条件下获得除钒率都略微增加,均保持在97%以上。由于除钒剂用量的增加导致溶液中钼的损失率明显增加。特别是在溶液pH值较低时,钼损率达到5.5%。但是随着溶液pH值的增加,钼损率不断降低,当pH值超过9.0时,钼损率降低到 1%以下。以上实验结果表明,若要进一步提高除钒的深度而避免较大钼损的话,可以适当增加吸附剂用量,同时提高溶液的反应pH值。
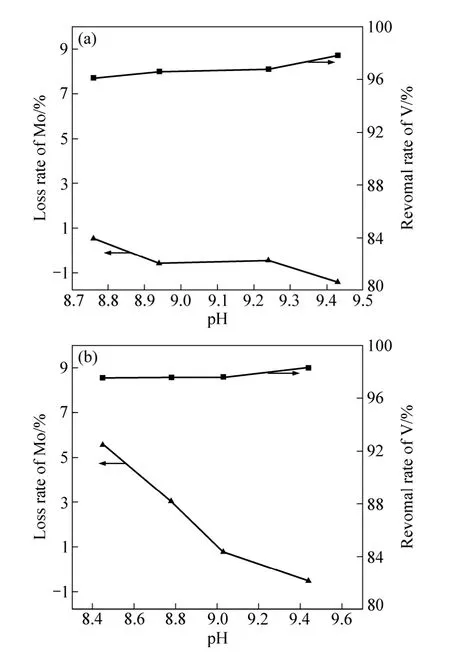
图4 pH值对钼酸铵体系除钒和钼损失的影响Fig. 4 Effect of pH value on removal rate of V and loss rate of Mo in (NH4)2MoO4
3 结论
1) 探索了不同的水合氧化物从钨酸钠溶液中除钒的实验效果。结果表明:相比于水合铝氧化物和锰氧化物,水合铁氧化物具有更好的除钒效果。只要提供足够吸附钒的铁离子,采用不同的铁盐都可以获得高于 99%的除钒率。 综合考虑除钒率和钨损失率,FeCl3是最合适的除钒试剂。
2) 利用铁盐从钼酸钠体系除钒,结果表明:当铁盐的添加量按Fe与V摩尔比为40、体系pH为7.5~10.8和反应时间为60 min的条件下进行除钒,除钒率可达到97%,钼损失率小于5%。
3) 从钼酸铵体系除钒的实验结果显示:当铁盐的添加量按Fe与V摩尔比为10、体系pH为8.6~9.0和反应时间为60 min的条件下进行除钒,除钒率在96%以上,且几乎没有钼的损失;当除钒剂用量提高到20倍时,除钒率均高于97%,当溶液pH值高于9.0时,钼的损失率可以控制在1%以下。
[1] 李洪桂, 赵中伟. 我国钨冶金技术的进步:纪念中国钨业100年[J]. 中国钨业, 2007, 22(6): 7-10.LI Hong-gui, ZHAO Zhong-wei. The technology progress in china tungsten metallurgy—To the 100th anniversary of China tungsten industry[J]. China Tungsten Industry, 2007, 22(6):7-10.
[2] 杨利群. 苏打烧结法处理低品位钨矿及废钨渣的研究[J]. 中国钼业, 2008, 32(4): 25-27.YANG Li-qun. Study of processing low-grade tungsten mineral and waste residue of tungsten by soda sintering[J]. China Molybdenum Industry, 2008, 32(4): 25-27.
[3] 廖世明, 柏谈论. 国外钒冶金[M]. 北京:冶金工业出版社,1985: 281-282.LIAO Shi-ming, BO Tan-lun. Foreign vanadium metallurgy[M].Beijing: Metallurgical Industry Press, 1985: 281-282.
[4] 李洪桂. 稀有金属冶金学[M]. 北京:冶金工业出版社, 1990:22-47.LI Hong-gui. Rare metals metallurgy[M]. Beijing: Metallurgical Industry Press, 1990: 22-47.
[5] KIEFFER B F, LASSNER E. Proceedings of the Fourth International Tungsten Symposium[C]//Vancouver: MPR Publishing Services Ltd, 1987: 59-67.
[6] LASSNER E. Modern methods of APT processing[C]//San Fraucisco: Proceedings of the Second International Tungsten Symposium, 1982: 71-80.
[7] 宋 阜, 朱宾权. 离子交换法分离富集钨酸钠溶液中的钒[J].稀有金属与硬质合金, 2006, 34(3): 5-7, 11.SONG Fu, ZHU Bing-quan. Extraction of vanadium from sodium tungstate by ion exchange[J]. Rare Metals & Cemented Carbides, 2006, 34(3): 5-7, 11.
[8] DOUGLAS D A, JAMEEL M. Process for recovering chromium,vanadium, molybdenum and tungsten values from a feed material[P]. US patent: 4298581, 1981-11-03.
[9] 罗 琳, 藤田丰久, 治进藤. 从废弃的钨金属制品中回收钨和钒[J]. 矿冶, 2002, 11(1): 50-54, 76.LUO LIN, FUJITA T, SHINDO O. Recovery of tungsten and vanadium from the tungstate scrap[J]. Mining and Metallurgy,2002, 11(1): 50-54, 76.
[10] LUO L, LIU K J, ATSUSHI S, YEN W, FUJITA T, SHINDO O,KATAI A. Recovery of tungsten and vanadium from tungsten alloy scrap[J]. Hydrometallurgy, 2004, 72(1/2): 1-8.
[11] LYAUDET G, VIAL J. Process for the separate recovery of molybdenum and vanadium[P]. US Patent: 4587109,1986-05-06.
[12] ROGER F S, PABLO P L, JOHN M L. Recovery of metal values from spent hydrodesulfurization catalysts[P]. US Patent:4495157, 1985-01-22.
[13] 周新花, 郑洁修, 马玉龙. 溶剂萃取法从含钒水浸溶液分离钒和钼[J]. 武汉大学学报, 1991(4): 83-88.ZHOU Xin-hua, ZHENG Jie-xiu, MA Yu-long. Studies on the extraction of V(Ⅴ) with diminished yield of Mo(Ⅵ) from vanadium containing leaching liquor[J]. Journal of Wuhan University, 1991(4): 83-88.
[14] HU J, WANG X W, XIAO L S, SONG S R, ZHANG B Q.Removal of vanadium from molybdate solution by ion exchange[J]. Hydrometallurgy, 2009, 95(3/4): 203-206.
[15] NGUYEN T H, LEE M S. Separation of molybdenum and vanadium from acid solutions by ion exchange[J].Hydrometallurgy, 2013, 136: 65-70.
[16] 张报清, 雷 霆, 方树铭, 王学文, 沈波涛, 姬成岗. 钼酸铵溶液化学沉淀法和离子交换法除钒研究[J]. 稀有金属, 2012,36(3): 466-471.ZHANG Bao-qing, LEI Ting, FANG Shu-ming, WANG Xue-wen, SHEN Bo-tao, JI Cheng-gang. Removal of vanadium from ammonium molybdate solution by chemical precipitation and ion exchange[J]. Chinese Journal of Rare Metals, 2012,36(3): 466-471.

