荞麦蜂花粉的氧化应激防护及其活性成分分析
, ,左,,振宇,,*
(1.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨 150090;2.国家知识产权局专利局专利审查协作江苏中心,江苏苏州 215011;3.东北林业大学林学院,黑龙江哈尔滨 150040)
花粉作为植物的雄性生殖细胞,在植物的生命过程中具有重要作用,被赋予“植物生命之源”的称号。花粉含有植物发育所需要的全部营养物质,是很好的药食同源食品。蜂花粉是蜜蜂采蜜带回的花粉团,其生理活性功能在近年来得到了广泛深入的研究。现已有很多关于蜂花粉的免疫活性、抗菌、抗肿瘤和促进淋巴细胞增殖活性等研究,使其在食品、药品、化妆品等领域得到了广泛的应用。
蜂花粉含有丰富的多酚、黄酮、多糖、不饱和脂肪酸等生物活性物质,这些活性物质使蜂花粉具有多种活性功能。Leja M等人的研究发现,蜂花粉多具有较强的抗氧化活性,且其抗氧化能力与多酚含量成正相关[1]。Li F等人指出山楂蜂花粉中含有一种水溶性多糖,具有良好的免疫增强功能[2]。Medeiros K等人研究发现蜂花粉具有良好的抗过敏功能,且指出黄酮类物质是主要的抗过敏活性物质[3]。
近年来,我国有学者对荞麦蜂花粉的活性物质进行了纯化和测定,并对其黄酮、多糖及多肽等活性成分的生理活性功能进行了一定程度的研究,指出其具有一定的抗氧化活性,但未见关于荞麦蜂花粉氧化应激防护的系统报道,而国外也尚无荞麦蜂花粉的详细报道。本文比较了荞麦蜂花粉水提取物和醇提取物的体外抗氧化能力以及促骨髓干细胞增殖的能力,并研究了荞麦蜂花粉水提取物的氧化损伤防护作用,测定了其营养活性物质。
1 材料与方法
1.1 材料与仪器
荞麦蜂花粉 市售级别,购于哈尔滨松霖园工贸有限公司;福林酚、ABTS、Trolox 购于sigma公司;其他无机试剂均为分析纯 购于天津市科密化学试剂制造有限公司;胎牛血清和α-MEM培养基 生物纯,购于HyClone公司。
Model 550酶标仪 美国Bio-Rad公司;HEPACLASS100 CO2培养箱 美国Thermo公司;LC1200液相色谱分析仪 美国Agilent公司;7890A气象色谱分析仪 美国Agilent公司;L-8800全自动氨基酸分析仪 日本日立公司;其他仪器设备均系国产。
1.2 实验方法
1.2.1 荞麦蜂花粉提取物的制备 荞麦蜂花粉提取物的制备参考LEBLANC B的方法,稍作改动。将蜂花粉于40℃下烘干,粉碎过40目筛。取5g蜂花粉,分别用100mL去离子水和70%乙醇进行提取。首先于4℃下磁力搅拌提5h,然后采用超声辅助提取90min,每隔30min震荡一次,然后放入4℃冰箱过夜。取出后3000r/min离心10min,取上清定容至100mL。活性物质含量的测定和抗氧化实验测定均在提取物制备7d内完成[4]。
1.2.2 花粉提取物体外抗氧化活性的测定
1.2.2.1 清除ABTS自由基能力 ABTS母液及工作液的配制参照FAN[5]等给出的方法,在734nm下,将ABTS母液稀释至A0=0.700~0.720,然后取0.1mL稀释的样品与ABTS工作液1.4mL混匀后,暗处反应6min,在734nm下测定不同梯度样品的吸光度A。Trolox作为阳性对照。
清除能力(%)=(1-A/A0)×100
1.2.2.2 清除羟基自由基能力 在测定管中依次加入0.5mL不同浓度的样品,1mL水杨酸(9mmol/L,50%的乙醇作溶剂),1mL硫酸亚铁(9mmol/L),最后加入1mL双氧水(8.8mmol/L)启动反应,在37℃下反应30min,于510nm下测定吸光度A,空白管中不加样品测定吸光度A0,对照管中不加双氧水测定吸光度Ai0。抗坏血酸为阳性对照[6]。
清除能力(%)=(1-(A-Ai0)/A0)×100
1.2.3 荞麦蜂花粉提取物促骨髓干细胞增殖活性研究
1.2.3.1 骨髓干细胞的提取 取150~180g的SD大鼠股骨,用新鲜培养液冲洗(含10%胎牛血清的α-MEM)骨髓,收集到10mL离心管中1000r/min离心10min后弃上清,加入3mL培养液重悬细胞,然后移入培养瓶培养24h半量换液,48h后全量换液[7-8]。待细胞融合度达到80%~90%后,用胰酶消化,传代培养。
1.2.3.2 骨髓干细胞增殖实验 用胰酶消化细胞,准确计数,铺到96孔板中(100μL/孔),经72h后,更换培养液并加入5μL不同浓度的蜂花粉提取物,培养72h后,用MTT的方法,在490nm下测定吸光度[9-10]。
1.2.4 辐射对骨髓干细胞的氧化损伤研究 骨髓干细胞铺于96孔板中,60Co γ-射线辐射(8Gy),在辐射前24h加入20%不同浓度(低、中、高剂量浓度分别是0.5、0.75、和1mg/mL)的蜂花粉提取物,辐射后培养24h后,用MTT法,在490nm下测定吸光度,计算细胞的存活率。正常组为未辐射未加药骨髓干细胞,模型组为辐射但未加药骨髓干细胞。
1.2.5 荞麦蜂花粉水提取物主要成分含量分析
1.2.5.1 总多酚含量测定 参考Fan Ziluan[5]的方法测定总多酚含量,并稍作修改。以没食子酸配制标准溶液,制作标准曲线。
1.2.5.2 总黄酮含量测定 参照FAN Ziluan[5]的方法测定总黄酮含量,并稍作修改。以儿茶素配制标准溶液,制作标准曲线。
1.2.5.3 蛋白质含量测定 采用考马斯亮蓝蛋白测定试剂盒(南京建成生物工程研究所)测定蜂花粉提取物中蛋白质含量。
1.2.5.4 总糖含量测定 总糖含量的测定参照杨晓萍等[11]提供的方法,即蒽酮-硫酸法。以D-葡萄糖为标准品,绘制总糖的标准曲线。
1.2.5.5 氨基酸组成分析 用日立L-8800型氨基酸分析仪,根据张华[12]等人的方法测定荞麦蜂花粉水提取物中氨基酸含量。
1.2.5.6 单糖组成分析
a.单糖的水解 采用三氟乙酸将多糖分解为单糖。用5mL 2.0mol/mL的三氟乙酸(TFA)将30.0mg荞麦蜂花粉水提取物完全溶解,封管并于110℃水解4h。待水解液冷却至室温,50℃减压蒸干,加入5mL甲醇溶解,用氮气吹干,重复溶解吹干4~5次,以完全除去TFA。
b. 单糖乙酰化 糖类物质本身没有足够的挥发性,本实验将单糖衍生为具有挥发性的糖醇乙酸酯,以进行气相色谱分析。将单糖溶液或混标液用4mL去离子水溶解,加入40mg硼氢化钠还原3h,每30min震荡一次。向反应液中加入适量乙酸以除去多余的硼氢化钠。50℃减压蒸干,加入5mL甲醇溶解,用氮气吹干,重复溶解吹干4~5次,以除去硼酸。110℃烘干20min以除去水分。加入6mL乙酸酐和2mL吡啶,100℃反应3~5h,沉淀完全溶解后,80℃减压蒸干,加入5mL氯仿溶解。用等体积的去离子水洗涤2~3次,除去多余的乙酸酐和其他离子,最后加入无水硫酸钠除水后,过滤上机。
c. 单糖混和标准工作液的配制 准确称量7种标准单糖(D-核糖,L-鼠李糖,L-阿拉伯糖,D-木糖,D-甘露糖,D-葡萄糖,D-半乳糖)各0.1000g,用去离子水定容至100mL。分别移取单糖混合标准储备液0.25、0.50、2.50、5.0、10.0mL置于10mL棕色容量瓶中,用去离子水定容,得到浓度为0.025、0.050、0.250、0.500、1.000mg/mL的标准工作液。
d. GC-MS分析 气相色谱条件:色谱柱为DB-5弹性石英毛细管柱(60m×0.25mm×0.25μm),程序升温条件为初温200℃,以25℃/min升至250℃,保持10min,载气为He,进样量为1μL,流速为1.0mL/min。进样口温度250℃,分流比1∶10。
质谱条件:电子轰击源EI,电子能量70eV,倍增器电压350v,接口温度250℃,离子源温度150℃,四级杆温度:230℃,质量数扫描范围35~450amu,用NIST02质谱库检索加以确认。
1.2.6 数据分析 实验数据采用平均值±标准差的形式呈现,文中图表采用origin8.5绘制,统计检验采用SPSS19.0软件,差异性分析采用one-way ANOVA方法。
2 结果与讨论
2.1 荞麦蜂花粉提取物体外抗氧化活性
根据荞麦蜂花粉水提取物和醇提取物体外清除ABTS和羟基自由基能力比较其抗氧化活性。
2.1.1 荞麦蜂花粉提取物清除ABTS自由基活性 荞麦蜂花粉水提取物和醇提取物清除ABTS自由基的能力如图1所示。二者都具有一定的清除ABTS自由基的能力,且其清除活性随浓度的增加而增强。荞麦蜂花粉水提取物和醇提取物清除ABTS自由基活性的EC50值(清除率达到50%时,提取物的浓度)分别为13.68和12.32mg/mL。可见,水提取物清除ABTS自由基的能力高于醇提取物,但二者之间并无显著性差异(p>0.05),不过二者均高于阳性对照Trolox(EC50值为108.47mg/mL,图2)。

图1 荞麦蜂花粉水提取物和醇提取物清除ABTS自由基比较 Fig.1 ABTS scavenging capacities of water and ethanol extracts of buckwheat bee pollen

图2 Trolox清除ABTS自由基能力 Fig.2 ABTS scavenging capacity of Trolox
2.1.2 荞麦蜂花粉提取物清除羟自由基活性 荞麦蜂花粉提取物清除羟自由基能力如图3所示。水提取物和醇提取物均具有一定的清除羟自由基的能力,其中水提取物在浓度为50mg/mL时,清除率最大可达到91.90%,而醇提取物清除率最大只有9.55%。可见,荞麦蜂花粉水提取物清除羟自由基的能力显著强于醇提取物(p<0.01)。然而,荞麦蜂花粉水提取物清除羟自由基能力(EC50值为11.17mg/mL)弱于阳性对照抗坏血酸(EC50值0.30mg/mL,图4)。

图3 荞麦蜂花粉水提取物和醇提取物清除羟自由基能力比较 Fig.3 Hydroxyl radical scavenging capacities of water and ethanol extracts of buckwheat bee pollen
2.2 荞麦蜂花粉促骨髓干细胞增殖活性
荞麦蜂花粉提取物对骨髓干细胞增殖能力的影响如图5所示。可以看出,二者均具有一定的促增殖能力。荞麦蜂花粉水提取物浓度在1.0mg/mL时促骨髓干细胞增殖能力最大,达到74.74%;而醇提取物促骨髓干细胞增殖能力在浓度0.75mg/mL时达到最大,为28.01%。可以看出,荞麦蜂花粉水提取物比醇提取物具有更高的促骨髓干细胞增殖的能力。
2.3 荞麦蜂花粉水提取物对辐射后骨髓干细胞存活率的影响
综合2.1和2.2的实验结果,可以得出荞麦蜂花粉水提取物比醇提取物具有更好的体外抗氧化能力和促骨髓干细胞增殖能力。

表1 荞麦蜂花粉水提物活性成分含量分析Table 1 Active components of buckwheat bee pollen
因此,以辐射诱导氧化伤害的骨髓干细胞为模型,研究了不同浓度荞麦蜂花粉水提取物对细胞存活率的影响,来探讨其对氧化伤害的防护作用,如图6所示。
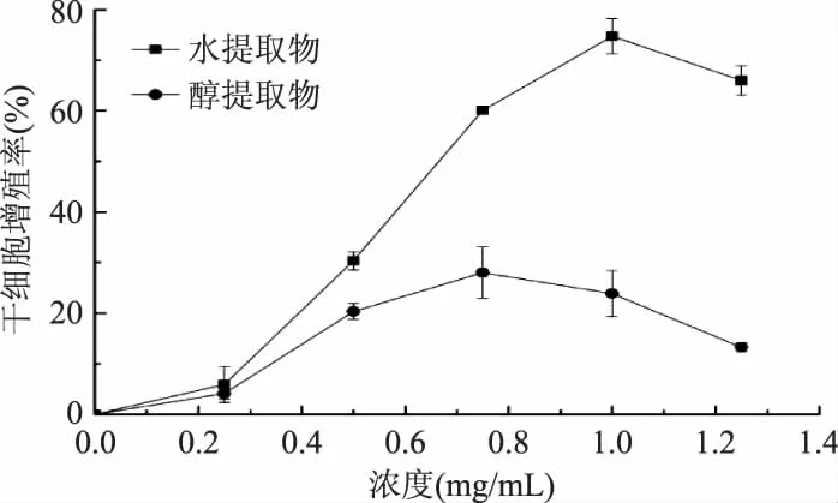
图5 荞麦蜂花粉水提取物和醇提取物促骨髓干细胞增殖能力 Fig. 5 Effect of water and ethanol extracts of buckwheat ee pollen on the proliferation of bone marrow stem cells

图6 荞麦蜂花粉水提取物对骨髓干细胞存活率的影响 Fig.6 Effect of WEBBP on viabilities of bone marrow stem cells
结果显示,经8Gy γ-射线辐射后,辐射模型组的骨髓干细胞存活率显著(p<0.01)低于正常组,加药组骨髓干细胞存活率也低于正常对照组,但只有低、中剂量组显著(p<0.05)。加药组骨髓干细胞的存活率显著(p<0.05)高于辐射模型组,中、高剂量组极显著(p<0.01),而且高剂量组与正常对照组无明显差异,说明荞麦蜂花粉水提取物可以保护骨髓干细胞免受辐射伤害,并能使存活率接近正常水平。这一结果与荞麦花蜂粉水提取物体外抗氧化和促干细胞增殖活性结果一致,故可以推断,其辐射防护作用可能与其抗氧化和促干细胞增殖活性相关。
2.4 荞麦蜂花粉水提取物主要成分的确定
对荞麦蜂花粉水提取物进行成分分析,用福林酚法、AlCl3法、蛋白试剂盒和蒽酮硫酸法分别测定其中总多酚含量、总黄酮含量、蛋白含量和总糖含量。
总多酚回归方程:y=0.0026x+0.0215
式中y为760nm处溶液的吸光度;x为溶液中的没食子酸含量(μg/mL),方程的拟和度R2=0.999。
总黄酮回归方程:y=0.0014x+0.0154
式中y为溶液在510nm处的吸光度;x为溶液中的儿茶素含量(μg/mL),方程的拟和度R2=0.999。
总糖回归方程:y=0.0094x+0.0081
式中:y为溶液在620nm处的吸光度;x为溶液中的葡萄糖含量(μg/mL),方程的拟和度R2=0.999。
结果如表1所示,其总糖和总蛋白质含量较高,可以推测,荞麦蜂花粉水溶性物质中主要成分可能是水溶性多糖,也可能是糖蛋白。
为进一步了解荞麦蜂花粉的抗辐射机制,通过氨基酸分析仪测定荞麦蜂花粉水提取物中氨基酸组成,采用气相色谱法分析其单糖组成。
对荞麦蜂花粉水溶性成分中的蛋白质进行氨基酸分析,氨基酸分析图谱如图7所示,氨基酸组成如表2所示。
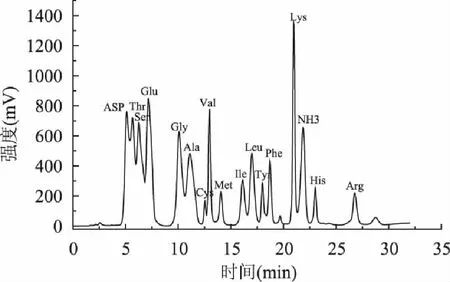
图7 氨基酸组成图谱 Fig.7 Amino acid composition chromatograms
荞麦蜂花粉水提取物中富含17种必需氨基酸和非必需氨基酸,占总氨基酸含量的比例在2.10%~13.30%之间。其中谷氨酸、天冬氨酸、赖氨酸、苏氨酸、丝氨酸含量较高,而蛋氨酸、组氨酸和半胱氨酸含量相对较低,这与李云捷[13]研究的玉米花粉多糖中氨基酸含量的趋势一致,说明不同花粉其氨基酸组成类似。值得一提的是,赖氨酸可以促进造血功能[14-15],而荞麦蜂花粉水提取物中赖氨酸的含量很高,因此可以推测,赖氨酸可能对干细胞的增殖具有促进作用,降低辐射损伤造成的干细胞死亡率。
荞麦蜂花粉水溶性成分中,总糖是主要成分,本实验通过GC/MS测定荞麦蜂花粉中多糖的单糖组成,实验结果见图8和表3所示。
结果显示,荞麦蜂花粉水溶性多糖是由核糖、鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成,其摩尔比是0.35∶0.95∶27.78∶0.93∶1.70∶13.19∶16.16。其中阿拉伯糖所占比例最高,比核糖高约79倍,其次是半乳糖、葡萄糖、木糖和鼠李糖、核糖。研究发现,阿拉伯糖、半乳糖在植物中可以以阿拉伯半乳聚糖的形式存在,此类中性多聚糖具有明显提高机体免疫系统活力,尤其对巨噬细胞吞噬作用更具有显著促进作用。此外,阿拉伯半乳聚糖还具有抑制肿瘤转移的作用[16],而Cai Yizhong对112种抗癌中草药提取物研究后指出,抗癌药物普遍具有较强的抗氧化作用,而天然产物抗辐射的主要机制之一就是其清除自由基的抗氧化能力[17]。由此可以推断,荞麦蜂花粉水提取物中可能含有阿拉伯半乳聚糖,具有提高机体免疫力的作用,提高辐射防护作用,而葡萄糖、核糖可为骨髓干细胞增殖提供能量和原料。
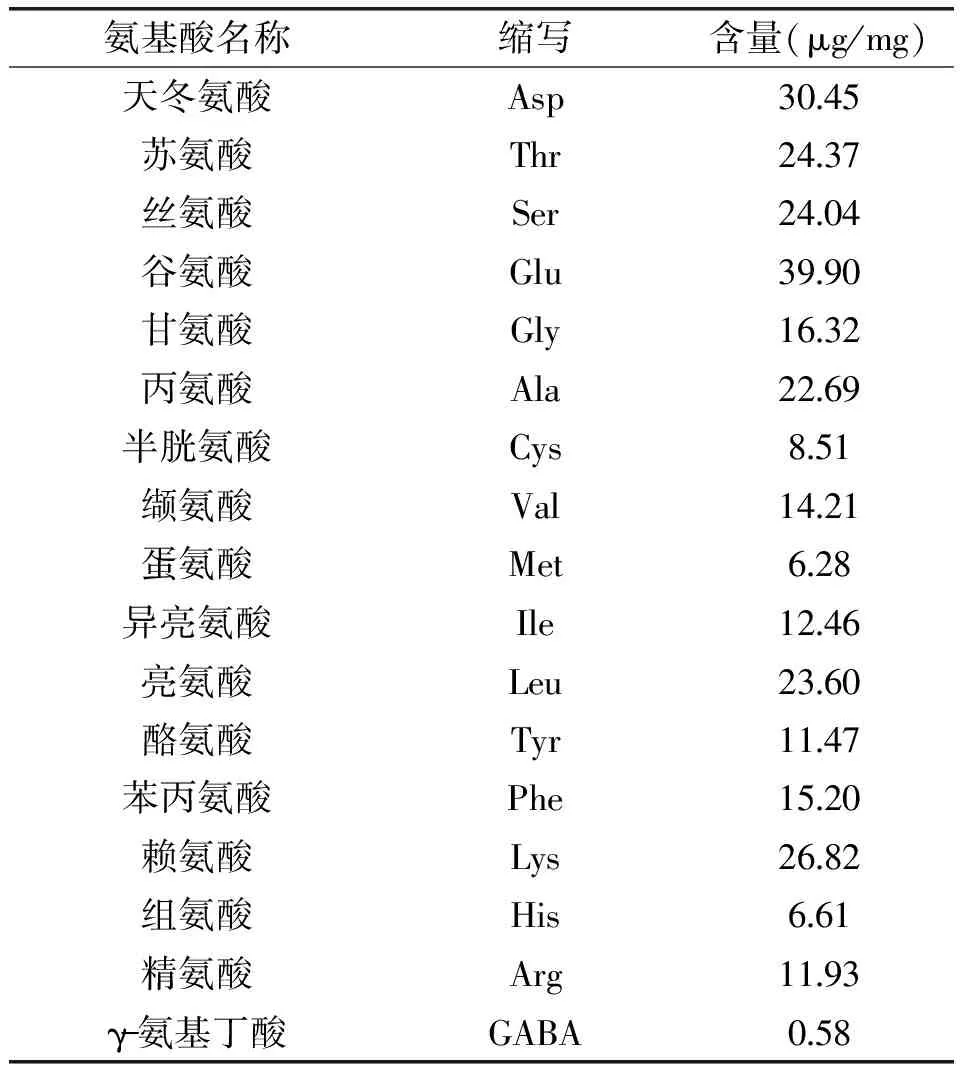
表2 氨基酸组成分析Table 2 Amino acid composition
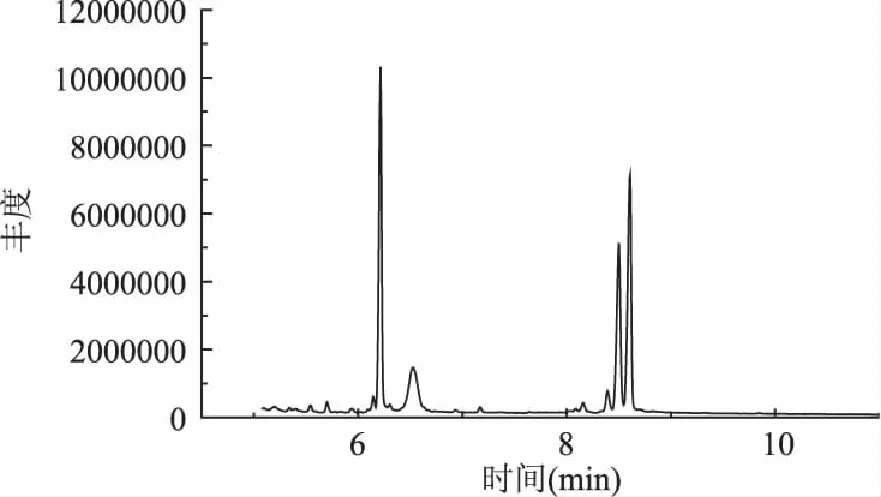
图8 单糖组成图谱 Fig.8 GC-MS chromatograms of monosaccharides
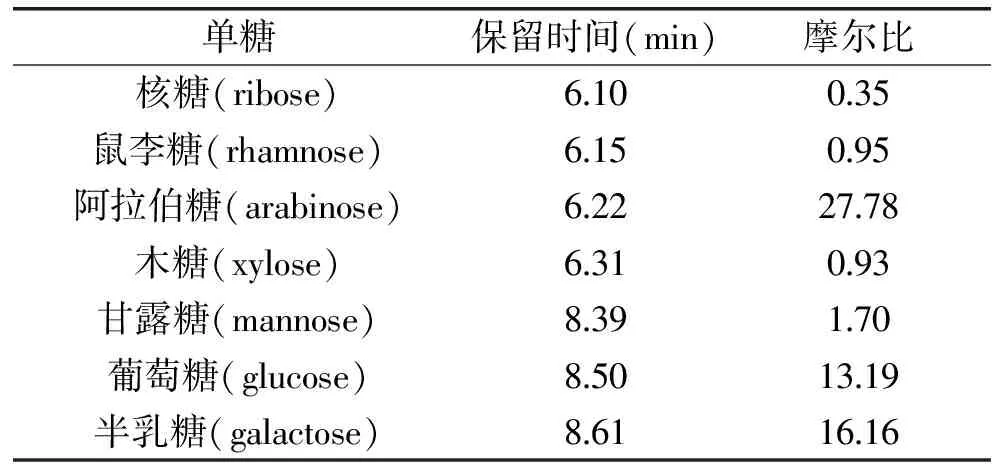
表3 单糖组成摩尔比Table 3 The molar ratio of monosaccharides
3 结论
荞麦蜂花粉水提取物和醇提取物均具有一定的体外抗氧化活性和促骨髓干细胞增殖活性,且水提取物的活性要强于醇提取物。以辐射诱导氧化损伤的骨髓干细胞为模型,确定了荞麦蜂花粉水提取物对氧化损伤也具有一定的防护作用。成分分析研究发现,荞麦蜂花粉水提取物总糖和蛋白质含量较高,推测其主要活性成可分能为糖蛋白或水溶性多糖。本实验为荞麦蜂花粉天然辐射防护剂和抗氧化物的研发提供了一定的理论依据,为荞麦蜂花粉活性功能的进一步开发奠定了基础。
[1]Leja M,Mareczek A,Wyzgolic G,etal. Antioxidative properties of bee pollen in selected plant species[J]. Food Chem,2007,100(1):237-240.
[2]Li Fei,Yuan Qipeng,Rashid F. Isolation,purification and immunobiological activity of a new water-soluble bee pollen polysaccharide from Crataegus pinnatifida Bge[J]. Carbohydrate Polymers,2009,78(1):80-88.
[3]Medeiros K,Figueredo C,Figueredo T,etal. Anti-allergic effect of bee pollen phenolic extract and myricetin in ovalbumin-sensitized mice[J]. Journal of Ethnopharmacology,2008,119(1):41-46.
[4]Leblanc B,Davis O,Boue S,etal. Antioxidant activity of Sonoran Desert bee pollen[J]. Food Chem,2009,115(4):1299-1305.
[5]Fan Ziluan,Wang Zhenyu,Liu Jiaren. Cold-field fruit extracts exert different antioxidant and antiproliferative activitiesinvitro[J]. Food Chem,2011,129:402-407.
[6]王艳敏. 蜂花粉中有效成分的提取及功能性研究[D]. 南昌:南昌大学,2010:1-2.
[7]Lennon D,Caplan A. Isolation of rat marrow-derived mesenchymal stem cells[J]. Experimental Hematology,2006,34(11):1606-1607.
[8]Lee J,Kosinski P,Kemp D. Contribution of human bone marrow stem cells to individual skeletal myotubes followed by myogenic gene activation[J]. Experimental Cell Research,2005,307(1):174-182.
[9]许春姣,翦新春,郭峰,等. 黄芪多糖对犬骨髓基质干细胞增殖及超微结构的影响[J]. 华西口腔医学杂志,2007,25(5):432-436.
[10]Lin J,Tang C. Determination of total phenolic and flavonoid contents in selected fruits and vegetables,as well as their stimulatory effects on mouse splenocyte proliferation[J]. Food Chem,2007,101:140-147.
[11]杨晓萍,吴谋成. 油菜蜂花粉多糖的提取、分离、结构及生物活性的研究[D]. 武汉:华中农业大学,2005:8-24.
[12]张华,杨鑫,张英春,等. 玉米蛋白中可溶性蛋白水解氨基酸组成的测定[J]. 中国粮油学报,2007,6(22):19-22.
[13]李云捷. 玉米花粉多糖的分离、纯化、结构鉴定及抗氧化活性的研究[D].武汉:华中农业大学,2005:5-6.
[14]于瑞,王兴涌. 各类氨基酸的应用研究进展[J]. 化工中间体,2011,10:13-17.
[15]徐琪寿. 氨基酸药理学研究进展[J]. 氨基酸和生物资源,1996,18(1):30-32.
[16]黄占华. 微波与超声波辅助提取落叶松中的阿拉伯半乳聚糖及纯化[D]. 哈尔滨:东北林业大学,2003:9-12
[17]Cai Yizhong,Luo Qiong,Sun Mei,et al. Antioxidative activity and phenolic compounds of 112 traditional Chinese medical plants associated with anticancer[J]. Life Sciences,2004,74(17):2157-2184.

