响应面法优化黄秋葵多糖脱色工艺
, ,
(青岛农业大学食品科学与工程学院,山东青岛 266109)
黄秋葵(AbelmoschusesculentusL. )又名秋葵、补肾草,为一年生草本植物,20世纪90年代从台湾、日本等地进入大陆,因其具有多种功能而被称为“植物伟哥”。大量研究表明,黄秋葵多糖是黄秋葵的主要活性成分,具有抗疲劳[1 - 2]、提高免疫力[3]、抗氧化[4 - 5]、降血脂[6]、抗肿瘤[7]等多种活性。目前黄秋葵多糖主要是从荚果中提取获得,任丹丹等[8]用响应面法优化黄秋葵多糖超声提取工艺;赵焕焕[5]用水提醇沉分方法取得黄秋葵荚果中的多糖。黄秋葵茎含有同样丰富的多糖资源,但却被当做工业废料而遗弃,造成巨大的浪费。这主要是因为与黄秋葵荚果相比,茎中色素含量较高,增加了多糖分离纯化的技术难度。对黄秋葵茎多糖进行脱色处理可以使其获得良好色泽,增加茎的经济价值。
在传统脱色方法中,活性炭法脱色时间长、多糖保留率低;双氧水法脱色对多糖结构会有较大的破坏作用,影响多糖活性[9]。新兴的大孔树脂脱色法不仅具有较高的物理化学稳定性和较强的处理能力,还具有较大的比表面积、较快的吸附速度、温和的脱色条件、较低的成本等诸多优点[10 - 11],近年来受到广泛关注。其中,大孔树脂HP - 20是非极性树脂,性质稳定,具有良好的吸附能力。廖海兵[12]用大孔树脂HP - 20从黄秋葵果甲醇提取物中分离出多种黄酮。目前,未见用大孔树脂HP - 20对黄秋葵多糖脱色的研究。
本文研究了大孔树脂HP - 20对黄秋葵茎多糖进行脱色的工艺条件,并用响应面法对其脱色参数进行优化,为黄秋葵茎的开发和综合利用奠定基础。
1 材料与方法
1. 1 材料与仪器
黄秋葵茎 市场采购;大孔树脂HP - 20 日本三菱DIAION公司生产;考马斯亮蓝,苯酚,浓硫酸,乙醇,盐酸,氢氧化钠等 均为分析纯。
DU - 800紫外分光光度计 美国Beckman公司;TGL - 16M高速台式冷冻离心机 长沙湘仪离心机器有限公司;冷冻干燥机 北京博医康实验仪器有限公司;RE - 52AA型旋转蒸发仪 上海亚荣生化仪器厂;恒温振荡培养箱 苏州麦可旺志生物技术有限公司。
1. 2 实验方法
1. 2. 1 黄秋葵多糖制备方法 黄秋葵茎晒干,按料水比1∶ 15加蒸馏水于22℃以180r/min摇床震荡提取8h,纱布过滤,10000r/min离心20min,取上清液冷冻干燥备用。
1. 2. 2 大孔树脂处理方法 一定量大孔树脂HP - 20以一倍体积的95%乙醇浸泡24h,用蒸馏水洗至无酒精后,5%盐酸浸泡2h,水洗至中性,再用2%氢氧化钠浸泡2h,蒸馏水洗至中性并浸泡备用。
1. 2. 3 单因素实验 以脱色率和多糖保留率为指标,确定上样质量浓度、脱色pH、脱色温度及脱色时间的最优参数。采用大孔树脂静态脱色模型,基本脱色参数为:取大孔树脂5mL于100mL三角瓶中,加入5mg/mL、pH为7的黄秋葵多糖溶液40mL,置于20℃保温120r/min震荡脱色7h,滤布过滤,取上清液计算脱色率和多糖保留率。
1. 2. 3. 1 样品质量浓度对脱色效果的影响 分别将黄秋葵多糖溶液的质量浓度配成0. 5、1、5、10、15、20mg/mL,pH为7,脱色温度20℃,脱色7h,进行脱色并计算脱色率和多糖保留率。
1. 2. 3. 2 pH对树脂脱色的影响 5mg/mL黄秋葵多糖溶液pH分别为3、5、7、9、11,脱色温度20℃,为避免长时间极端pH环境会对大孔树脂的破坏作用,因此脱色时间为缩短为3h,进行脱色并计算脱色率和多糖保留率。
1. 2. 3. 3 脱色温度对大孔树脂脱色的影响 将5mg/mL pH7的黄秋葵多糖溶液分别置于10、20、30、40、50℃环境中脱色,为了避免长时间高温大孔树脂的破坏,因此将脱色时间缩短为3h,进行脱色并计算脱色率和多糖保留率。
1. 2. 3. 4 脱色时间对树脂脱色的影响 将5mg/mL pH7的黄秋葵多糖溶液于20℃环境中分别脱色1、3、5、7、9、20h,进行脱色并计算脱色率和多糖保留率。
1. 2. 4 响应面实验 根据Box - Behnken中心组合实验设计原理,综合分析单因素实验结果,在Design -expert 8. 0. 6软件平台上,选取对脱色率和多糖保留率影响较为显著(p<0. 05)的因素,设计响应面实验设计,并进行结果分析。
参考单因素实验的结果,选取黄秋葵多糖溶液上样质量浓度、pH、脱色温度、脱色时间4个因素,设计了4因素3水平的响应面分析实验。设计因素水平及编码见表1。
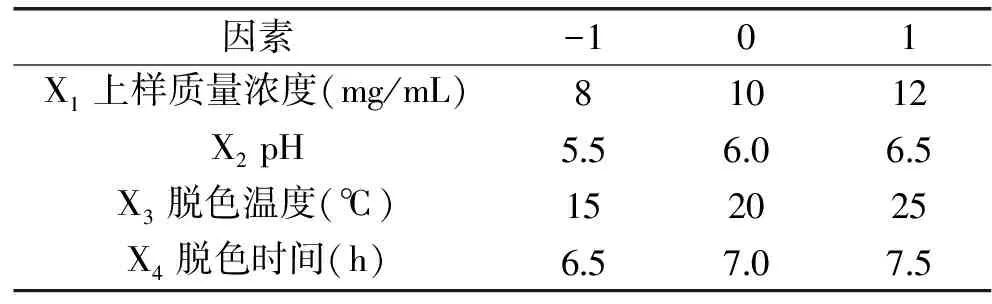
表1 大孔树脂对黄秋葵脱色工艺响应面因素水平表Table 1 Coded values of corresponding actual values of independent variables in response surface design
1. 2. 5 黄秋葵脱色多糖理化性质分析 将脱色前后的黄秋葵多糖冷冻干燥,观察外观,并研究其在蒸馏、无水乙醇、乙醚、丙酮、氯仿、正丁醇和三氯乙酸中的溶解性变化;用蒸馏水配成10mg/mL的溶液,测定考马斯亮蓝反应。
1. 2. 6 分析方法
1. 2. 6. 1 脱色率的测定及计算 溶液呈橙黄色,所以溶液主要吸收蓝色波段可见光,因此选择该波段中心的450nm波长为检测波长。计算公式为:
脱色率(%)=脱色前吸光度 - 脱色后吸光度/脱色前吸光度×100
1. 2. 6. 2 多糖及其保留率的测定 利用苯酚 - 硫酸法[13]测定黄秋葵多糖溶液脱色前后的多糖含量。计算公式为:

1. 2. 6. 3 蛋白质定性测定 采用考马斯亮蓝法[14]
2 结果与分析
2. 1 苯酚硫酸法测多糖标准曲线
根据曲线可得,回归方程为Y=0. 0059X - 0. 001,相关系数R2为0. 9992,说明方程99. 92%的变化来自变量,相关性良好,方程有效。
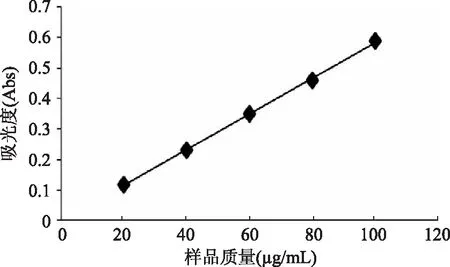
图1 苯酚 - 硫酸法测定多糖含量标准曲线Fig. 1 Standard curve of the content determination of polysaccharide withe phenol - sulfur cacid method
2. 2 单因素实验结果
2. 2. 1 上样质量浓度对脱色效果的影响 结果如图2所示,随着上样质量浓度的增加,脱色率呈降低趋势,在上样质量浓度为10 ~ 15mg/mL范围内脱色率已经降低到90%以下,这可能与大孔树脂与黄秋葵多糖色素的接触面饱和从而使大孔树脂的吸附能力降低有关;随着上样质量浓度的增加多糖保留率逐渐增加,在5 ~ 10mg/mL增长较为明显。综合考虑脱色率和多糖保留率,选择10mg/mL为黄秋葵多糖脱色的较适宜上样质量浓度。
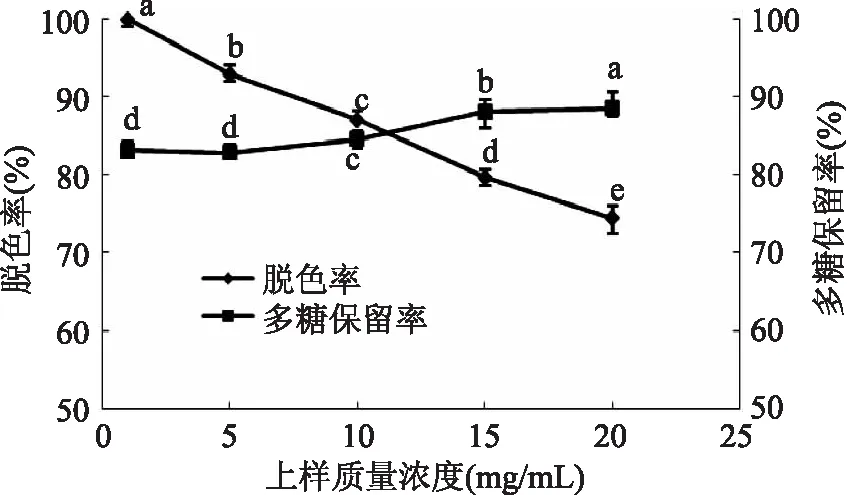
图2 上样质量浓度对脱色效果的影响Fig. 2 Effect of sample concentration on decolorization rate and polysaccharide retention rate注:不同字母上标代表数值间差异显著(p<0. 05),图3 ~ 图5同。
2. 2. 2 pH对脱色效果的影响 结果如图3所示,随着pH的增加,脱色率和多糖保留率呈先升高后降低的趋势。脱色率在酸性范围内较高,在碱性范围内脱色效果明显下降,在pH6附近最高,接近多糖溶液的自然pH。分析原因,在酸性条件下,黄秋葵多糖溶液中的色素表现为弱极性或非极性,从而减弱与大孔树脂的结合作用;在偏碱性条件下,某些色素分子性质可能发生改变,使得样品溶液颜色加深从而导致脱色效果不明显,脱色率降低。多糖保留率在酸性范围内随着pH的增大而升高,当pH大于7时开始降低。为获得较好的脱色效果,选择pH6为较适宜pH。
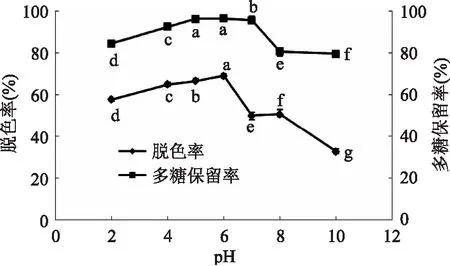
图3 pH对脱色效果的影响Fig. 3 Effect of pH value on decolorization rate and polysaccharide retention rate
2. 2. 3 脱色温度对脱色效果的影响 结果如图4所示,脱色温度对黄秋葵多糖脱色率整体上起促进作用,脱色率随着脱色温度的升高有显著提高,分析原因是色素分子扩散速度随温度的增加而加快,多糖溶液的黏度下降,从而有利于色素的吸附。温度对多糖保留率的影响较明显,随着脱色温度的升高多糖保留率明显降低,在脱色温度为20℃时多糖保留率为92. 15%,而在30℃时则下降到85. 17%。为了获得较高的脱色率和多糖保留率,并结合实际生产要求和条件,选择20℃为黄秋葵多糖脱色较为适宜的温度。
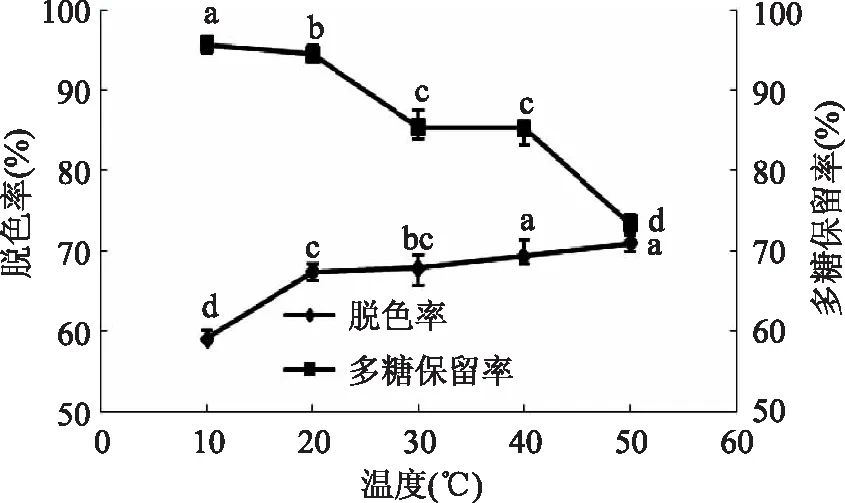
图4 温度对脱色效果的影响Fig. 4 Effect of temperature on decolorization rate and polysaccharide retention rate
2. 2. 4 脱色时间对脱色效果的影响 结果如图5所示,当脱色时间在7h以内时,随着脱色时间的延长,脱色率明显增加,脱色7h后,脱色率增加缓慢,脱色9h以后脱色率几乎不再变化,即脱色20h与脱色9h时的脱色率没有显著性差异,分析原因可能是色素的吸附和解吸已经达到了平衡。另一方面,多糖保留率随脱色时间的延长呈降低趋势,当脱色时间在0 ~ 9h之间时多糖保留率降低尤为明显。为了获得较高的脱色率并兼顾多糖保留率,选择7h为大孔树脂对黄秋葵多糖进行脱色的较适宜时长。
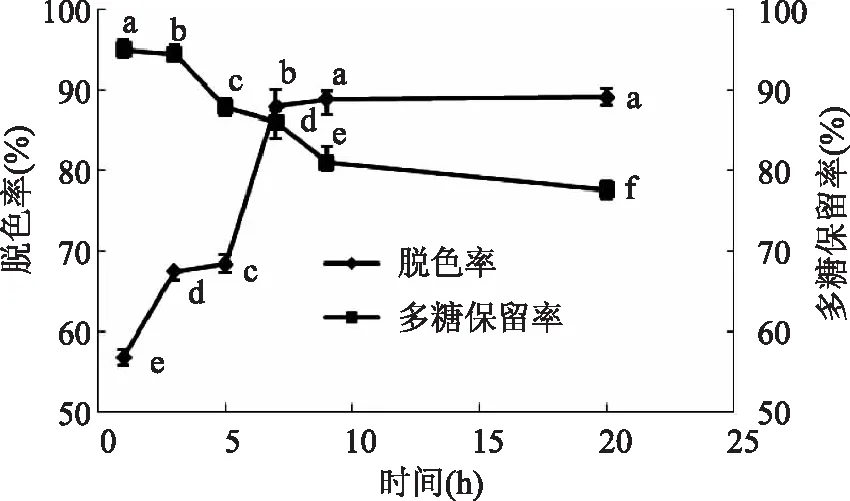
图5 时间对脱色效果的影响Fig. 5 Effect of time on decolorization rate and polysaccharide retention rate
2. 3 响应面法优化工艺条件
2. 3. 1 响应面结果 本实验共设计30个实验点,其中24个析因实验,6个中心实验,实验设计和实验结果见表2。利用Design - Expert 8. 0. 6软件对表2实验数据进行回归拟合,得到以脱色率(Y1)和多糖保留率(Y2)为响应值的二次多项回归方程为:
Y1=91. 41 - 0. 47X1+0. 26X2+0. 022X3+0. 47X4-0. 075X1X2- 0. 51X1X3- 0. 24X1X4+0. 37X2X3- 0. 16X2X4+0. 15X3X4- 0. 52X12- 0. 74X22- 0. 29X32- 0. 34X42
Y2=85. 16+0. 076X1+0. 14X2- 0. 011X3- 0. 15X4+0. 12X1X2+0. 26X1X3+0. 04X1X4+0. 04X1X4- 0. 24X2X3- 0. 096X2X4+0. 26X3X4- 0. 63X12- 0. 55X22- 0. 57X32-0. 39X42
分别对大孔树脂脱色率和多糖保留率的回归模型及各参数的显著性进行验证,结果见表3和表4。由表3可得,脱色率为响应值的回归模型中,模型p值小于0. 0001为极显著,失拟项的p值为0. 5695>0. 05,对脱色率影响不显著,说明该模型的拟合度较好,可以利用该模型确定最佳工艺条件。其中R2为0. 9605,说明响应值(脱色率)有96. 05%的变化来自所选变量。模型的一次项X1和X4对脱色率影响极显著,X2影响显著,交互项X1X3影响极显著,X1X4和X2X3影响显著,二次项X12、X22和X42影响极显著,X32影响显著,其余均不显著,表明各影响因素对于脱色率的影响不是简单的线性关系。剔除影响不显著的各项,简化后的回归方程为:
Y1=91. 41 - 0. 47X1+0. 26X2+0. 47X4- 0. 51X1X3-0. 24X1X4+0. 37X2X3- 0. 52X12- 0. 74X22- 0. 29X32- 0. 34X42

表2 响应面实验设计及结果表Table 2 Experimental design for response surface analysis and corresponding experimental data
由表4可得,多糖保留率为响应值的回归模型中,p值小于0. 001为极显著,失拟项的p值为0. 4356>0. 05,对多糖保留率影响不显著,说明该模型的拟合度较好。可以利用该模型确定最佳工艺条件。其中R2为0. 9622,说明响应值(多糖保留率)有96. 22%的变化来自所选变量。模型一次项X2和X4对多糖保留率影响显著,交互项X1X3、X2X3和X3X4影响显著,二次项影响极显著,其余均不显著,表明各影响因素对多糖保留率的影响不是简单的线性关系。剔除影响不显著的各项,简化后的回归方程为:
Y2=85. 16+0. 14X2- 0. 15X4+0. 26X1X3- 0. 24X2X3+0. 26X3X4- 0. 63X12- 0. 55X22- 0. 57X32- 0. 39X42
2. 3. 3 两因素间的交互效应分析 由表3和表4可知,交互项X1X4对脱色率影响极显著,X1X3与X2X3对脱色率的影响显著;X1X3、X2X3以及X3X4对多糖保留率影响显著。利用Design Expert 8. 0. 6软件进行分析两两考察因素间交互作用的响应面3D图,如图6和图7所示,可直观地看出反应各因素和响应值及各考察因子之间的交互作用。响应面图全部开口向下,随着每个因素的编码值的增大,响应值增大,当响应值增大到极值后,又随着因素编码值的增大逐渐减少,从响应面的最高点和等高线可看出在所选的范围内存在极值,即该模型有稳定点,且稳定点是最大值。
如图6所示,脱色率随X1X3、X1X4以及X2X3的改变而改变,呈现出先增后减的趋势。根据响应面的陡峭程度可以看出上样浓度对脱色率的影响较脱色温度和脱色时间对其的影响较大。若要获得较高的脱色率,上样浓度应在7. 81 ~ 9. 97mg/mL范围,pH在5. 8 ~ 6. 2范围内,脱色温度应在17. 86 ~ 25. 56℃范围,脱色时间在6. 8 ~ 7. 6h范围。

图6 因素交互影响脱色率的响应面图Fig. 6 Response surfaces of the pairwise interactive effects of two decolorization conditions on decolorization rate
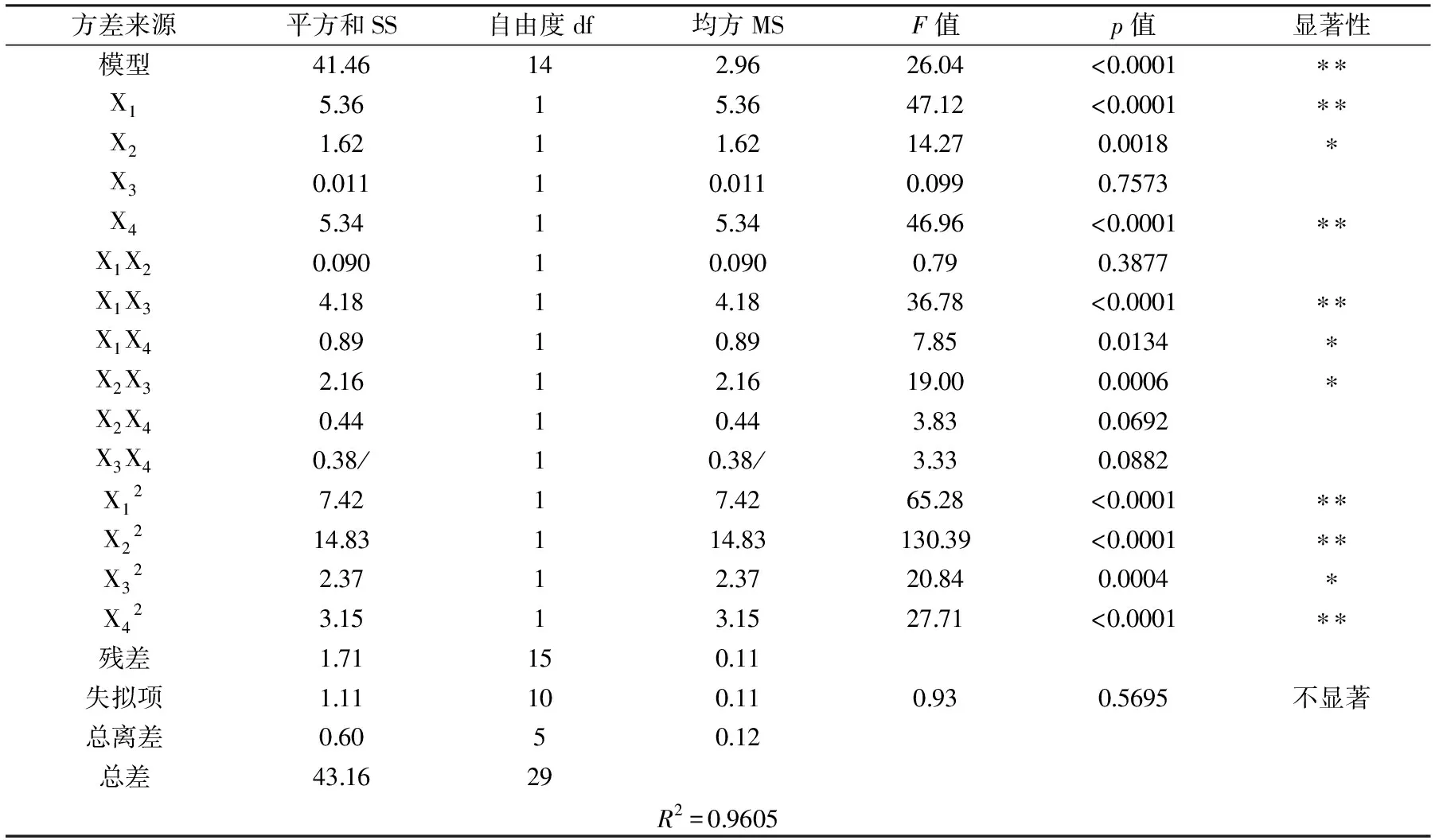
表3 脱色率为响应值回归模型方差分析表Table 3 Analysis of variance table
注:p值小于0. 05,表示对应因素对响应值的影响显著,用*表示;小于0. 01为极显著,用* *表示,表4同。

表4 多糖保留率为响应值回归模型方差分析表Table 4 Analysis of variance table
如图7所示,多糖保留率随X1X3、X1X4以及X2X3的改变而改变,呈先增后减的趋势。若要获得较高的多糖保留率,上样质量浓度应该控制在9 ~ 11mg/mL之间,pH应控制在5. 82 ~ 6. 25之间,脱色温度应控制在22. 72 ~ 18. 37℃之间,脱色时间应控制在6. 8 ~ 7. 2h之间。
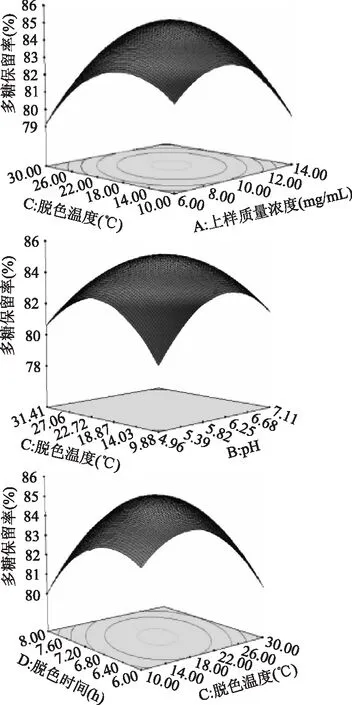
图7 因素交互影响多糖保留率的响应面图Fig. 7 Response surfaces of the pairwise interactive effects of two decolorization conditions on polysaccharide retention
2. 3. 4 最佳条件优化及验证结果 通过所得回归模型对脱色工艺进行优化,得到最佳脱色工艺条件为上样质量浓度9. 74mg/mL、pH6. 07、脱色温度20. 23℃、脱色时间7. 07h,在此条件下脱色率的最大理论值为91. 56%,多糖保留率的最大理论值为85. 11%。考虑实际操作情况,确定大孔树脂HP - 20对黄秋葵多糖的最佳脱色工艺为上样质量浓度9. 8mg/mL、脱色pH为6、脱色温度20℃、脱色时间7h。对此优化条件进行验证,重复3次,平均脱色率为91. 07%,平均多糖保留率为85. 52%,表明该回归模型具有较好的预测性能,可用于指导实际生产。
2. 4 最佳工艺参数下获得脱色黄秋葵多糖理化性质分析
将最佳脱色工艺下获得的多糖溶液冷冻干燥,进行理化性质分析,结果见表5。脱色前后多糖固体由橙黄色变为乳白色,溶解性没有发生变化;考马斯亮蓝反应由脱色前的阳性变为脱色后的阴性,说明大孔树脂具有去除蛋白、纯化样品的作用。由此说明,大孔树脂HP - 20对黄秋葵多糖的脱色效果较好,没有改变其基本性质,为黄秋葵多糖进一步分离纯化提供参考。
3 结论及讨论
本研究以脱色率和多糖保留率为指标,通过探究上样质量浓度、脱色pH、脱色温度及脱色时间在大孔树脂HP - 20对黄秋葵多糖脱色效果中的影响,获得最优脱色工艺参数。通过单因素实验确定响应因素,由中心组合实验获得大孔树脂HP - 20对黄秋葵多糖的脱色率(Y1)和多糖保留率(Y2)分别与上样质量浓度(X1)、pH(X2)、脱色温度(X3)和脱色时间(X4)的回归方程:
Y1=91. 41 - 0. 47X1+0. 26X2+0. 47X4- 0. 51X1X3-0. 24X1X4+0. 37X2X3- 0. 52X12- 0. 74X22- 0. 29X32- 0. 34X42
Y2=85. 16+0. 14X2- 0. 15X4+0. 26X1X3- 0. 24X2X3+0. 26X3X4- 0. 63X12- 0. 55X22- 0. 57X32- 0. 39X42
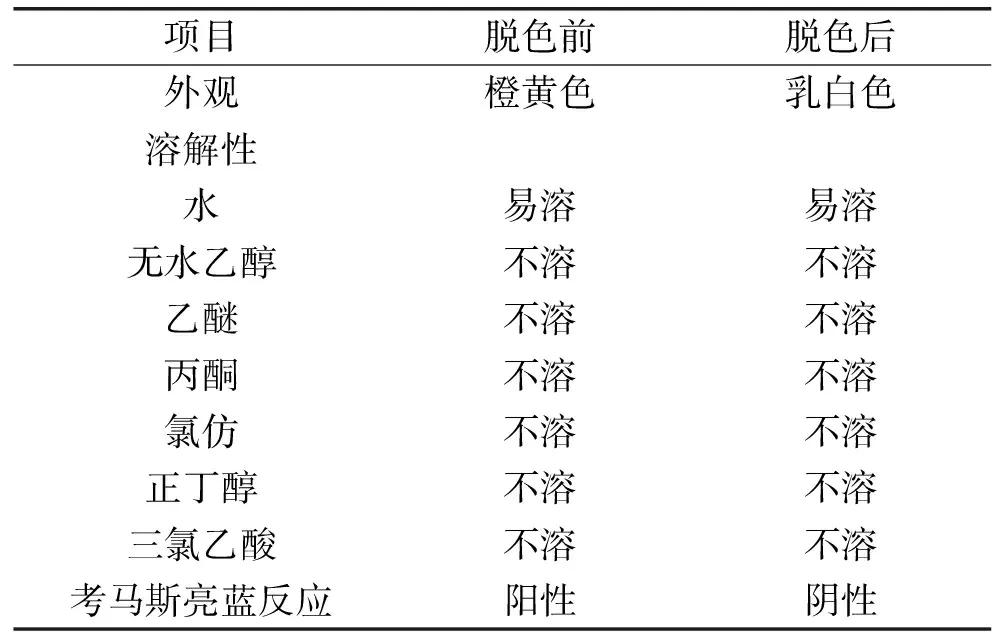
表5 黄秋葵多糖脱色前后理化性质Table 5 The table of physical and chemical properties of okra polysaccharide before and after decoloring
两个方程的拟合度较好,可信度也较高。通过所得回归模型对脱色工艺进行优化,确定大孔树脂HP - 20对黄秋葵多糖的最佳脱色工艺为上样质量浓度9. 8mg/mL、脱色pH为6、脱色温度20℃、脱色时长7h。对此优化条件进行验证,重复3次,平均脱色率为91. 07%,平均多糖保留率为85. 52%,表明该回归模型具有较好的预测性能,可用于指导实际生产。
大孔树脂对色素物质的吸附,反应条件温和,避免了传统脱色工艺化学反应对需保留物质的破坏。目前,大孔树脂脱色工艺已大量应用于研究中,夏玮等[15]通过比较发现大孔树脂AB - 8树脂对桑叶多糖的脱色效果最佳,脱色率达82%,多糖保留率可达83%;张强华等[16]通过比较获得大孔树脂D941对甜叶菊糖苷溶液的脱色效果较好,脱色率在90%左右;罗玺等[17]研究表明大孔树脂D303对灵芝多糖的脱色效果最好,脱色率可达91. 89%,多糖保留率75. 28%;本实验通过大孔树脂HP - 20对黄秋葵多糖溶液进行处理也获得较理想的脱色效果。在生产实践中,一些企业也开始用大孔树脂对样品进行脱色处理,改善产品外观,提高有效成分含量。
本实验利用大孔树脂对黄秋葵多糖溶液进行脱色处理,降低了色素含量,改善了其外观,同时提高了黄秋葵多糖的纯度;用响应面法进行了脱色工艺的优化,获得了脱色最佳工艺参数,对黄秋葵多糖的进一步研究和产品的开发有所助益。
[1]李建华,陈珊. 黄秋葵水提取液抗疲劳的药效学观察[J]. 中国运动医学杂志,2004,23(2):196 - 197.
[2]Tongjaroenbuangam W,Ruksee N,Chantiratikul P,etal. Neuroprotective effects of quercetin,rutin and okra(AbelmoschusesculentusLinn. )in dexamethasone - treated mice[J]. Neurochemistry International,2011,59(5):677 - 685.
[3]Sheu S C,Lai M H. Composition analysis and immuno -modulatory effect of okra(AbelmoschusesculentusL. )extract[J]. Food Chemistry,2012,134(4):1906 - 1911.
[4]Adelakun O E,Oyelade O J,Ade - omowaye B I O,etal. Influence of pre - treatment on yield chemical and antioxidant properties of a Nigerian okra seed(Abelmoschusesculentusmoench)flour[J]. Food and Chemical Toxicology,2009,47(3):657 - 661.
[5]赵焕焕. 黄秋葵多糖提取纯化及体外抗氧化活性的探讨[D]. 郑州:郑州大学,2012.
[6]陈艳珍,宋新华. 黄秋葵粉对衰老小鼠抗疲劳和免疫功能的影响[J]. 食品研究与开发,2012,33(10):170 - 172.
[7]任丹丹. 黄秋葵多糖提取纯化及体外结合胆酸能力和抑制肿瘤活性分析[D]. 广州:华南理工大学,2012.
[8]任丹丹,陈谷. 响应面法优化黄秋葵多糖超声提取工艺[J]. 食品科学,2011,32(8):143 - 146.
[9]袁红波,张劲松,贾薇,等. 利用大孔树脂对低分子量灵芝多糖脱色的研究[J]. 食品工业科技,2009,30(3):204 - 206.
[10]王一敏,任晓蕾. 大孔树脂的应用研究[J]. 中医药信息,2008,25(4):26 - 28.
[11]李淑珍,李进,杨志江,等. 大孔树脂分离纯化黑果构祀总黄酮的研究[J]. 食品科学,2009,30(1):19 - 24.
[12]廖海兵. 黄秋葵功效成分纯化鉴定及其在不同品种间的差异研究[D]. 杭州:浙江农林大学,2012.
[13]张惟杰. 糖复合物生化研究技术[M]. 杭州:浙江大学出版社,1999:10 - 12.
[14]董娜,贾艳菊,张晓. 考马斯亮蓝法测定奶粉真蛋白的研究[J]. 食品科技,2011,36(11):272 - 278.
[15]夏玮,吕庆,张文清,等. 大孔吸附树脂脱色桑叶多糖的研究[J]. 食品与发酵工业,2007,33(2):141 - 144.
[16]张强华,熊清平,石莹莹. 大孔树脂对甜叶菊糖苷的脱色研究[J]. 食品工业科技,2011,32(5):249 - 252.
[17]罗玺,唐庆九,张劲松,等. 灵芝多糖树脂法脱色工艺优化[J]. 食品科学,2011,32(16):5 - 10.

