大豆抗原蛋白Glycinin对鲤稚鱼和幼鱼肠道组织的影响
吴莉芳,邢秀苹,赖红娥,杨欢欢,秦贵信,杨 婳
(1 吉林农业大学 动物科技学院,吉林 长春 130118;2 厦门利洋水产科技有限公司,福建 厦门 361012)
大豆抗原蛋白是指大豆及其制品中可引起人和动物产生过敏反应的一些大分子蛋白质或糖蛋白。主要包括大豆疏水蛋白、大豆壳蛋白、大豆抑制蛋白、大豆空泡蛋白、大豆球蛋白、伴大豆球蛋白、2S白蛋白等[1]。早在1934年,Duke提出大豆蛋白对人具有致敏性,通常表现为颤抖、咽喉水肿、皮疹和急性哮喘等症状[2]。随后,学者们发现含有大豆及大豆制品的日粮可导致鼠[3]、犊牛[4]、仔猪[5]等幼龄动物发生过敏反应,引起小肠绒毛萎缩、脱落,隐窝细胞增生,进而导致消化吸收障碍、生长受阻和过敏性腹泻等。另外,研究发现,大豆蛋白能够破坏虹鳟(Oncorhynchusmykiss)[6-9]等鱼类肠道形态结构和肠细胞结构,并且使其发生病理性变化。这些现象被归因于大豆蛋白中含有的抗原蛋白。随着大豆及其制品在人类食品和动物饲料中的广泛应用,由大豆所致的过敏现象引起了营养学家的密切关注。大豆球蛋白(Glycinin)是免疫原性较强的大豆抗原蛋白,能够引起鱼类消化道过敏反应,造成胃、肠道的免疫损伤,进而引起消化吸收障碍,甚至死亡。鲤鱼(Cyprinuscarpio)是我国目前主要养殖的淡水经济鱼类之一。张锦秀等[10]研究了去皮豆粕对幼建鲤生长性能和肠道的影响。郭林英[11]利用大豆β-伴球蛋白提取物对鲤肠上皮细胞增殖及其功能的影响进行了研究。目前,关于大豆抗原蛋白Glycinin对鲤鱼不同发育时期肠道组织的影响,尚未见系统报道。为此,本研究分别以鲤稚鱼和幼鱼为试验对象,将分离纯化的大豆抗原蛋白Glycinin以不同比例添加在其配合饲料中,探讨大豆抗原蛋白Glycinin对不同发育时期鲤鱼肠道组织的影响,旨在为合理开发利用大豆蛋白源及大豆抗原蛋白的去除提供依据。
1 材料与方法
1.1 大豆抗原蛋白Glycinin的获得
本试验在鲤稚鱼和幼鱼配合饲料中添加的大豆抗原蛋白Glycinin是在实验室采用简化膜中间试验方法[12]获得。较好地去除了大豆中其他抗原蛋白的干扰,Glycinin的纯度达到85%以上。
1.2 饲料的制备
试验饲料以鱼粉为动物蛋白源,混合油脂(m(玉米油)∶m(鱼油)=1∶1)为脂肪源,糊精、面粉作为饲料糖源,分别配制Ⅰ~Ⅴ5组等氮(鲤稚鱼和幼鱼饲料粗蛋白含量分别约为400和360 g/kg)等能(总能分别约为16.9和15.2 MJ/kg)试验饲料,其Glycinin的添加梯度分别为0(对照),30,60,90和120 g/kg。将各原料粉碎过孔径0.246 mm的筛,按配方准确称其质量,用电动绞肉机制成粒径1.5和2.5 mm颗粒饲料。晒干后置于-20 ℃冰箱中保存备用。鲤稚鱼、幼鱼试验饲料组成及营养成分见表1和表2。
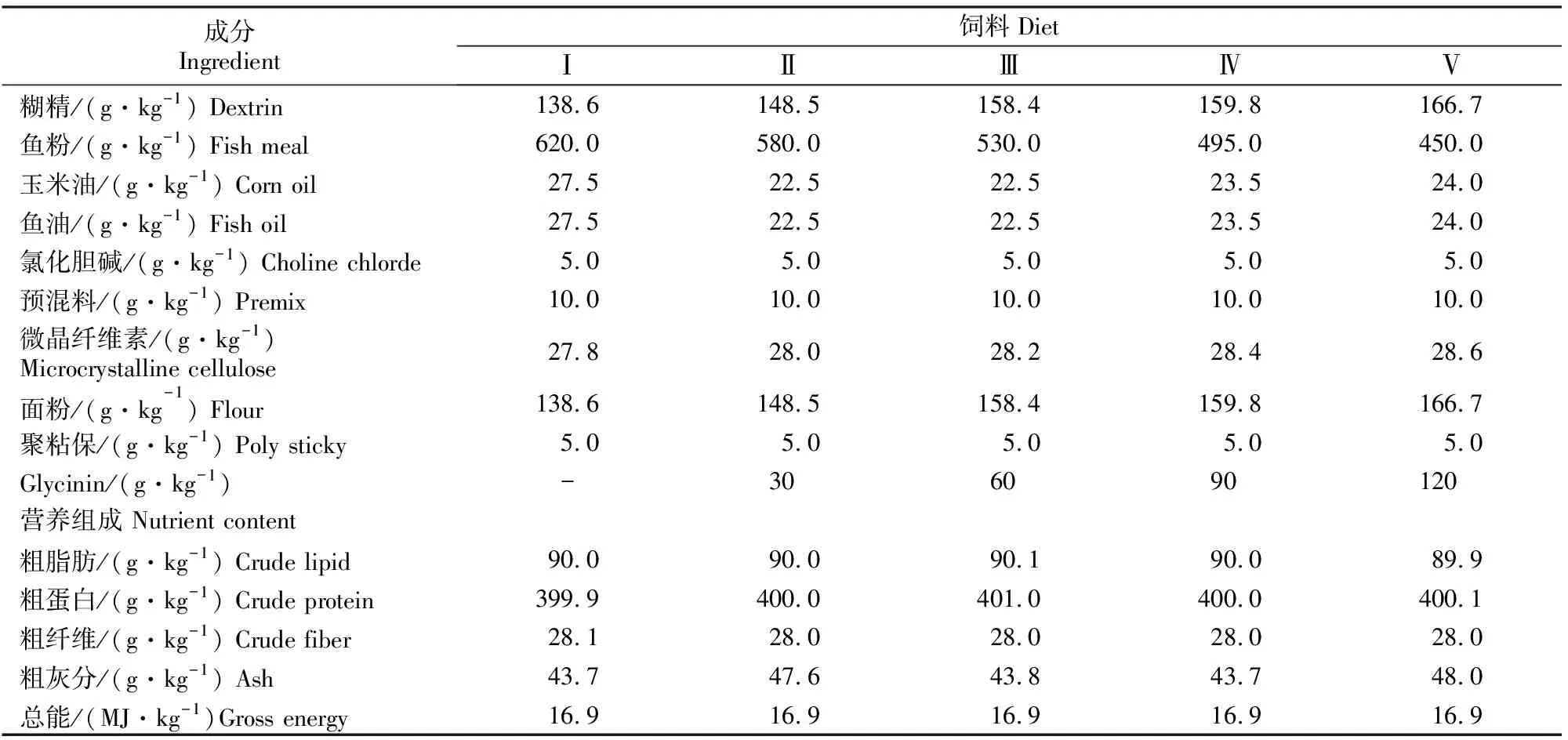
表1 鲤稚鱼饲料配方及营养水平(风干基础)
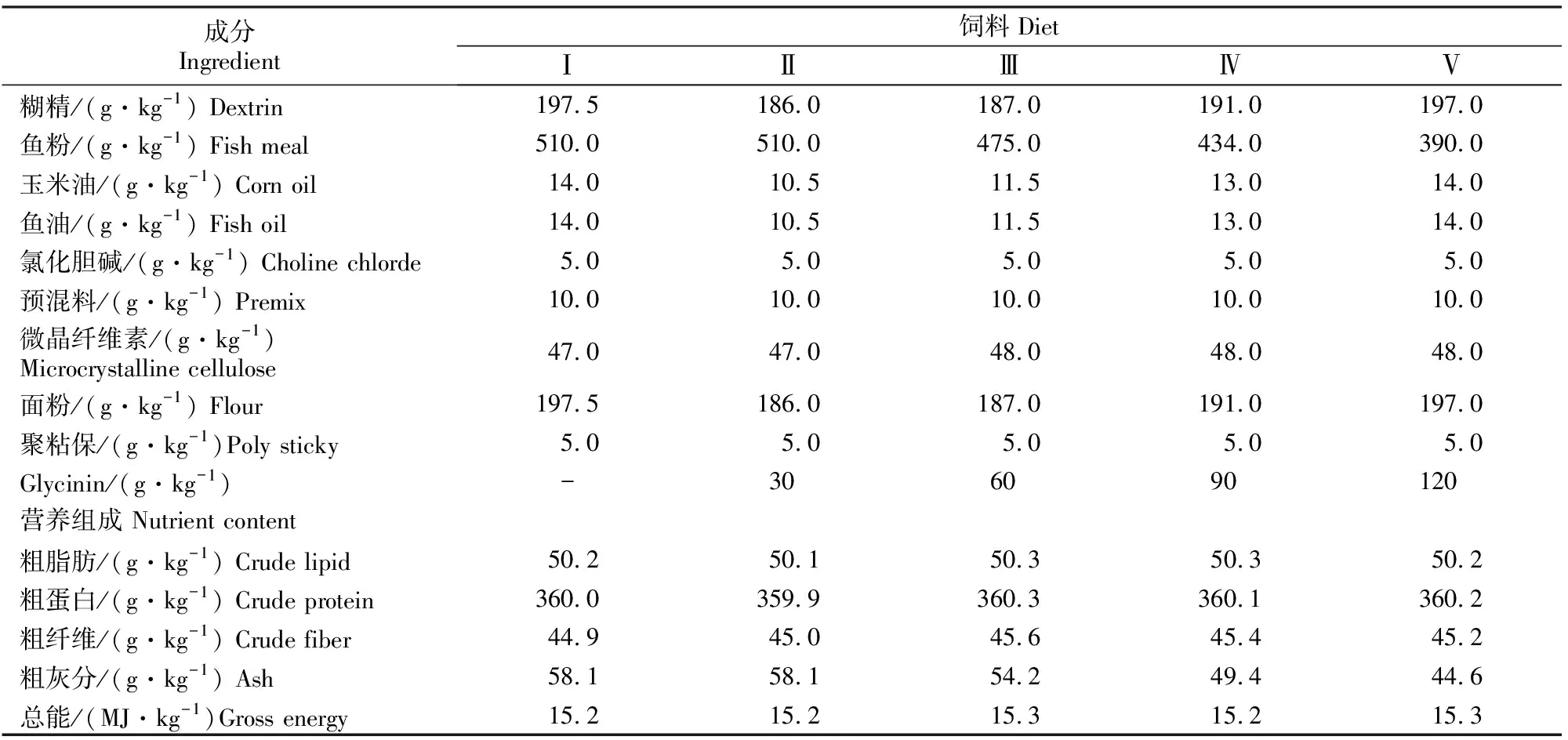
表2 鲤幼鱼饲料配方及营养水平(风干基础)
1.3 试验鱼及饲养管理
本次饲养试验在吉林农业大学动物室控温单循环系统中进行,试验前预饲15 d,饱食投喂对照组饲料,预饲试验结束后挑选规格整齐、鳍鳞完整、体质健壮、无畸形,体质量(10.12±0.08) g的鲤稚鱼450尾、体质量(116.89±0.13) g的鲤幼鱼300尾,分别随机放养在15个水族箱中(鲤稚鱼每箱30尾,鲤幼鱼每箱20尾)。放养前用20 mg/L高锰酸钾水溶液药浴10 min,随机选择3个水族箱作为一个试验组。每天投饵2次(上午09:00,下午16:00),投饵方式为人工手撒,日投饵率为鱼体质量的3%~5%,每天记录每个水族箱摄食饲料质量。在整个试验过程中,水质保持稳定,水温24~26 ℃,溶解氧5.0~8.0 mg/L,氨氮指标小于0.3 mg/L,养殖试验持续8周。
1.4 样品的采集与切片的制作
饲养试验结束前停食24 h后,从每个处理组随机取鱼30尾,测量体长、终末体质量、肠长、肠质量,另从每缸随机取鱼3尾,活体解剖,观察肠道形态,去除肠道脂肪,用6.5 g/L生理盐水冲洗肠道内容物,迅速取前肠、中肠、后肠1.0 cm×1.0 cm组织,钉在标记好的小纸片上,快速用体积分数4%的中性甲醛固定液固定肠段。按常规组织切片制备程序进行修块与冲洗、脱水与透明、透蜡、包埋、切片和H-E染色,细胞核被苏木精染成蓝色,细胞质被伊红染成粉红色,进行肠道微观形态结构观察和皱襞高度测量。使用Olympus摄影显微镜进行图像采集,用Image-pro Plus 5.02软件对各鱼种前肠、中肠、后肠的皱襞高度进行测量。肠道指标计算公式如下:肠体指数=肠质量/体质量,肠长指数=肠长/体长。
1.5 数据处理与分析
试验数据用“平均值±标准差(Mean±SD)”表示。采用SPSS (17.5)软件对所有指标进行方差分析,若方差分析显著,进一步进行LSD和Duncan’s多重比较,分析组间差异显著性。显著性水平设定为P<0.05。
2 结果与分析
2.1 大豆抗原蛋白Glycinin对鲤稚鱼和幼鱼肠道组织的影响
大豆抗原蛋白Glycinin对鲤稚鱼和幼鱼肠道组织的影响见表3和表4。
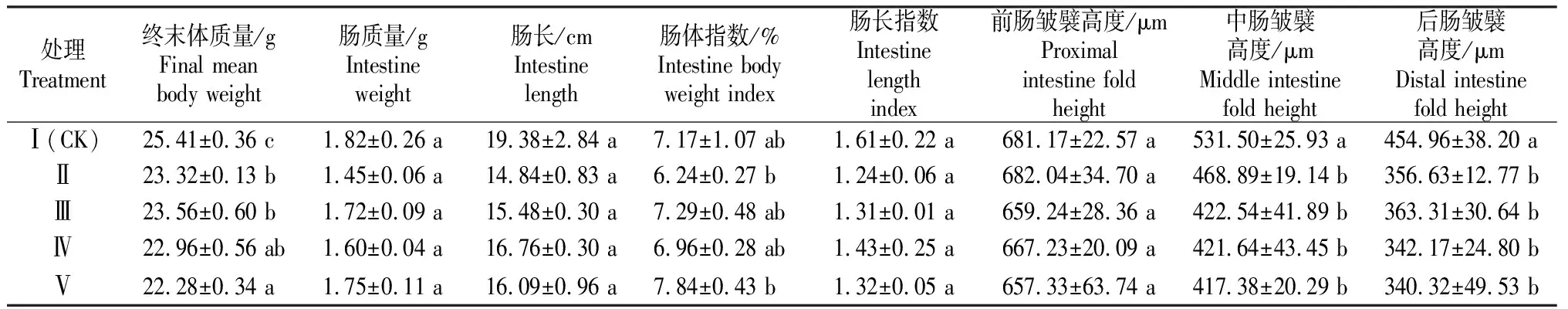
表3 大豆抗原蛋白Glycinin对鲤稚鱼肠道组织的影响
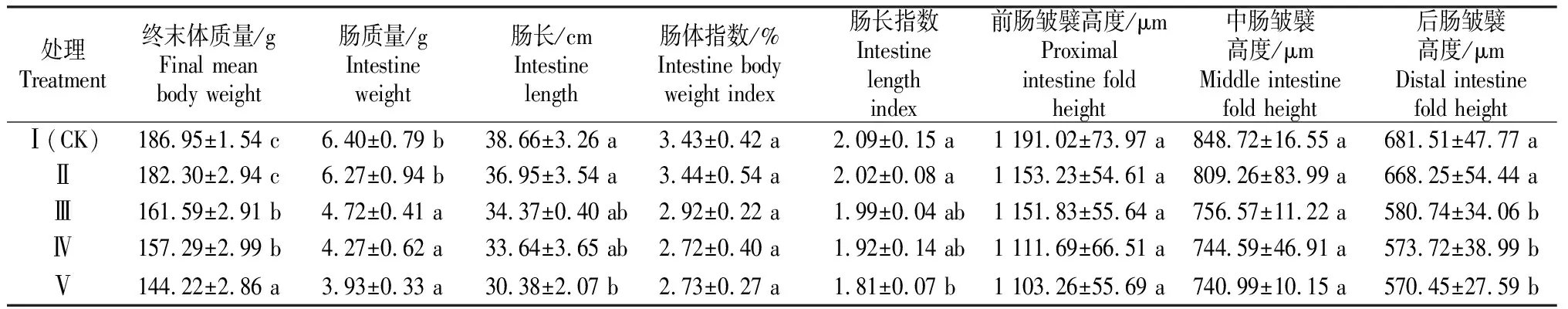
表4 大豆抗原蛋白Glycinin对鲤幼鱼肠道组织的影响
由表3可知,在本试验条件下,大豆抗原蛋白Glycinin的添加量为30,60,90和120 g/kg组(Ⅱ,Ⅲ,Ⅳ,Ⅴ组)鲤稚鱼终末体质量、中肠和后肠皱襞高度显著低于对照组(Ⅰ组)(P<0.05),而前肠皱襞高度、肠质量、肠长、肠体指数和肠长指数在各组之间差异不显著(P>0.05)。
表4表明,随着大豆抗原蛋白Glycinin添加量的增加,鲤幼鱼前肠、中肠和后肠皱襞高度呈下降趋势。大豆抗原蛋白Glycinin的添加量为60,90和120 g/kg组(Ⅲ,Ⅳ,Ⅴ组)鲤幼鱼终末体质量、后肠皱襞高度、肠质量显著低于对照组(P<0.05);而Glycinin的添加量为120 g/kg组的肠长和肠长指数显著低于对照组(P<0.05);肠体指数、前肠和中肠皱襞高度在各组间差异不显著(P>0.05)。
2.2 大豆抗原蛋白Glycinin对鲤稚鱼和幼鱼肠道形态的影响
由图1可知,对照组鲤稚鱼肠道绒毛和纹状缘排列整齐,黏膜下层较薄并且肌层较厚,皱襞间质较窄。30 g/kg Glycinin添加组鲤稚鱼肠道形态与对照组没有明显差异;60 g/kg Glycinin添加组鲤稚鱼肠绒毛开始出现局部断裂或破损;90和120 g/kg Glycinin添加组鲤稚鱼肠道组织形态进一步被破坏,中肠和后肠受到Glycinin的影响较严重。
图2表明,对照组鲤幼鱼肠道绒毛和纹状缘排列整齐,黏膜下层较薄并且肌层较厚,皱襞间质较窄。30 g/kg Glycinin添加组鲤幼鱼肠道组织形态受到Glycinin的影响不明显;60 g/kg Glycinin添加组鲤幼鱼肌层开始出现变薄的现象;90和120 g/kg Glycinin添加组鲤幼鱼肠道形态受到Glycinin的影响较明显,绒毛出现断裂或者缺失。
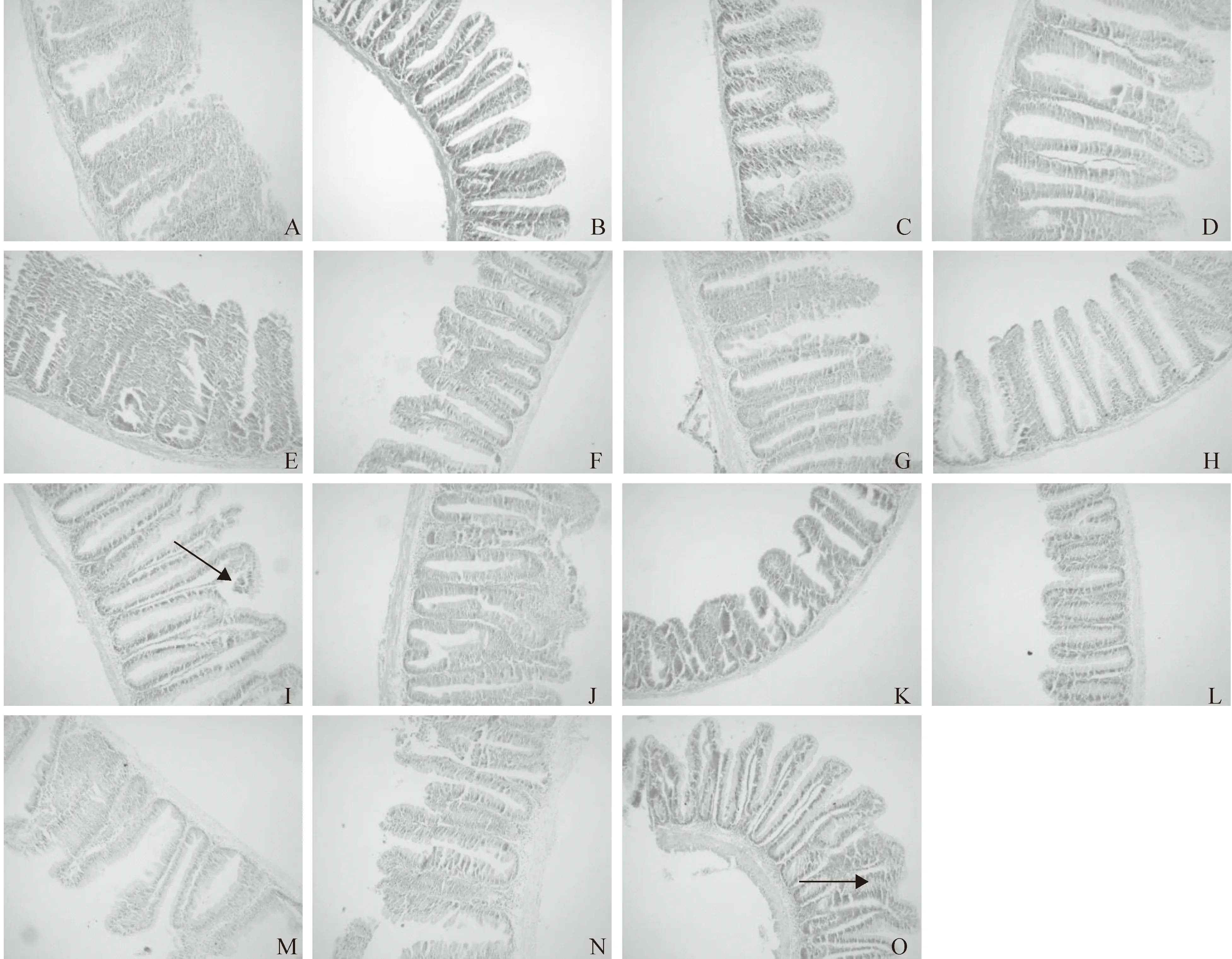
图1 大豆抗原蛋白Glycinin对鲤稚鱼肠道形态的影响(100×)
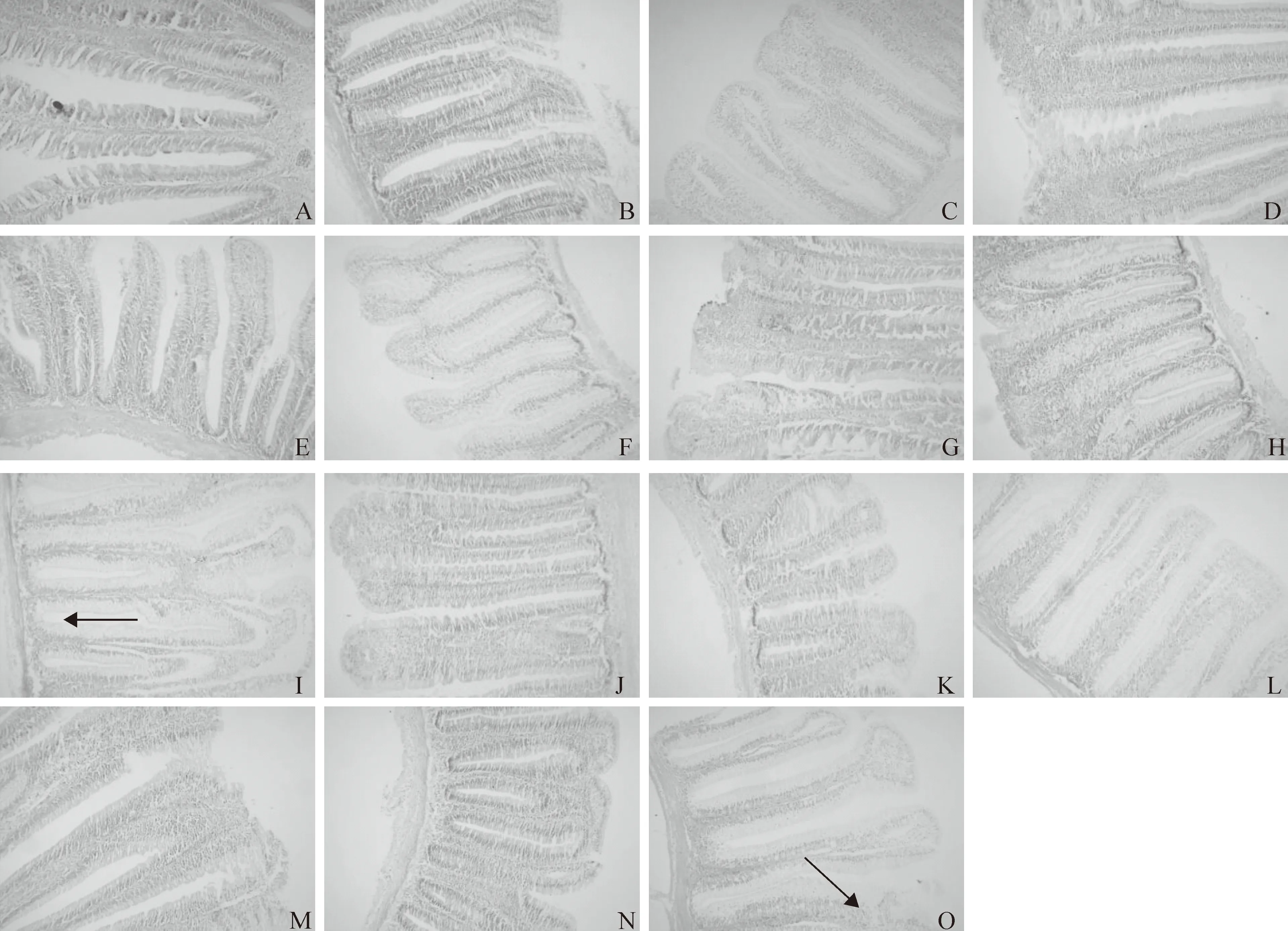
图2 大豆抗原蛋白Glycinin对鲤幼鱼肠道形态的影响(100×)
3 讨 论
3.1 大豆抗原蛋白Glycinin对鲤稚鱼和幼鱼肠道皱襞高度的影响
鱼类的肠道是消化吸收营养物质的主要场所,也是鱼类最大的黏膜免疫器官和最脆弱的免疫屏障。肠道通常是鱼类感染疾病的主要途径之一。肠道黏膜形态结构正常是营养物质消化吸收和动物正常生长的生理基础, 肠道皱襞高度降低意味着肠道的吸收面积减小,对营养物质的吸收能力降低。在本试验条件下,大豆抗原蛋白Glycinin的添加量为30,60,90和120 g/kg组鲤稚鱼中肠和后肠皱襞高度显著低于对照组(P<0.05);大豆抗原蛋白Glycinin的添加量为60,90和120 g/kg组的鲤幼鱼后肠皱襞高度显著低于对照组(P<0.05)。关于大豆抗原蛋白Glycinin对鱼类肠道皱襞高度的影响,国内外鲜有报道,大多数研究针对大豆蛋白源。张锦秀等[10]研究报道,当饲料中去皮豆粕(DSBM)替代50%鱼粉蛋白后,幼建鲤前肠和后肠的皱襞高度下降。Baeverfjord等[13]研究报道,与对照组鱼粉相比,豆粕引起大西洋鲑(Salmosalar)后肠单褶皱襞高度下降了44.3%,复合褶皱襞高度下降了21.7%。Van den Ingh等[14]对长期饲喂含全脂大豆(FFSB)和大豆蛋白浓缩物(SBPC)的大西洋鲑的前肠和后肠形态进行了研究,发现FFSB组大西洋鲑后肠上皮的微绒毛缩短,前肠形态与对照组差异不显著;而SBPC组大西洋鲑前肠和后肠形态与对照组相比均无明显异常。孙泽威等[15]报道了大豆抗原蛋白引起犊牛生长性能和肠道吸收能力下降。本研究中,添加Glycinin后,鲤稚鱼和幼鱼前、中、后肠皱襞高度总体呈下降趋势,这主要是由于鲤稚鱼消化和免疫器官不发达,消化系统发育尚不成熟,消化机能不完善,正常的肠道微生态系统尚未建立,使大量未消化的营养物质流入肠道。因此,大豆抗原蛋白也可大量进入肠道,在获得免疫耐受力之前,经过一段过敏时期,引起肠道的损伤。
3.2 大豆抗原蛋白Glycinin对鲤稚鱼和幼鱼肠道形态的影响
鱼类肠道是消化吸收的重要器官,具有容纳、推进、消化饲料以及吸收营养物质和免疫等功能。Rumsey等[6]利用ELISA法检测饲料中Glycinin和β-Conglycinin含量分别是58.8和34.4 mg/g时,其均可破坏虹鳟前肠和后肠上皮结构及细胞结构。Li 等[16]研究发现,Glycinin和β-Conglycinin 能引起仔猪、犊牛等动物的肠道过敏,造成肠道损伤、绒毛萎缩、腺窝增生、肠道消化吸收能力下降。Urán等[17]在鲤鱼饲料中添加20%的豆粕替代动物蛋白,1周后鲤鱼肠道的大部分指标发生变化,3周后炎症反应加剧,在第4~5周时鲤鱼肠道开始恢复,核上空泡增加,大部分的指标恢复正常。Krogdahl等[18]、Refstie等[19]、Ksudhik等[20]分别在大西洋鲑、虹鳟、欧洲真鲈(Dicentearchuslabrax)的饲料中添加一定量的大豆蛋白,发现大豆蛋白使鱼后肠绒毛上皮结构发生形态变化,黏膜褶缩短。本研究通过对鲤稚鱼和幼鱼肠道微观结构的观察发现,在本试验条件下,大豆抗原蛋白Glycinin的添加量为60 g/kg时,鲤稚鱼肠绒毛开始出现局部断裂或破损;当Glycinin添加量为90和120 g/kg时,鲤稚鱼肠道组织形态进一步被破坏,中肠和后肠受到Glycinin的影响较严重。当Glycinin添加量为60 g/kg时,鲤幼鱼肌层开始出现变薄的现象;当Glycinin添加量为90和120 g/kg时,鲤幼鱼肠道绒毛出现断裂或者缺失。这主要是由于鱼类摄食含有大豆抗原蛋白Glycinin的饲料后,大部分Glycinin被降解为肽和氨基酸。然而由于稚鱼和幼鱼肠道黏膜屏障发育不成熟,大豆抗原蛋白Glycinin以完整的大分子形式穿过小肠上皮细胞间或上皮细胞内的空隙从而完整地进入血液和淋巴。这些具有抗原活性的大分子物质刺激机体产生免疫反应,引起肠道绒毛萎缩,从而使肠道形态结构发生变化。
[参考文献]
[1] L’Hocine L,Boye J I.Allergenicity of soybean:New developments in identification of allergenic proteins,cross-reactivities and hypoallergenization technologies [J].Critical Reviews in Food Science and Nutrition,2007,47:127-143.
[2] Moneret-Vautrin D A,Morisset M,Flabbee J,et al.Epidemiology of life-threatening and lethal anaphylaxis:A review [J].Allergy,2005,60:443-451.
[3] Mowat A M,Ferguson A.Hypersensitivity in the small intestinal mucosa:Ⅴ.Induction of cell-mediated immunity to a dietary antigen [J].Clinical & Experimental Immunology,1981,43(3):574-582.
[4] Dawson D P,Morrill J L,Reddy P G,et al.Soybean protein concentrate and heated soy flours and as protein sources in milk replacer for preruminant calves [J].Journal of Dairy Science,1988,71(5):1301-1309.
[5] Li D F,Nelssen J L,Reddy P G,et al.Transient hypersensitivity to soybean meal in the early-weaned pig [J].Journal of Animal Science,1990,68(6):1790-1799.
[6] Rumsey G L,Siwicki A K,Anderson D P,et al.Effect of soybean protein on serological response,non-specific defense mechanisms, growth,and protein utilization in rainbow trout [J].Veterinary Immunology and Immunopathology,1994(41):323-329.
[7] Refstie S,Korsφenφ J,Storebakken T,et al.Differing nutrition-al responses to dietary soybean meal in rainbow trout (Oncorhynchusmykiss) and Atlantic salmon (Salmosalar) [J].Aquaculture,2000,190:49-63.
[8] Romarheim O H,Skrede A,Gao Y L,et al.Comparison of wh-ite flakes and toasted soybean meal partly replacing fish meal as protein source in extruded feed for rainbow trout (Oncorhynchusmykiss) [J].Aquaculture,2006,256:354-364.
[9] Odd Helge H,Anders S,Michael P,et al.Lipid digestibility,bile drainage and development of morphological intestinal changes in rainbow trout (Oncorhynchusmykiss) fed diets containing defatted soybean meal [J].Aquaculture,2008,274:329-338.
[10] 张锦秀,周小秋,刘 扬.去皮豆粕对幼建鲤生长性能和肠道的影响 [J].中国水产科学,2007,14(2):315-320.
Zhang J X,Zhou X Q,Liu Y.Effects of dehulled soybean meal on growth performance and intestine of juvenileCyprinuscarpiovar.jian [J].Journal of Fishery Sciences of China,2007,14(2):315- 320.(in Chinese)
[11] 郭林英.大豆β-伴球蛋白提取物对鲤鱼肠上皮细胞增殖及其功能的影响 [D].四川雅安:四川农业大学,2006.
Guo L Y.Effects of soybean β-conglycinin extract on the proliferation and function of carp intestinal-epithelial cells in primary culture [D].Ya’an,Sichuan:Sichuan Agricultural University,2006.(in Chinese)
[12] Wu S W,Murphy P A,Johnson L A,et al.Simplified process for soybean glycinin and β-conglycinin fractionation [J].Journal of Agricultural and Food Chemistry,2000,48:2702-2708.
[13] Baeverfjord G,Krogdahl.Development and regression of soybean meal induced enteritis in Atlantic salmon,SalmosalarL.distal intestine:A comparison with the intestines of fasted fish [J].Fish Dis,1996(19):375-387.
[14] Van den Ingh T S G,Krogdahl A M A,Olli J J,et al.Effects of soybean-containing diets on the proximal and distal intestine in Atlantic salmon (Salmosalar):A morphological study [J].Aquaculture,1991,94:297-305.
[15] 孙泽威,秦贵信,张庆华.大豆抗原蛋白对犊牛生长性能、日粮养分消化率和肠道吸收能力的影响 [J].中国畜牧杂志,2005,41(11):30-33.
Sun Z W,Qin G X,Zhang Q H.Effect of soybean antigen on growth performance,nutrient digestibility and absorption ability of gut in calf [J].Chinese Journal of Animal Science,2005,41(11):30-33.(in Chinese)
[16] Li D F,Nelssen J L,Reddy P G,et al.Interrelationship between hypersensitivity to soybean proteins and growth performance in early weaned pigs [J].Journal of Animal Science,1991,69:4602-4609.
[17] Urán P A,Goncalves A A,Taverne-Thiele J J,et al.Soybean meal induces intestinal inflammation in common carp (CyprinuscarpioL.) [J].Aquaculture,2008,25:751-760.
[18] Krogdahl A,Bakke-mckellep A M,Baeverfjord G.Effects of graded levels of standard soybean meal on intestinal structure mucosal enzyme activities,and pancreatic response in Atlantic salmon (SalmosalarL.) [J].Aquaculture Nutrition,2003,9:361-371.
[19] Refstie S,Storebakken T,Baeverfjord G,et al.Long-term protein and lipid growth of Atlantic salmon (Satmosalar) fed diets with partial replacement of fish meal by soy protein products at medium or high lipid level [J].Aquaculture,2001,193:91-106.
[20] Ksudhik S J,Coves D,Dutto G.Almost total replacement of fish meal by plant protein sources in the diet of a marine teleost,the European seabass,Dicentearchuslabrax[J].Aquaculture,2004,230:391-404.

