斯氏狸殖吸虫线粒体Cytb基因在不同虫期的转录水平分析
王 曼,张锡林,黄玉清,陈文碧,佘俊萍,向 丽,王光西
斯氏狸殖吸虫(Paragonimusskrjabini)主要分布于四川、云南、贵州、湖北、福建等14个省、市、自治区,人是本虫的非适宜宿主,虫体在人体内不发育为成虫,而是以幼虫状态到处游窜,引起幼虫移行症。主要表现是游走性皮下结节,但幼虫也可侵入肝、脑等组织中,容易造成临床误诊。其中,脑型并殖吸虫病对中枢神经系统损伤较大[1]。线粒体作为生物体呼吸代谢的主要细胞器,其基因组具有结构简单、母系遗传、缺少重组、进化速率快等特点,目前已成为研究吸虫代谢途径、研究抗虫药物的理想靶标[2-3]。有研究显示,mtDNA-Cytb(线粒体DNA-细胞色素b)序列分析可以用于带绦虫生物多态性研究[4]。斯氏狸殖吸虫移行过程中要穿过不同组织,需要不同的酶及大量能量,这与虫体线粒体基因转录水平有无关系?虫体不同发育阶段线粒体基因转录是否有差别?为此,本实验采用RT-PCR,T/A克隆及RTQ-PCR技术,研究斯氏狸殖吸虫线粒体Cytb(cytochrome B)基因在不同虫期的转录,为更深入了解该吸虫的物质代谢途径,探索药物作用的药靶奠定基础。
1 材料与方法
1.1实验材料及仪器
1.1.1囊蚴和虫体的获取 自云南威信县肺吸虫病流行区采集溪蟹,从溪蟹中分离出囊蚴,经过形态学鉴定为斯氏狸殖吸虫囊蚴[5]。采用腹腔注射法,感染雄性家犬(由泸州医学院实验动物中心提供)(200个囊蚴/条)1条,感染雄性SD大鼠(由泸州医学院实验动物中心提供)20只(30±2个囊蚴/只)。(感染前,取犬、大鼠粪便检查寄生虫卵阴性)。镜下观测囊蚴结构、形态,初步鉴定为斯氏狸殖吸虫囊蚴。
感染第30 d麻醉处死大鼠10只,在肝脏及腹腔检获斯氏狸殖吸虫幼虫。感染第60 d麻醉处死10只大鼠,在肝脏和肺部检获斯氏狸殖吸虫童虫。感染第90 d麻醉处死家犬,在肺部检获斯氏狸殖吸虫成虫。将部分成虫置生理盐水培养过夜,收集培养液离心获虫卵。成虫经卡红染色后观察其内部的形态结构,鉴定为斯氏狸殖吸虫。
1.1.2主要试剂 Trizol (美国Invitrogen公司);RT-PCR试剂盒、Ex Taq酶、DNA Marker DL-2000(日本TaKaRa公司);反转录试剂盒(宝生物工程(大连)有限公司);E.Z.N.A. Cycle-Pure Kit(美国Omega公司)、E.Z.N.A. Gel Extract Kit(美国Omega公司) 、E.Z.N.A. Plasmid Miniprep Kit (美国Omega公司);琼脂糖 (西班牙Biowest公司);无水乙醇 、三氯甲烷、异丙醇(成都市科龙化学试剂厂);溴酚蓝 (上海生工生物技术有限公司)。
1.1.3主要仪器 PCR仪 (美国Bio-Rad公司170-9703型);琼脂糖凝胶电泳装置 (美国Bio-Rad公司);RTQ-PCR仪 (美国应用生物系统公司ABI 7500型);凝胶成像扫描仪 (美国Bio-Rad公司Universal Hood Ⅱ型);凝胶成像结果分析软件Quantity One(美国Bio-Rad公司);低温高速离心机 (美国Beckman公司Avanti-J-25型);小型离心机 (美国Sigma公司1-1S型);紫外分光光度计 (美国Beckman公司,DU-640型);微型漩涡混合仪(上海沪西分析仪器厂有限公司WH-2型);核酸蛋白检测仪(上海沪西分析仪器厂 HD-2)。
1.2方法
1.2.1总RNA的提取 囊蚴、幼虫、童虫、成虫及虫卵5个虫期总RNA的提取方法相同。分别用0.01 mol/L PBS(pH 7.2)洗涤3次,备用。
取50~100 mg虫体在匀浆器中,用无菌DEPC水吹洗两遍,然后加入1 mL Trizol,吹打两次,研磨匀浆,直至看不见明显的固体(整个过程均在冰上完成)。室温静置5 min后,将匀浆过后的溶液移入1.5 mL EP管中,并加入0.2 mL氯仿,盖紧样品管盖,用力摇晃EP管15 s并将其室温下静置2~3 min,然后4 ℃12 000×g离心15 min,小心提取上层无色水相(RNA溶于此)至另一1.5 mL EP管中,加入等体积、预冷的异丙醇,轻柔混匀,室温静置5~10 min,然后4 ℃ 12 000×g离心10 min,弃上清,下部白色沉淀为总RNA。加预冷75%乙醇1 mL洗涤RNA,4 ℃7 500×g离心5 min,弃上清,晾干,加入20 μL无菌水溶解沉淀。NaroDrop 1000紫外分光光度仪测RNA 浓度。
1.2.2cDNA的合成 按照宝生物工程(大连)有限公司高效率逆转录试剂盒 ReverTra Ace -α-cDNA 合成cDNA。反应条件: 5×primescript Buffer 2 μL,Primescript RT Enzyme Mix1 0.5 μL, Oligo dT primer 0.5 μL, Total RNA 500 ng(10 μL反应体系最大值), Random 6 mers 0.5 μL, 加DEPC水至总体积 10 μL。反应程序:37 ℃ 15 min,85 ℃ 5 s。 NaroDrop 1000紫外分光光度仪检测cDNA质量。
1.2.3各个虫期cDNA 的PCR扩增 根据斯氏狸殖吸虫线粒体cytb基因片段设计了一对特异引物:
CytbF: 5′-GGTTGCTTGATCATAACATTGG -3′
CytbR: 5′-GACACTCTGGGTCGACCTTG-3′
25 μL的反应体系:TaKaRa Ex Taq(5 U/μL) 0.5 μL、10×Ex Taq Buffer(Mg2+Free) 2.5 μL、MgCl2(25 mmol/L) 2 μL、dNTP Mixture(各2.5 mmol/L) 2 μL、灭菌dd H2O15 μL、引物CytbF 1 μL、引物CytbR 1 μL、模板1 μL。PCR扩增条件为:94 ℃预变性5 min,1个循环;然后94 ℃变性1 min,48 ℃退火30 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸10 min。1%琼脂糖凝胶电泳鉴定。
1.2.4Realtime PCR测定及熔解曲线分析 引物由上海赛百盛公司设计并合成。内参引物:根据吸虫18S rDNA V4区设计。
内参引物:
5′-TGGTTGATCCTGCCAGATGTCATATGCTTG -3′
5′-GTCCTTGGATGTGGTAGCCATTTCTCAGGC -3′
特异引物:
5′- GGTTGCTTGATCATAACATTGG -3′
5′- GACACTCTGGGTCGACCTTG -3′
取5个虫期cDNA进行SYBR Green I荧光定量PCR,按照TOYOBO反应试剂盒进行:2×SYBR 10 μL,上、下游引物各0.8 μL,模板2 μL,无菌水6.4 μL,总体积20 μL。反应程序为:95 ℃ 1 min;95 ℃ 15 s、60 ℃ 15 s、70 ℃ 42 s ,40个循环。循环结束后进行熔解曲线分析。将目的基因质粒作为标准品,进行10倍梯度稀释同时进行定量PCR,将各个标准品的起始拷贝数取对数,作为横坐标,其所对应的Ct值作为纵坐标,即得到标准曲线,用数据分析软件将样本的扩增曲线与标准曲线对比,并结合内参自动计算出各目的基因的拷贝数。
2 结 果
2.1虫种鉴定 通过对囊蚴、成虫虫体的形态观察鉴定为斯氏狸殖吸虫(见图1)。
2.25个虫期 RNA、cDNA浓度值 囊蚴、30 d幼虫、60 d童虫、成虫、虫卵RNA浓度值分别为:150.9 ng/μL、164.3 ng/μL、401.8 ng/μL、305.4 ng/μL、690.2 ng/μL,cDNA浓度值分别为:1 413.2 ng/μL、2 264.8 ng/μL、2 063.2 ng/μL、3 407.6 ng/μL、1 367.3 ng/μL。
2.35个虫期cDNA的PCR扩增结果 斯氏狸殖吸虫线粒体Cytb(目的片段542 bp)除了在虫卵期无转录,其他4个虫期均有转录(见图2)。
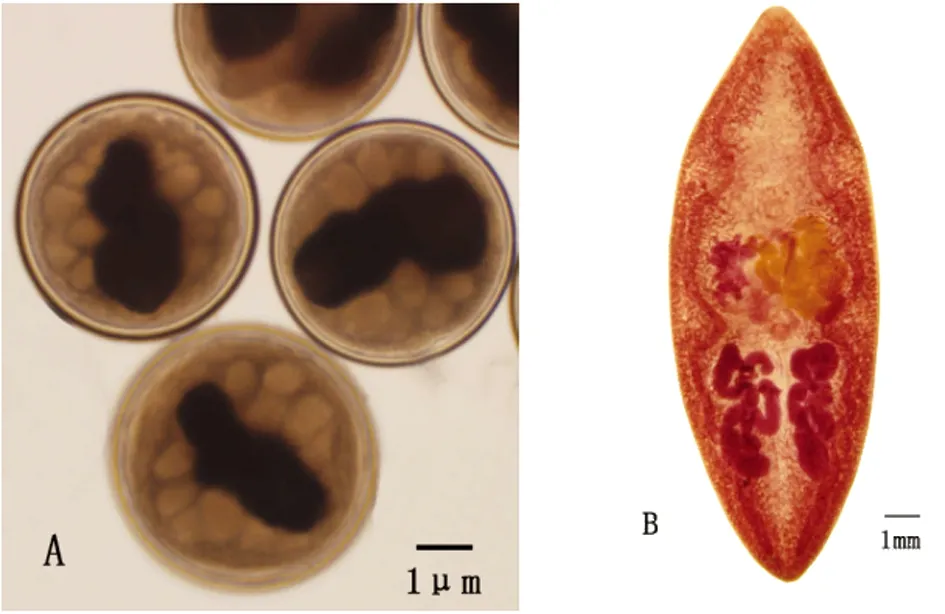
图1 斯氏狸殖吸虫囊蚴、成虫形态
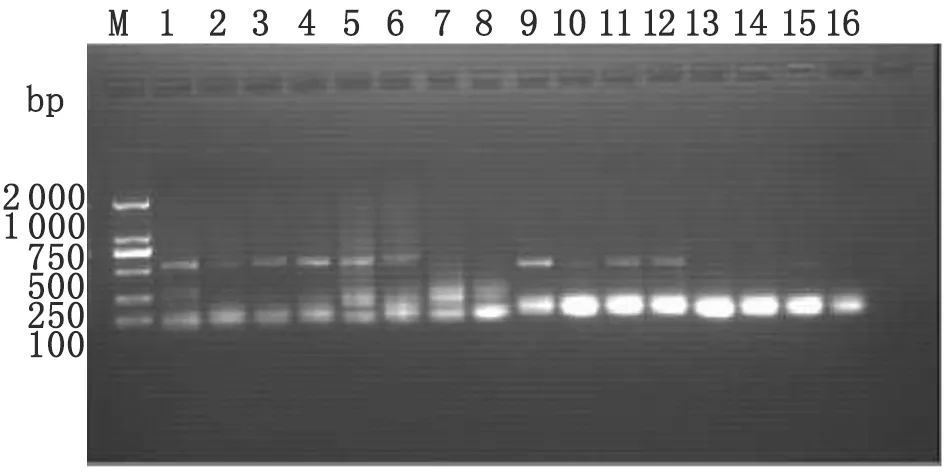
图2 斯氏狸殖吸虫5个虫期cDNA的PCR扩增结果电泳图
2.4Real-time PCR 标准曲线 标准曲线线性关系良好(图3),回归系数γ=0.994,定量结果准确可靠。
2.5Real-time PCR 熔解曲线 熔解曲线背景干净,所有曲线只有一个主峰并且在相同的温度之间,说明引物的特异性高,扩增产物单一特异(图4)。
2.6Real-time PCR 目的基因扩增曲线 扩增曲线平滑,每条曲线均有明显的指数扩增期,基线平、无上扬,不同的标准起始模板数在反应后的平台期,产物量相差不大。曲线与曲线间平行性较好,说明各反应管扩增效率相近,定量的重复性和准确性较好(图5)。
RTQ-PCR仪器自带软件显示目标样本的基因转录水平, 线粒体Cytb转录主要在囊蚴期、幼虫期及童虫期,并且是逐步升高趋势,成虫期转录较少,虫卵期没有转录。各期的转录量:虫卵期为0,囊蚴期34.34±0.26,30 d幼虫期42.56±0.35,60 d童虫期46.12±0.56,成虫期17.64±0.77(图6)。
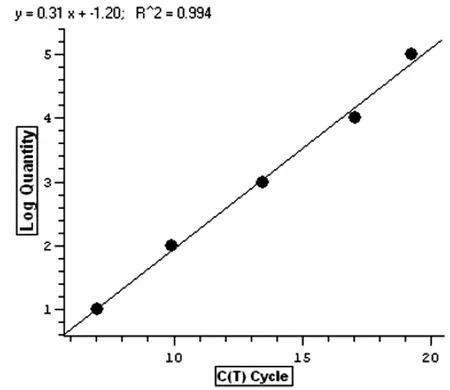
图3 斯氏狸殖吸虫线粒体Cytb基因标准曲线
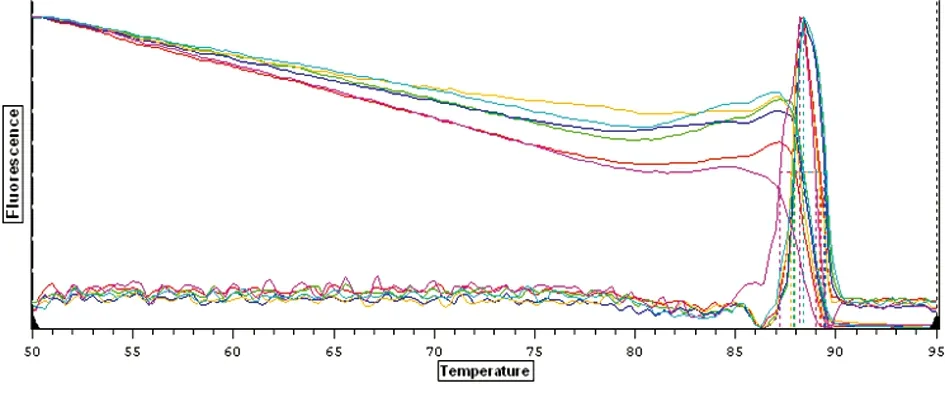
图4 斯氏狸殖吸虫线粒体Cytb gene熔解曲线

图5 斯氏狸殖吸虫线粒体Cytb基因扩增曲线
3 讨 论
在我国斯氏狸殖吸虫分布较广,危害严重,如:广州北部山区新发现卫氏并殖吸虫超高度疫源地两处,斯氏狸殖吸虫中度疫源地一处,吕田地区拟钉螺螺尾蚴感染率0.03%(1/310),溪蟹囊蚴感染率36.73%(36/98),感染度4.55个囊蚴/只蟹,0.53个囊蚴/g蟹,蟹种为平远南海溪蟹[6]。据调查神农架林区第一中间宿主螺的感染率为0.91%,第二中间宿主淡水蟹感染囊蚴为3.21个/只,动物宿主猫和果子狸的自然感染率为51.72%和15.79%,且斯氏狸殖吸虫病人群血清抗体阳性率为6.74%(76/1128)[7],三峡库区淡水蟹斯氏狸殖吸虫囊蚴的感染率为39.65%,斯氏狸殖吸虫病人群血清抗体阳性率为7.46%(54/724)[8],云南威信扎西地区淡水蟹斯氏狸殖吸虫囊蚴的感染率为33.8%(43/130)[9],由此可见,斯氏狸殖吸虫病随时可能在人群中暴发。全球已报道的并殖吸虫有50多种,其中中国报道35种,但有许多是同物异名,崔爱利等学者应用PCR技术扩增了斯氏狸殖吸虫的ITS2和部分COI基因,分析了序列的同源性,并构建种系发生树,从分子生物学角度揭示了四川并殖吸虫与斯氏狸殖吸虫系同种异名,泡囊并殖吸虫与日本的宫崎并殖吸虫也是斯氏狸殖吸虫的同种异名的推论[10]。
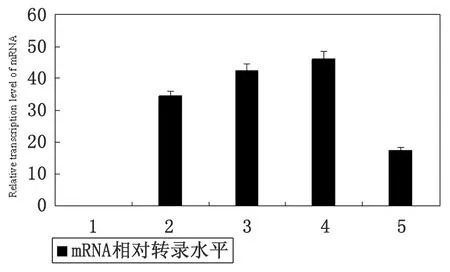
图6 斯氏狸殖吸虫各个发育阶段的线粒体Cytb 基因mRNA相对转录水平
由于人是斯氏狸殖吸虫的的非适宜宿主,虫体以幼虫状态引起宿主幼虫移行症,但是,其致病的机制一直未能完全阐明,给此病的诊断和治疗造成了一些困难,为此本研究从线粒体Cytb基因的角度来研究斯氏狸殖吸虫的致病机制,并发现了斯氏狸殖吸虫线粒体Cytb基因除了在虫卵期不转录以外,其他4个虫期均有转录,从囊蚴期、30 d幼虫期、60 d童虫期,Cytb基因转录逐步升高,在60 d童虫期高表达,提示该基因在幼虫的发育和移行中有重要作用。也证明了囊蚴经口感染,在消化液作用下,后尾蚴脱囊而出,幼虫穿过肠壁进入腹腔,移行、串扰,串致肝脏,穿过膈肌经胸腔致肺脏发育成虫定居,在这4个虫期斯氏狸殖吸虫一直不停的在进行发育、组织迁移并逃避宿主的免疫,具有很强侵袭作用,利用线粒体Cytb基因能否应用在药物靶点中还有待进一步的研究证实。
参考文献:
[1]Liu Q, Wei F, Liu W, et al. Paragonimiasis: an important food-borne zoonosis in China[J]. Trends Parasitol, 2008, 10(7): 318-323. DOI: 10.1016/j.pt.2008.03.014
[2]Monzotea L, Gilleb L. Mitochondria as a promising antiparasitic target[J]. Curr Clin Pharmacol, 2010, 5(1): 55-60.
[3]Li J, Zhao GH, Zou FC, et al. Combined mitochondrial 16S and 12S rDNA sequences: an effective genetic marker for inter-species phylogenetic analysis of zoonotic trematodes[J]. Parasitol Res, 2010, 107: 561-569. DOI: 10.1007/s00436-010-1895-x
[4]Luo L, Yang YM. Sequencing and analysis on mtDNA Cytb ofTaeniacestodesin Bai population (Dali) of Yunnan Province[J]. Chin J Zoonoses, 2010, 26(5): 425-428. (in Chinese)
罗浪,杨毅梅.云南大理白族带绦虫mtDNA-Cytb序列测定及分析[J].中国人兽共患病学报,2010,26(5):425-428.
[5]Li YS.Morphology characteristics ofParagonimusin China[M]// Shen YP. Practical paragonimiasis. 2nded. Beijing: People’s Medical Publishing House, 2008: 8-29. (in Chinese)
李友松.我国主要并殖吸虫虫种形态特征[M]//沈一平.实用肺吸虫病学. 2版.北京:人民卫生出版社,2008:8-29.
[6]Lu YY, Shen HX, Kuag HC, et al. Epidemic distribution of Paragonimus in northern suburban of Guangzhou[J]. Chin J Zoonoses, 2011, 27(7): 605-609. (in Chinese)
陆予云,沈浩贤,邝浩成,等.广州北部山区并殖吸虫流行分布现状初步研究[J].中国人兽共患病学报,2011,27(7): 605-609.
[7]Zhu J, Zhu MS. Natural foci of paragonimiasis in Shennongjia, Hubei Province[J]. Chin J Zoonoses, 2012, 28(12): 1255-1257. (in Chinese)
朱敬,朱名胜.神农架林区并殖吸虫病自然疫源地调查[J].中国人兽共患病学报,2012,28(12):1255-1257. DOI:10.3969/cjz j.issn.1002—2694.2012.12.021
[8]Zhang XL,Wang Y,Wang GX,et al.Distribution and clinical features ofParagonimiasisskrjabiniin Three Gorges Reservoir Region[J].Parasitol Int,2012,61(4):645-649. DOI: 10.1016/j.parint.2012.06.007
[9]Wang GX, Huang YQ, Chen WB, et al. Research on the infections focus ofParagonimiasisskrjabiniat Weixin, Yunnan Province[J]. Sichuan J Zool, 31(4): 606-607. (in Chinese)
王光西,黄玉清,陈文碧,等.云南威信县24例肺吸虫病病原追踪调查[J].四川动物,2012,31(4):606-607.
[10]Cui AL, Chang ZS, Chen MG, et al. Study on DNA sequences ofPagumogonimusskrjabinipopulations from five provinces in China[J]. Chin J Parasitol Parasit Dis, 2003, 21(2): 71-75. (in Chinese)
崔爱利,常正山,陈名刚,等.我国五省斯氏并殖吸虫群体DNA序列分析的研究[J]. 中国寄生虫学与寄生虫病杂志,2003,21(2):71-75.

