骆驼蓬总生物碱中骆驼蓬碱、去氢骆驼蓬碱及其代谢产物大鼠体内药代动力学研究
史小媛, 刘 伟, 张 磊, 李淑萍, 程雪梅,2, 习 阳, 王长虹,2*
(1.上海中医药大学中药研究所 中药标准化教育部重点实验室 中药新资源与质量标准综合评价国家中医药管理局重点研究室,上海 201203;2.上海中药标准化研究中心, 上海 201203; 3.宁波大学医学院,浙江 宁波 315211)
[制 剂]
骆驼蓬总生物碱中骆驼蓬碱、去氢骆驼蓬碱及其代谢产物大鼠体内药代动力学研究
史小媛1, 刘 伟1, 张 磊1, 李淑萍1, 程雪梅1,2, 习 阳3, 王长虹1,2*
(1.上海中医药大学中药研究所 中药标准化教育部重点实验室 中药新资源与质量标准综合评价国家中医药管理局重点研究室,上海 201203;2.上海中药标准化研究中心, 上海 201203; 3.宁波大学医学院,浙江 宁波 315211)
目的 研究骆驼蓬总生物碱中骆驼蓬碱、去氢骆驼蓬碱及其活性代谢产物骆驼蓬醇和骆驼蓬酚在大鼠体内的药代动力学特征。 方法 口服骆驼蓬总 生物碱 (140 mg/kg) 及静脉 注射骆 驼 蓬碱与去 氢 骆驼蓬碱 的 混合溶液 (均为3.3 mg/kg), 采集不同时间点的血浆, 采用 UPLC-MS/MS 法测定大鼠血浆中骆驼蓬碱、 去氢骆驼蓬碱、 骆驼蓬醇、 骆驼蓬酚的血药浓度,并计算药代动力学参数。结果 灌胃和静脉给药后,在血浆中检测到骆驼蓬碱、去氢骆驼蓬碱、骆驼蓬醇和骆驼蓬酚, 但骆驼蓬酚的血药浓度在 24 h时未下降而未能计算药动参数。 静注给药后, 骆驼蓬碱、 去氢骆驼蓬 碱 和骆驼蓬 醇 的 t1/2e分 别 为 2.554、 3.116、 1.899 h,MRT分 别 为 1.700、 1.311 、 1.880 h,AUC0-t为 373.1、2033.0、 8.914 ng.h/mL。 口 服 总 生 物 碱 后 骆 驼 蓬 碱、 去 氢 骆 驼 蓬 碱 和 骆 驼 蓬 醇 的 Cmax分 别 为 347.6、 184.5、32.7 ng/mL,Tmax分别为 3.200、 1.150、 0.300 h,t1/2e分 别 为 6.994、 5.625、 21.912 h,MRT分 别 为 8.588、 9.791 、27.780 h,AUC0-t为 2 755.5、 1 202.8、 129.8 ng.h/mL。口服 总 生物碱后 骆 驼蓬碱和 去 氢骆驼蓬 碱 的绝对生 物 利 用度分别为 63.22%和 4.96%。 结论 口服总生物碱后骆驼蓬碱和去氢骆驼蓬碱均可迅速吸收并迅速代谢, 骆驼蓬碱与去氢骆驼蓬碱相比较,具有更高的生物利用度,代谢产物骆驼蓬醇和骆驼蓬酚与原型骆驼蓬碱和去氢骆驼蓬碱相比较,消除速率相对较慢。此外,静注给药后,体内去氢骆驼蓬碱的初始血药浓度明显高于骆驼蓬碱。
骆驼蓬;总生物碱提取物;去氢骆驼蓬碱;骆驼蓬碱;代谢产物;药代动力学
骆驼 蓬 Peganum harmala L.为 蒺 藜 科 (Zygophyllaceae) 骆 驼 蓬 属 (Peganum) 多 年 生 草 本 植物,民间常以种子或全草入药,用于治疗咳嗽气喘、 无名肿痛、 风湿痹痛等症[1]。 生物碱类成分如去氢骆驼蓬碱 (Harmine)、 骆驼蓬碱 (Harmaline) 等为骆驼蓬的主要活性成分, 对中枢神经系统、心血管系统及免疫系统等具有广泛的生物活性[2-3]。 前期研究发现, 骆驼蓬碱和去氢骆 驼蓬碱等具有较强的抗乙酰胆碱酯酶和抗单胺氧化酶活性[4-5]。本课题 组 前 期 报 道 了 骆 驼 蓬 碱 及 去 氢 骆 驼蓬碱在体内可以代谢生成同样具有较强抗乙酰胆碱酯 酶 活 性 的 骆 驼 蓬 醇 (Harmol) 及 骆 驼 蓬 酚(Harmalol) 等 代 谢 产 物[6-7], 如 图 1 所 示。 目 前,骆驼 蓬 总 生 物 碱 (Total Alkaloid Extracts from P. harmala,TAEP) 药代动力学研究多限于对其主要活性成分骆驼蓬碱及去氢骆驼蓬碱单体的研究[7-8], 并未涉 及 总 生 物 碱 多 种 成 分 共 存 情 况 下 主要活性成分的药代动力学特征的研究。因此,本实验在前期研究的基础上, 研究 TAEP中主要活性成分骆驼蓬碱、去氢骆驼蓬碱及其活性代谢产物骆驼蓬醇、骆驼蓬酚在大鼠体内药代动力学过程,为TAEP的新药研发和临床应用提供参考。
1 材料与试药
1.1 药品与试剂 TAEP, 上海中医药大学中药研究所制备, 批号 110115), 经 HPLC法[9]测定 骆驼蓬碱 和 去 氢 骆 驼 蓬 碱 含 量 分 别 为 0.27 g/g与0.28 g/g; 骆驼蓬碱和去氢骆驼蓬碱对照品 (上海中药标准 化 研 究中 心, 纯 度 98%); 9-氨基 吖 啶(美国 Sigma公司); 乙腈为色谱纯 (美国 Fisher公司),其余试剂为分析纯,购自上海国药集团有限公司。 实验用水为超纯水 (Millipore制备)。
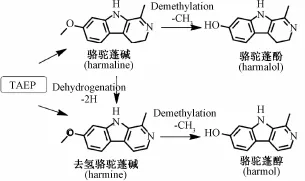
图1 化合物结构及代谢转化途径Fig.1 Structures of com pounds and metabolic pathways
1.2 仪 器 Waters ACQUITY UPLC-Quattro Premier XE超高效液相色谱三重四极杆质谱联用仪 (Waters, 美国),MassLynxTM4.1 工作站软件; HGC-36A干式热氮吹仪 (天津恒奥科技发展有限公司);5415R台式高速冷冻离心机 (德国 Eppendorf公司);BP 211 D电子 天 平 (Sartorius, 德国); KQ-500B型超声波清洗器 (江苏省昆山市超声仪器有限公司);Milli-Q超纯水器 (美国 Millipore公司)。
1.3 动 物 清 洁 级 SD 大 鼠 16 只, 体 质 量(220 ±30)g, 雌雄各半, 合格证号 SCXK2008-0016, 由上海中医药大学实验动物中心提供。
2 方法与结果
2.1 大鼠血浆中骆驼蓬碱和去氢骆驼蓬碱及其代谢产物骆驼蓬醇和骆驼蓬酚的测定 参考前期建立的 UPLC-MS/MS 法测定比格犬血浆样品中骆驼蓬碱、去氢骆驼蓬碱及其代谢产物骆驼蓬醇、骆驼蓬酚的方法[7], 重 点考察了 该 方 法用 于 检 测大 鼠 血浆样品中骆驼蓬碱、去氢骆驼蓬碱及其代谢产物骆驼蓬醇、骆驼蓬酚的专属性、线性及基质效应。
2.1.1 色谱与质谱条件
2.1.1.1 色谱条件 使用 Waters-ACQUITYTM UPLC system系统分离 ;ACQUITY UPLC BEH C18色谱柱 (50 mm ×2.1 mm,1.7 μm); 流 动 相 为 0.1%甲酸水 (A)-乙 腈 (B); 采 用 梯 度 洗 脱 (0 ~2.5 min,9% ~13%B; 2.5 ~2.51 min,13% ~14.5%B; 2.51 ~4.0 min,14.5% ~15.5%B;4.0 ~4.01 min,15.5% ~90%B; 4.01 ~5.0 min, 90%B; 5.0 ~6.0 min,9%B); 体 积 流 量 0.4 mL/min;柱温 35 ℃; 进样体积为 5 μL。
2.1.1.2 质谱条 件 使用 Micromass Quattro Premier XE串联 三重四级杆质谱联合电喷雾 (ESI) 作为分析检测的仪器。在正离子模式下采用多反应监测模式,各待测物选用的检测离子对分别为:骆驼蓬碱,215.20→172.05; 去氢骆驼蓬碱,213.52→169.92; 骆驼蓬醇,199.15→171.11; 骆驼蓬酚, 201.20 → 160.20; 9-氨 基 吖 啶 ( 内 标,IS), 199.08→171.11。 质谱参数: 毛细管电压 2.5 kV;锥孔电压 50 V;碰撞电 压 25 V; 萃 取 电 压 2.0 V;离子源温度120 ℃; 脱溶剂温度400 ℃; 脱溶剂气700 L/h(N2); 锥孔气 75 L/h。 N2(纯度 99.9%)和氩气 (纯度 99.999%) 分别用作锥孔气及碰撞气。各待测物质谱检测方法的检测时间段、锥孔电压 和 碰 撞 电 压 分 别 为: 骆 驼 蓬 碱,3.00 ~4.50 min,40 V,20 V; 去 氢 骆 驼 蓬 碱,3.50 ~4.50 min,55 V,30 V; 骆 驼 蓬 醇,1.35 ~2.00 min,50 V,30 V; 骆 驼 蓬 酚,0.50 ~1.60 min,40 V,20 V; IS,2.00 ~3.00 min, 50 V,30 V。 数据 采 集 与处理通 过 MassLynx 4.1 软件完成。
2.1.2 对照品溶液和质控样品的制备 对照品溶液:分别精密称取骆驼蓬碱、去氢骆驼蓬碱、骆驼蓬 醇、 骆 驼 蓬 酚 对 照 品 4.00、 4.00、 2.00、2.00 mg, 置 于 10 mL棕 色 量 瓶 中, 加 乙 腈 溶 解 并稀释至刻度摇匀,配制成骆驼蓬碱、去氢骆驼蓬碱、 骆驼蓬醇、 骆驼蓬酚质量浓度分别为 0.40、 0.40、 0.20、 0.20 mg/mL的混合对照品母液; 精密称取 IS 对 照 品 2.00 mg, 置 于 10 m L棕 色 量 瓶中, 加乙腈溶解并稀释至刻度, 摇匀, 配制成 IS质量浓度为 0.20 mg/mL的 IS 母液。
质控样品 (QC): 取混合对照品母液用初始流动相 (含 0.1%甲 酸的 9%乙腈溶 液) 稀释制得低、中、高3个质量浓度样品,质量浓度分别为1.0、20、 500 ng/mL( 骆 驼 蓬 碱 与 去 氢 骆 驼 蓬碱); 0.5、 10、 250 ng/mL( 骆 驼 蓬 醇 与 骆 驼蓬酚)。
2.1.3 血浆样品的处理方法 100 μL血浆中加入50 ng/mL的 IS 溶 液 100 μL, 涡 旋 混 合 1 min, 加入 200 μL乙 腈 (0 ℃),15 000 ×g 离 心 10 min (4 ℃), 移取上清液 320 μL,N2吹干, 残留物加入初 始 流 动 相 80 μL, 涡 旋 1 min 使 其 溶 解, 15 000 ×g离心 10 min(4 ℃), 取上清 液 进样。
2.1.4 方法的专属性考察 采用 UPLC-MS/MS 法检测大鼠血浆样品中骆驼蓬碱、去氢骆驼蓬碱、骆驼蓬醇、骆驼蓬酚的血药浓度。骆驼蓬碱、去氢骆驼蓬碱、 骆驼蓬醇、骆驼蓬酚及 IS 保留时间分别为 3.77、 3.91、 1.55、 1.35、 2.36 min, 血浆中内源性物质不干扰测定。
2.1.5 标准曲线与线性范围 取混合对照品母液用乙腈稀释成骆驼蓬碱与去氢骆驼蓬碱质量浓度为1.0、 2、 5、 10、 20、 50、 100、 200、 500 ng/mL, 骆驼蓬醇与骆驼蓬酚质量浓度为 0.5、 1、 2.5、 5、 10、25、50、 100、250 ng/mL。取 IS 对照品母液用乙腈稀释成 50 ng/mL的 IS 溶液。 取 100 μL空白血浆,加入各质量浓度的对照品、 50 ng/mL的 IS 溶液和乙腈各 100 μL, 涡 旋 混 合 1 min,15 000 ×g 离 心 10 min(4 ℃), 移取上清液320 μL,N2吹干, 残留物加入 初 始 流 动 相 80 μL, 涡 旋 1 min 使 其 溶 解, 15 000 ×g 离心 10 min(4 ℃), 上 清 液, 即 为 系 列标准曲线样品。以待测物质量浓度为横坐标,待测物与内标的峰面积比值为纵坐标,进行线性回归,计算标准曲线回归方程,结果表明各组分线性关系良好, 结果见表1, 色谱图见图2。

表1 血浆中待测物及代谢产物的标准曲线、 线性范围及定量限 (n=6)Tab.1 Calibration curves, linearity range, and lim it of quantification of analytes and itsmetabolites in p lasma (n=6)

图 2 空白血 浆 ( A) 、 混合 对 照 品 ( B, 定 量 限 ) 、 灌 胃 30 m in后 的 血 浆 样 品 ( C) 及 静 脉 注 射 30 m in后 的 血 浆 样 品(D) 色谱图Fig.2 Chromatograms of blank plasma ( A) , m ixture reference( B, the LOD of reference) , plasma samp le after 30 m in of oral adm inistration( C) and plasma sample after 30 m in of intravenous adm inistration( D)
2.1.6 基质效应 取低、 中、 高 3 个质量浓度的QC样品, 每个质量浓度进行5个样本分析。 同时,另取空白血浆 100 μL, 除不加入标准溶液外, 其它按 “2.1.3” 项下的方法操作, 所得的残留物加入相应质量浓度的混合标准溶液和 IS 溶液, 涡旋混合,进样分析,获得相应的峰面积。结果表明,本方法低、中、高3个质量浓度样品的回收率均在85% ~115%之间, 样品不受基质干扰。
2.2 药代动力学实验
2.2.1 供 试 样 品 的 制 备 称 取 350 mg TAEP, 加入 24 m L 0.3%CMC-Na溶 液 及 1m L 0.1 mol/L HCl, 制得 14.0 mg/mL的 混 悬 液 25 mL(口 服 用,含去氢骆驼蓬碱与骆驼蓬碱分别为 3.92 和 3.78 mg/mL); 分别称取 16.68 mg骆驼蓬碱与去氢骆驼蓬碱对照 品 适量, 加入24 mL生理 盐 水及1 mL 0.1 mol/L HCl, 制得含骆驼 蓬碱与去 氢 骆 驼蓬碱分别为 0.667 mg/mL的混合静脉注射液。
2.2.2 给药方案 SD大鼠 16 只, 随机分为 2 组,每组8 只, 雌雄各半, 试验前禁食不禁水12 h。 一组灌胃给予剂量为 140 mg/kg的 TAEP, 给药后 2、5、 15、 30、 45 min、 1、 2、 4、 8、 12、 24 h 于 眼眶静脉丛取血 0.25 mL; 另一组尾静脉注射给予骆驼蓬碱与去氢骆驼蓬碱的混合溶液,剂量为3.33 mg/kg, 给 药 后 2、 5、10、 20、30、 45 min、1、 2、 4、8、 12、 24 h 于 眼 眶 静 脉 丛 取 血0.25 mL。 血样 置 于肝素化离 心 管,4℃ 5 000 ×g离心 15 min 制备血 浆, 血浆保存 在 -80℃ 待 测。
2.2.3 血药浓度测定及药代动力学参数 血浆样品经过处理后进行 UPLC-MS/MS 测定, 测得给药后不同时间点骆驼蓬碱、去氢骆驼蓬碱及其代谢产物骆驼蓬醇、骆驼蓬酚血药浓度。
大鼠静脉给予骆驼蓬碱与去氢骆驼蓬碱的混合溶 液 ( 分 别 3.33 mg/kg) 后, 测 得 的 骆 驼 蓬 碱 、去氢骆驼蓬碱及其代谢产物骆驼蓬醇、骆驼蓬酚的药 -时曲线见图 3。 由图 3-A可见, 静脉给药后骆驼蓬碱及去氢骆驼蓬碱的血药浓度迅速下降,但直至24 h时还能检测到一定浓度的骆驼蓬碱及去氢骆驼蓬碱。但是,值得注意的是给药后去氢骆驼蓬碱的初始血药浓度远远高于骆驼蓬碱的血药浓度,前者约比后者高出 8 倍左右。 由图 3-B可见, 在2 min时即可检测到 去 氢 骆驼蓬碱 的 代 谢产物骆驼蓬醇,20min 时血药浓度即达到峰值, 然后出现迅速下降, 至24 h还能检测到较低的血药浓度。 同样, 在给药后 2 min 也可检测到骆驼蓬碱的代谢产物骆驼蓬酚,20min 时达到血药浓度峰值, 但随后血药浓度呈现出缓慢上升的趋势。结果与比格犬静脉注射骆驼蓬碱和去氢骆驼蓬碱后体内药代动力学行为相似[7]。
大鼠 灌 胃 给 予 TAEP 140 mg/kg后, 测 得 的 骆驼蓬碱、去氢骆驼蓬碱及其代谢产物骆驼蓬醇、骆驼蓬酚的药 -时曲线见图 3。 由图 3-C可见, 灌胃给药2 min 后即可在血中检测到很高浓度的骆驼蓬碱及去氢骆驼蓬碱,其中骆驼蓬碱的血药浓度在4 h时 达到峰值, 随 后 较 缓 慢 下 降, 到 24 h 时 还 能检测到浓度较低的骆驼蓬碱。去氢骆驼蓬碱血药浓度在 2 min 时 即 达到 峰 值, 然 后 出 现 迅 速 下 降 至45 min时 开 始 缓 慢 上 升, 到 2 h 时 出 现 第 二 个 峰值, 其后又开始缓慢下降, 一直 到 24 h时 还能检测到浓度较低的去氢骆驼蓬碱。 由图 3-D可见, 在2 min 时即可检测到去氢骆驼蓬碱的代谢产 物骆驼蓬醇,5 min 血药浓度即 达到峰值, 然后出 现迅速下降至45 min 时又开始 缓 慢上升, 到 1 h 时出现第二个峰值, 其后开始缓 慢 下 降,4 h至24 h血 药 浓度一直维持在一个水平,稍有上下波动。而骆驼蓬碱的代谢产 物 骆 驼蓬酚在 30 min 时 被检测到, 随后一直 缓慢上升, 至 24 h未出现峰值。 结 果与比格犬口服骆驼蓬碱和去氢骆驼蓬碱后的体内药代动力学行为相似[9]。
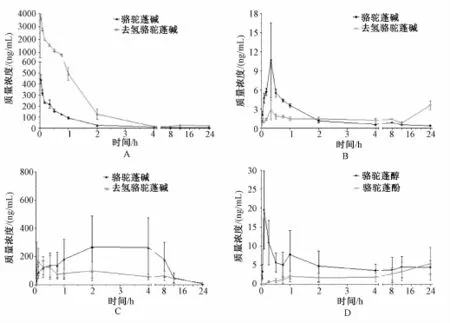
图 3 大鼠静脉 注 射骆驼蓬 碱 与去氢骆 驼 蓬碱的混 合 溶液 (3.33 mg/kg) 和 口 服骆驼 蓬 总 生物碱 (140 mg/kg) 后原型 骆驼蓬碱和去氢骆驼蓬碱 (A、 C) 和代谢产物骆驼蓬醇、 骆驼蓬酚 (B、 D) 平均血药浓度-时间曲线 (n=8,)Fig.3 Mean p lasma concentration-time curves of harmaline, harm ine( A, C) and their metabolites harmol, harmalol( B, D) in rats after intravenous adm inistration of m ixed solution of harmaline and harm ine(3.33 mg/kg) and oral adm inistration of total alkaloid extracts(140 mg/kg) from Peganum harmala L.( n=8,)
将血药浓度-时间数据采用非房室模型药动学软 件 PK solution 2TM(Summit Research Services, USA) 处理得到各主要药代动力学参数, 包括峰浓度 (Cmax)、 达 峰 时间 (Tmax)、 血药浓度-时间 曲 线下 面 积 (AUC0-t与 AUC0-∞)、 消 除 速 率 常 数(Ke) 、 消 除半衰 期 (t1/2e) 、 吸 收 速 率 常 数 (Ka) 、吸收半衰 期 (t1/2a)、 分 布 速率常数 (Kd)、 分 布 半衰期 (t1/2d)、 平均滞留时间 (MRT)、 表观分布容积 (Vd)、 血浆清除率 (CL) 及生物利用度 (F)。参照参考文献[10], 代谢 产 物 骆 驼 蓬 醇的给药剂量按原型去氢骆驼蓬碱剂量计算,静脉注射给药后骆驼蓬醇的体内过程按口服方式处理。通过剂量校正, 分别计算口服 TAEP后骆驼蓬碱与去氢骆驼蓬碱的绝对生物利用度。药动学参数以均值±标准差 () 表示, 统计学分析使用 t检验和SPSS 方差分析,P<0.05 具有统计学意义。 结果见表 2。 由于骆驼蓬酚血药浓 度 在 24 h 时还处于缓慢上升过程,因此其药代动力学参数未能计算获得。
从表 2 可以看出, 口服 TAEP后骆驼蓬碱、 去氢骆驼蓬碱 和 骆驼蓬醇的 Cmax分别为 347.6、 184.5和 32.7 ng/mL,Tmax分 别 为 3.200、 1.150、0.300 h,t1/2e分 别 为 6.994、 5.625、 21.912 h, MRT分别为 8.588、 9.791 、 27.780 h,AUC0-t为2 755.5、 1 202.8 、 129.8(ng.h)/mL。 静 注 给药后, 骆驼蓬碱、 去氢骆驼蓬碱和骆驼蓬醇的 t1/2e分 别 为 2.554、3.116、 1.899 h,MRT 分 别 为1.700、 1.311 、 1.880 h,AUC0-t为 373.1、2 033.0 、 8.914(ng.h)/mL。 口服总生物碱后骆驼蓬碱和去氢骆驼蓬碱的绝对生物利用度分别为63.22%和 4.96%。
表 2 大 鼠口服骆 驼 蓬总生物 碱 (140 mg/kg) 与静脉注 射骆 驼 蓬 碱 及去 氢 骆 驼 蓬碱 的 混 合 溶 液 (3.33 mg/kg) 后 骆 驼 蓬碱、 去氢骆驼蓬碱及其代谢产物的药代动力学参数 (n=8,)Tab.2 Pharmacokinetics parameters of harmaline, harm ine and their metabolites in rats after oral adm inistration of total alkaloid extracts(140 mg/kg) from Peganum harmala L.and intravenous adm inistration of m ixed solution of harmaline and harm ine(3.33 m g/kg) (n=8,)
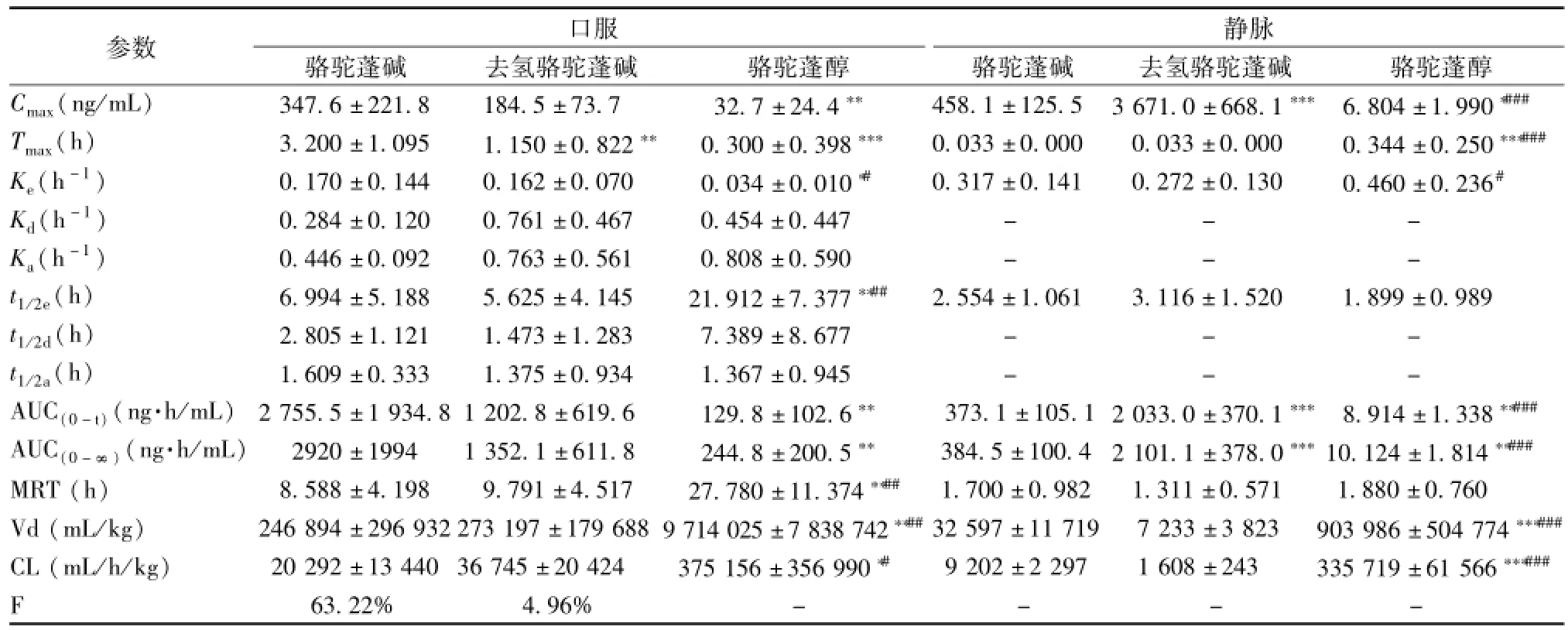
表 2 大 鼠口服骆 驼 蓬总生物 碱 (140 mg/kg) 与静脉注 射骆 驼 蓬 碱 及去 氢 骆 驼 蓬碱 的 混 合 溶 液 (3.33 mg/kg) 后 骆 驼 蓬碱、 去氢骆驼蓬碱及其代谢产物的药代动力学参数 (n=8,)Tab.2 Pharmacokinetics parameters of harmaline, harm ine and their metabolites in rats after oral adm inistration of total alkaloid extracts(140 mg/kg) from Peganum harmala L.and intravenous adm inistration of m ixed solution of harmaline and harm ine(3.33 m g/kg) (n=8,)
注: 与骆驼蓬碱比较,*P<0.05,**P<0.01,***P<0.001; 与去氢骆驼蓬碱比较,#P<0.05,##P<0.01,###P<0.001
口服静脉参数 骆驼蓬碱 去氢骆驼蓬碱 骆驼蓬醇 骆驼蓬碱 去氢骆驼蓬碱 骆驼蓬醇Cmax(ng/m L) 347.6 ±221.8 184.5 ±73.7 32.7 ±24.4** 458.1 ±125.5 3 671.0 ±668.1***6.804 ±1.990*###Tmax(h) 3.200 ±1.095 1.150 ±0.822** 0.300 ±0.398*** 0.033 ±0.000 0.033 ±0.000 0.344 ±0.250***###Ke(h-1) 0.170 ±0.144 0.162 ±0.070 0.034 ±0.010*# 0.317 ±0.141 0.272 ±0.130 0.460 ±0.236#Kd(h-1) 0.284 ±0.120 0.761 ±0.467 0.454 ±0.447 - - -Ka(h-1) 0.446 ±0.092 0.763 ±0.561 0.808 ±0.590 - - -t1/2e(h) 6.994 ±5.188 5.625 ±4.145 21.912 ±7.377**## 2.554 ±1.061 3.116 ±1.520 1.899 ±0.989 t1/2d(h) 2.805 ±1.121 1.473 ±1.283 7.389 ±8.677 - - -t1/2a(h) 1.609 ±0.333 1.375 ±0.934 1.367 ±0.945 - - -AUC(0-t)(ng.h/m L)2 755.5 ±1 934.8 1 202.8 ±619.6 129.8 ±102.6** 373.1 ±105.1 2 033.0 ±370.1***8.914 ±1.338**###AUC(0-∞)(ng.h/mL) 2920 ±1994 1 352.1 ±611.8 244.8 ±200.5** 384.5 ±100.4 2 101.1 ±378.0***10.124 ±1.814**###MRT(h) 8.588 ±4.198 9.791 ±4.517 27.780 ±11.374**## 1.700 ±0.982 1.311 ±0.571 1.880 ±0.760 Vd(m L/kg) 246 894 ±296 932 273 197 ±179 688 9 714 025 ±7 838 742**##32 597 ±11 719 7 233 ±3 823 903 986 ±504 774***###CL(m L/h/kg) 20 292 ±13 440 36 745 ±20 424 375 156 ±356 990*# 9 202 ±2 297 1 608 ±243 335 719 ±61 566***###F 63.22% 4.96% ----
3 讨论
骆驼蓬 总 生 物 碱 是 骆 驼 蓬 主 要 活 性 部 位[11],其中骆驼蓬碱和去氢骆驼蓬碱含量之和超过50%,甚至高达 85.49%, 二者的含有量之比 大约 1 ∶1[9]。 前期报道发现骆驼蓬碱在大鼠体内不 仅可以通过脱烷基化代谢生成骆驼蓬酚,还能够迅速脱氢代谢生成去氢骆驼蓬碱,随后代谢产生骆驼蓬醇[6]。 研究发现 骆 驼 蓬 碱、 去 氢 骆 驼 蓬 碱 及 其 代谢产物骆驼蓬醇、骆驼蓬酚均具有很强的抗胆碱酯酶活性, 表明 TAEP具有开发成治疗老年痴呆症药物的潜能。 因此, 对 TAEP中骆驼蓬碱、 去氢骆驼蓬碱及其代谢产物骆驼蓬醇、骆驼蓬酚的药动学特征进行研究是非常有必要的。
静脉注射相同剂量骆驼蓬碱和去氢骆驼蓬碱后,去氢骆驼蓬碱的初始血药浓度远远高于骆驼蓬碱,一方面可能是去氢骆驼蓬碱的代谢速率比骆驼蓬碱慢所致,另一方面骆驼蓬碱在体内可以代谢转化成去氢骆驼蓬碱进一步增加了二者血药浓度的差异。具体原因有待于进一步通过骆驼蓬碱和去氢骆驼蓬碱的代谢速率等方面进行研究和证明。
灌胃给药后,对骆驼蓬碱和去氢骆驼蓬碱的药动 学 参 数 进 行 比 较, 两 者 的 Tmax、 Cmax、 AUC、Vd、 CL等均存在一定的差异, 但无统计学意义(除 Tmax外)。 代 谢 产物骆驼 蓬 醇 和骆驼蓬 酚 的 Cmax及 AUC0-t较原型去氢骆驼蓬碱和骆驼蓬碱小, 说明除了这两个主要代谢产物外,其它代谢产物可能还占相当的比例[6]。 两个 原 形 药物 骆 驼 蓬碱 与 去氢骆驼蓬碱在体内的代谢和消除速率均较快,给药后即刻在体内就可检测到代谢产物。而代谢产物骆驼蓬醇的消除速率相对较慢 (代谢产物骆驼蓬醇的MRT是原形去氢骆驼蓬碱的3倍), 尤其是骆驼蓬酚血药浓度在 24 h内 一 直呈上升趋 势。一则说明了体内代谢产物的形成过程较长,二则说明骆驼蓬醇和骆驼蓬酚的消除较慢。要进一步阐明原因,有必要对骆驼蓬醇和骆驼蓬酚单体给药后的体内过程进行进一步研究。
骆驼蓬碱的口服生物利用度较大为 63.22%,而去氢骆驼蓬碱的口服生物利用度较小为 4.96%。而大鼠口服去氢骆驼蓬碱单体的生物利用度为19.65%[8], 说明总生物碱中多种共存成分对去氢骆驼蓬碱的生物利用度影响较大,原因有待于进一步研究。另外,骆驼蓬碱与去氢骆驼蓬碱结构类似,生物利用度却存在较大差异,其原因和影响因素也需要进行深入研究,以期为进一步的新药开发及临床应用提供理论依据。
虽然原型药物骆驼蓬碱和去氢骆驼蓬碱在体内起主要作用,但同样具有活性的代谢产物骆驼蓬醇和骆驼蓬酚在体内消除速率明显减慢,平均滞留停留时间明显增加,有利于整体药效作用维持更长时间。 另外, 由口服 TAEP后的药时曲线图 (图3 B, D) 可以发现,去氢骆驼蓬碱与骆驼蓬醇可能存在双峰或多峰现象。一般认为双峰或多峰现象的产生与肝肠循环有关,还有学者认为肠道不同部位的吸收时间和速率的不一致也是造成双峰和多峰的原因[12-13]。 此 外, 骆 驼 蓬 碱 及 去 氢 骆 驼 蓬 碱 的 相 互代谢转化也很有可能是产生多峰的原因之一。要进一步确定是否确实存在双峰或多峰现象及阐明产生的原因,有必要对更多数量和不同种属的动物的去氢骆驼蓬碱和骆驼蓬醇单体给药后的体内过程进行比较研究。
[1] 中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准维吾尔药分册[S].乌鲁木齐: 新疆科技卫生出版社,1998:80.
[2] 赵 婷,王长虹,王峥涛.骆驼蓬属植物中生物碱类化学成分及其 药理活 性研 究进展 [ J].国际 药 学研 究杂 志, 2010,37(5):333-339.
[ 3 ] Farouk L,Laroubi A,Aboufatima R,et al.Evaluation of the analgesic effect of alkaloid extract of Peganum harmala L.: Possiblemechanisms involved [ J] .J Ethnopharmacol,2008, 115(3):449-454.
[ 4 ] Zheng X Y,Zhang Z J,Chou G X,et al.Acetylcholinesterase inhibitive activity-guided isolation of two new alkaloids from seeds of Peganum nigellastrum Bunge by an in vitro TLC-bioautographic assay[ J] .Arch Pharm Res,2009,32(9): 1245-1251.
[ 5 ] Kim H,Sablin SO,Ramsay R R.Inhibition ofmonoamine oxidase A byβ-carboline derivatives[ J] .Arch Biochem Biophys, 1997,337(1):137-142.
[ 6 ] Zhao T,Zheng S S,Zhang B F,et al.Metabolic pathways of the psychotropic-carboline alkaloids,harmaline and harmine, by liquid chromatography/mass spectrometry and NMR spectroscopy[J].Food Chem,2012,134(2):1096-1105.
[ 7 ] Zhang L,Teng L,Gong C,etal.Simultaneous determination of harmine,harmaline and their metabolites harmol and harmalol in beagle dog plasma by UPLC– ESI-MS/MS and its application to a pharmacokinetic study[ J].J Pharm Biomed Anal, 2013,85(2013):162-168.
[8] 王长虹,孙殿甲,高炜玮.大鼠静脉注射和灌胃盐酸去氢骆驼蓬碱的药物动力学[J].中国临床药学杂志,2002,11 (3):159-161.
[ 9] 张 磊.骆驼蓬总生物碱薄膜包衣片的研究 [D].上海:上海中医药大学,2013.
[10 ] Wang CH,LiY,Gao JG,etal.The comparative pharmacokinetics of two pyrrolizidine alkaloids,senecionine and adonifoline,and theirmain metabolites in rats after intravenous and oral administration by UPLC/ESIMS [ J] .Anal Bioanal Chem, 2011,401(1):275-287.
[11] 刘 力, 程雪梅, 王长虹, 等.骆驼蓬总生物碱提取物的质量标准 研 究 [J].中 国 医 药 工 业 杂 志,2010,41(6): 420-423.
[12] 卢 海 儒.药-时 曲 线 上 的 多 峰 现 象 [ J].青 海 医 药 杂 志, 1995,25(8):31-32.
[13] 郑 萍, 胡敏燕, 刘世霆, 等.卡马西平吸收的多峰现象[J].中国临床药学杂志,1999,8(3):184-184.
Pharm acokinetics of harm aline,harm ine and their m etabolites in rats adm inistered w ith total alkaloid extracts from Peganum harmala L.
SHI Xiao-yuan1, LIU Wei1, ZHANG Lei1, LI Shu-ping1, CHENG Xue-mei1,2, XI Yang3, WANG Chang-hong1,2*
(1.Institute of ChineseMateria Medica,ShanghaiUniversity of Traditional ChineseMedicine; TheMOE Key Laboratory for Standardization of ChineseMedicines and The SATCM Key Laboratory for New Resourcesand Quality Evaluation of ChineseMedicines,Shanghai201203,China; 2.Shanghai R&D Centre for Standardization of ChineseMedicines,Shanghai201203,China; 3.School ofMedicine,Ningbo University,Ningbo,Zhejiang 315211,China)
AIM To study the pharmacokinetics of harmaline(HAL),harmine(HAR)and theirmetabolites in rats administered with total alkaloid extracts from Peganum harmala Linn(TAEP).METHODS Blood samples of rats orally administered with TAEP(140 mg/kg),or intravenously given mixedsolution of HAL and HAR (3.33 mg/kg),were collected at different times.The plasma concentrations of HAL,HAR and theirmetabolites harmol(HOL),harmalol(HAM)were determined by UPLCMS/MSmethod,and thus their pharmacokinetic pa-rameters were obtained.RESULTS Plasma levels of HAL,HAR,HOL and HAM could be detected in rats dosed with intravenousmixture of HAL and HAR or oral intaking of TAEP.The pharmacokinetics of HAL,HAR and HOL were determined except HAM,due to a failure in its plasma concentration drop at24 h.For the intravenous group,all the disposition parameterswere:t1/2eof of HAL,HAR and HOLwere2.554,3.116 and 1.899 h;MRT 1.700,1.311 and 1.880 h; and AUC0-tof 373.1,2033.0 and 8.914 ng.h/mL,respectively.For the group with oral administration of TAEP,the acquired parameterswere:Cmaxof HAL,HAR and HOL 347.6,184.5 and 32.7 ng/mL; Tmax3.200,1.150 and 0.300 h; t1/2e:6.994,5.625 and 21.912 h; MRT 8.588,9.791 and 27.780 h; AUC0-t2755.5,1202.8 and 129.8 ng.h/mL,respectively.The absolute bioavailability of HAL and HAR were 63.22%and 4.96%after oral administration,respectively.CONCLUSION HAL and HAR from oral intakes of TAEP could be quickly absorbed and rapidlymetabolized,and HAL displayed a higher bioavailability value than HAR.The metabolites(HOL and HAM)are eliminated more slowly than the prototypes(HAL and HAR).In addition,the initial plasma concentration of HAR is significantly higher than HAL in intravenous use.
Peganum harmala L.; alkaloid extracts; harmine; harmaline; metabolites; pharmacokinetics
R969.1
:A
:1001-1528(2014)06-1169-07
10.3969/j.issn.1001-1528.2014.06.013
2014-02-11
国家自然基金-新疆联合基金重点项目 (U1130303), 国家自然基金项目 (81173119), 国家 “重大新药创制” 科技重大专项 (2012ZX0910320-051), 上海市优秀学术带头人计划资助项目 (13XD1403500), 宁波市自然科学基金资助项目 (2013A610207)
史小媛 (1988—), 女, 硕士生, 研究方向: 药物制剂与体内过程。 Tel:(021)51322511,E-mail:Sxy1988916@163.com
*通 信作 者: 王 长虹 (1964 —), 男, 研究 员, 博 士 生 导 师, 研 究 方 向: 中 药 新 制 剂 与 体 内 过 程 研 究。 Tel:(021)51322511,E-mail: wchcxm@hotmail.com

