小柴胡汤对2型糖尿病小鼠的作用研究
小柴胡汤对2型糖尿病小鼠的作用研究
齐密霞1,宁花兰2,杨艳芳3,吕丽燕4,贺敬波1
(深圳市宝安区人民医院 1.中医科;2皮肤科;3功能科,深圳 518101;4.深圳市第五人民医院,深圳 518100)
目的 研究小柴胡汤对2型糖尿病小鼠的影响,并探讨其作用机制。方法采用高脂饲料喂养并腹腔注射链脲佐菌素建立2型糖尿病小鼠模型,分别给予罗格列酮,小柴胡汤低、中、高剂量及等体积的0.9%氯化钠溶液。每周测定小鼠血糖,4周后进行口服糖耐量测试,6周后检测血清胰岛素、三酰甘油、总胆固醇、高密度脂蛋白、低密度脂蛋白。采用Western blot检测脂肪组织过氧化物酶体增殖物激活受体-γ(PPAR-γ)和葡萄糖转运蛋白-4(Glut-4)。结果小柴胡汤能显著降低小鼠血糖,改善口服糖耐量,并降低血清胰岛素水平;可显著降低小鼠低密度脂蛋白,升高高密度脂蛋白水平,但对总胆固醇和三酰甘油水平无影响;同时,小柴胡汤增加小鼠脂肪组织PPAR-γ和Glut-4水平。结论小柴胡汤能降低2型糖尿病模型小鼠的血糖,改善血脂紊乱,该作用可能与促进PPAR-γ和Glut-4水平、增加外周组织对胰岛素敏感性有关。
小柴胡汤;糖尿病,2型;降血糖;过氧化物酶体增殖物激活受体-γ;葡萄糖转运蛋白-4
2型糖尿病是以胰岛素抵抗和胰腺β细胞受损,外周组织对葡萄糖利用障碍为特征的代谢综合征,多在35~40岁之后发病,占糖尿病患者90%以上[1]。患者多以口服降糖药与食疗、运动相结合控制病情[2-4]。中药以其疗效确切、温和、无毒的特点,在治疗糖尿病方面具有悠久历史,已报道有多种中草药在降糖、调脂及其并发症方面发挥重要作用[5]。小柴胡汤在东汉张仲景著《伤寒杂病论》、《金匮要略》及《黄帝内经》中均有记载,由柴胡、人参、黄芩、半夏、甘草、生姜、大枣7味药组成,是和解少阳的代表方剂[6]。该方临床作用广泛,具有抗肝损害、抗炎、免疫调节等作用[7]。近年来,临床上通过加减此方,在糖尿病及其并发症治疗上获得良效,但作用机制尚不甚清楚[8]。笔者采用高脂饮食合并小剂量链脲佐菌素单次腹腔注射的方法建立2型糖尿病模型,研究小柴胡汤对2型糖尿病小鼠的作用,并通过检测过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptorγ, PPAR-γ)和葡萄糖转运蛋白-4(glucose transporter, Glut-4),探讨小柴胡汤降糖作用机制。
1 材料与方法
1.1 试剂与仪器 小鼠Glut-4单克隆抗体(Santa Cruz公司);小鼠PPARγ单克隆抗体(Santa Cruz公司);小鼠胰岛素ELISA试剂盒(eBioscience公司,美国);三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白(highdensity lipoprotein,HDL)、低密度脂蛋白(lowdensity lipoprotein,LDL)试剂盒(中生北控生物科技股份有限公司):JPS-5怡成血糖测定仪(北京怡成医疗器械有限公司),低温高速离心机(HermLe公司,德国),台式恒温振荡器(太仓华美生化仪器厂),AVE型半自动生化分析仪(爱威科技实业有限公司),MV-Ⅱ型双垂直板式电泳槽(大连竞迈生物科技有限公司),MK酶联免疫检测仪(Thermo公司,芬兰),高速冷冻离心机(HERMLE,德国)。
1.2 药物 小柴胡汤煎剂制备:柴胡24 g,黄芩9 g,清半夏9 g,甘草9 g,人参9 g,大枣12 g,购于深圳市第八人民医院门诊部中药房,加水300 mL浸泡30 min后煎煮40 min,去药渣,再煎煮40 min,60℃恒温浓缩成1 mL含生药2.5 g,4℃保存,使用前37℃水浴。
1.3 实验动物 雄性BALB/c小鼠,体质量20~22 g,由广东省医学实验动物中心提供,动物许可证号: SCXK(粤)2008-0002。
1.4 2型糖尿病动物模型的建立 雄性BABL/c小鼠,适应性喂养1周,随机分为空白对照组和模型组。其中空白对照组小鼠给予正常饲料喂养,模型组动物给予高脂饲料喂养(胆酸钠0.5%,胆固醇1%,猪油5%,蛋黄粉10%,基础饲料83.5%),连续8周。8周后,模型组动物一次性腹腔注射链脲佐菌素(streptozotocin,STZ)50 mg·kg-1,建立2型糖尿病模型。给予STZ 5 d后,选取血糖高于11.1 mmol·L-1的小鼠作为造模成功的糖尿病小鼠。
1.5 动物分组及给药 造模成功的糖尿病小鼠50只,随机分为5组:模型对照组、阳性对照组和小柴胡汤高、中、低剂量组,每组10只。另设空白对照组小鼠10只,与模型对照组小鼠具有相同周龄,给予普通标准小鼠饲料喂养。除空白对照组外,其余各组继续喂以高脂饲料直至实验结束。阳性对照组灌胃给予罗格列酮3.0 mg·kg-1·d-1,相当于临床用量10倍;小柴胡汤低、中、高剂量组分别按生药4,8,12 g·kg-1灌胃给药;空白对照组和模型对照组灌胃给予等量0.9%氯化钠溶液0.1 mL·(10g)-1。连续给药6周,qd。
1.6 口服糖耐量测试 给药4周后,小鼠禁食6 h,灌胃给予葡萄糖2 g·kg-1,分别在0,30,60,90,120 min采集小鼠尾静脉血,通过快速血糖测试仪测定小鼠血糖。
1.7 血清生化指标测定 给药6周后,测定小鼠体质量,禁食6 h,采集小鼠尾静脉血,通过快速血糖测试仪测定小鼠血糖。摘眼球取血,分离血清,-20℃冻存。检测血清LDL、HDL、TC、TG,采用半自动生化分析仪测定,结果以mmol·L-1表示。血清胰岛素测定按照ELISA试剂盒操作,结果以ng·mL-1表示。
1.8 脂肪组织中PPAR-γ和Glut-4测定 取脂肪组织100 mg,加细胞裂解液(radio immunoprecipitation assay,RIPA)1 mL提取蛋白,考马斯亮蓝法测蛋白质浓度。取样品蛋白50 μg,以SDS-PAGE电泳分离蛋白质,半干转移法将蛋白条带转移至硝酸纤维素(nitrocellulose filter membrane,NC)膜,脱脂奶粉37℃,封闭4 h后,依次加入鼠的单克隆PPAR-γ一抗(稀释度1∶1 000)、二抗(辣根过氧化物酶标记的羊抗鼠抗体,稀释度为1∶5 000),洗涤后用增强化学发光法(enhanced chemiluminescence,ECL)显像曝光。Glut-4检测方法同上。
1.9 统计学方法 用SPSS 11.3版统计软件进行统计学分析,采用均数±标准差(±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 小柴胡汤对2型糖尿病小鼠血糖的影响 与空白对照组相比,模型对照组小鼠血糖持续升高,且差异有统计学意义(P<0.05);小柴胡汤能明显降低糖尿病小鼠血糖,呈剂量依赖性,高剂量组血糖降低程度与阳性对照组相当。小柴胡汤对2型糖尿病小鼠的作用与文献报道对糖尿病人作用效果一致[8]。见图1。
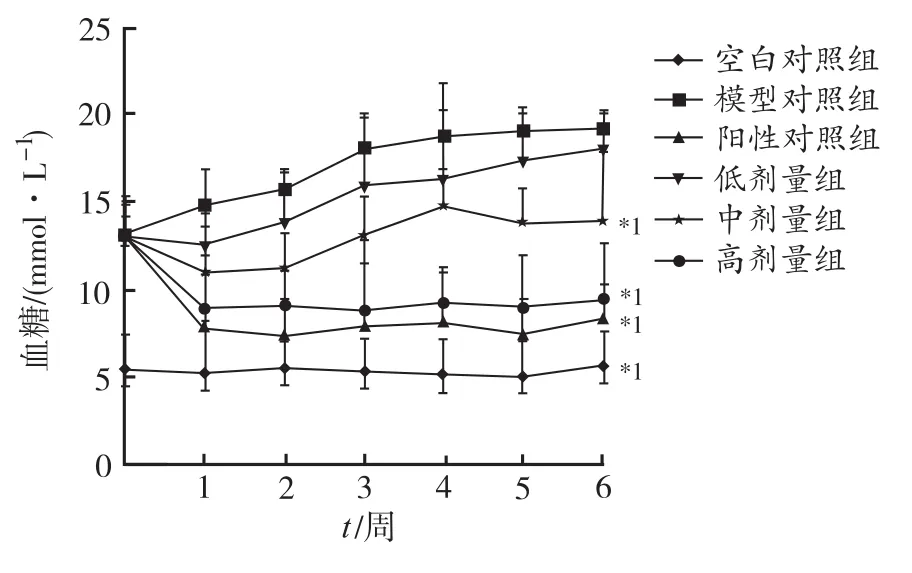
与模型对照组比较,*1P<0.05图1 小柴胡汤对2型糖尿病小鼠血糖的影响Compared with model control group,*1P<0.05Fig.1 Effect of xiaochaihu decoction on blood glucose in type 2 diabetic mice
2.2 小柴胡汤对2型糖尿病小鼠口服糖耐量的影响 给药4周后,进行口服糖耐量测试。与空白对照组比较,模型对照组在给予葡萄糖30 min,血糖显著升高;小柴胡汤组可迅速降低30和60 min的血糖水平,该结果提示小柴胡汤可改善糖耐量。见图2。
2.3 小柴胡汤对2型糖尿病小鼠血清生化指标影响
2型糖尿病患者因外周组织对胰岛素敏感性降低导致血清胰岛素升高。本研究中,2型糖尿病小鼠在实验结束时血清胰岛素水平高于空白对照组(P<0.05)。给予小柴胡汤后,高剂量组血清胰岛素含量明显降低,表明其能改善动物高胰岛素血症状态,减轻胰岛β细胞的负担,从而间接对胰腺β细胞具有保护作用。但与模型对照组比较,低、中剂量组对血清胰岛素的作用差异无统计学意义(P>0.05)。此外,给予小柴胡汤6周后,能升高HDL水平,降低LDL水平,高剂量组与模型对照组比较差异有统计学意义(P<0.05)。但对TC及TG无明显作用。见表1。

与模型对照组比较,*1P<0.05图2 小柴胡汤对2型糖尿病小鼠口服糖耐量的影响Compared with model control group,*1P<0.05Fig.2 Effect of xiaochaihu decoction on OGTT in type 2 diabetic mice
2.4 小柴胡汤对2型糖尿病小鼠脂肪组织PPAR-γ和Glut-4的影响 为评价小柴胡汤降糖作用机制,进一步采用Western blot检测脂肪组织中PPAR-γ和Glut-4的含量,结果如图3。与空白对照组相比,模型对照组脂肪组织中PPAR-γ和Glut-4含量显著降低。而小柴胡汤各给药组剂量依赖性增加PPAR-γ和Glut-4的含量,且高剂量组更明显。

A.电泳图;B.柱形图;与模型对照组比较,*1P<0.05图3 小柴胡汤对2型糖尿病小鼠PPAR-γ和Glut-4的影响A.electrophotogram;B.histogram;comparedwithmodel control group,*1P<0.05Fig.3 Effect of xiaochaihu decoction on PPAR-γ and Glut-4 in type 2 diabetes mice
3 讨论
2型糖尿病的主要发病机制涉及胰岛素抵抗和胰岛β细胞受损,表现为外周组织尤其是肌肉、脂肪组织对葡萄糖的利用障碍[9]。本研究采用高脂饮食诱发胰岛素抵抗状态,降低外周组织对胰岛素的敏感性;同时采用低剂量STZ造成轻度胰岛β细胞受损,血糖升高。该模型表现为血糖进行性升高,糖耐量异常,血脂代谢紊乱,与文献报道一致[10]。小柴胡汤在临床上治疗糖尿病患者具有良好的效果,其在降低血糖的同时,可改善糖尿病患者肝气郁结症和胃功能紊乱等糖尿病综合征。因此,本研究在临床实践的基础上,研究小柴胡汤对STZ与高脂膳食诱导的2型糖尿病小鼠的治疗作用。结果显示,小柴胡汤在高剂量时可改善口服糖耐量,降低胰岛素水平,从而有效控制血糖。
表1 小柴胡汤对血清生化指标的影响Tab.1 Effect of xiaochaihu decoction on serum biochemical indicators ±s

表1 小柴胡汤对血清生化指标的影响Tab.1 Effect of xiaochaihu decoction on serum biochemical indicators ±s
与模型对照组比较,*1P<0.05;与空白对照组比较,*2P<0.05Compared with model group,*1P<0.05;compared with blank control group,*2P<0.05
组别胰岛素/(ng·mL-1) LDLHDLTCTG (mmol·L-1)小柴胡汤低剂量组1.84±0.320.48±0.090.88±0.192.41±0.321.73±0.19中剂量组1.89±0.390.44±0.13*10.83±0.322.38±0.381.77±0.23高剂量组1.61±0.27*10.42±0.17*10.91±0.23*12.33±0.281.82±0.35阳性对照组1.59±0.24*10.40±0.13*10.97±0.18*12.10±0.29*10.92±0.09*1模型对照组1.91±0.22*20.49±0.10*20.82±0.13*22.39±0.43*21.93±0.14*2空白对照组1.27±0.120.35±0.121.10±0.092.18±0.310.88±0.11
2型糖尿病患者体内游离脂肪酸(free fatty acid, FFA)脂类升高导致β细胞胰岛素代偿功能进行降低, β细胞功能衰退,降低糖耐量,进一步加剧血糖紊乱[11]。本研究考察了小柴胡汤对血脂的作用,结果显示,在给予小柴胡汤6周后,糖尿病小鼠HDL升高, LDL降低,但对TC和TG无明显改善作用。HDL在血脂代谢过程扮演了重要的角色,其可将末梢组织游离胆固醇与血液循环中脂蛋白或与某些大分子结合从而运送至肝脏等组织,从而促进胆固醇的清除[12]。而在本研究中,在HDL升高的水平基础上,胆固醇等血脂指标并未显著降低,可能与实验周期过短有关。小柴胡汤对血脂的改善作用,可保护血管内皮细胞,降低2型糖尿病以微血管病变为特征的糖尿病综合征如糖尿病肾病。
此外,小柴胡汤在降低血脂的同时,可明显升高脂肪组织中PPAR-γ和Glut-4的水平。PPAR-γ为一类配体激活的核转录因子,在脂肪组织高表达,通过促进脂肪组织分化从而减少肥大脂肪细胞的数量,增加代谢活性有助于小脂肪细胞摄取葡萄糖,此外还可促进线粒体解偶联蛋白的表达,增强组织对葡萄糖的摄取,消耗能量从而改善胰岛素抵抗状态[13-14]。而Glut-4主要在骨骼肌和脂肪组织中表达,在胰岛素刺激下,通过胰岛素受体介导的胰岛素信号通路,使Glut-4通过易位作用转移至胞膜进而将葡萄糖转运至细胞中[15-16]。2型糖尿病患者Glut-4的表达降低,导致葡萄糖转运功能障碍是发生胰岛素抵抗的主要原因[17]。小柴胡汤通过增加PPAR-γ的表达,增加胰岛素敏感性,从而促进葡萄糖转运及代谢过程。除小柴胡汤本身可促进Glut-4的增加, PPAR-γ信号通路的激活同样可增强Glut-4的表达,从而促进葡萄糖的摄取,从而降低血糖。
综上所述,本实验结果证实小柴胡汤具有降低2型糖尿病小鼠的血糖、血脂作用。其降糖作用与增加PPAR-γ和Glut-4的表达有关,一方面促进游离脂肪的利用,增加外周组织对胰岛素的敏感性;另一方面促进葡萄糖的摄取,从而有效控制高血糖高血脂症状。
[1] CHEN L,MAGLIANO DJZIMMET P Z.The worldwide epidemiology of type 2 diabetes mellitus present and future perspectives[J].Nat Rev Endocrinol,2012,8(4):228-236.
[2] SAVOCA M R,MILLER CKLUDWIG D A.Food habits are related to glycemic control among people with type 2 diabetes mellitus[J].J Am Diet Assoc,2004,104(4): 560-566.
[3] BALDUCCI S,ZANUSO S,FERNANDO F,et al.Physical activity/exercise training in type 2 diabetes.The role of the Italian Diabetes and Exercise Study[J].Diabetes Metab Res Rev,2009,25(Suppl 1):S29-33.
[4] 胡洁,安富荣.西格列汀治疗2型糖尿病的临床研究进展[J].医药导报,2013,32(6):760-764.
[5] XIE W,ZHAO Y,ZHANG Y.Traditional Chinese medicines in treatment of patients with type 2 diabetes mellitus[J]. Evid Based Complement Alternat Med,2011,726723.
[6] 任灵贤.小柴胡汤问题的探讨[J].河北中医,2011,33 (3):398-403.
[7] 马蓉,汪宗仁.汉方传统制法与现代工艺结合研制小柴胡颗粒[J].中国药师,2009,12(12):1831-1833.
[8] 李明煜.小柴胡汤治疗糖尿病体会[J].河南中医,2003, 23(5):11-12.
[9] SPELLMAN C W.Pathophysiology of type 2 diabetes: targeting islet cell dysfunction[J].J Am Osteopath Assoc, 2010,110(3 Suppl 2):S2-7.
[10] SRINIVASAN K,VISWANAD B,ASRAT L,et al.Combination of high-fat diet-fed and low-dose streptozotocintreated rat:a model for type 2 diabetes and pharmacological screening[J].Pharmacol Res,2005,52(4):313-320.
[11] BODEN GSHULMAN G I.Free fatty acids in obesity and type 2 diabetes:defining their role in the development of insulin resistance and beta-cell dysfunction[J].Eur J Clin Invest,2002,32(Suppl 3):14-23.
[12] CHEHADE J M,GLADYSZ MMOORADIAN A D.Dyslipidemia in type 2 diabetes:prevalence,pathophysiology, and management[J].Drugs,2013,73(4):327-339.
[13] BERMUDEZ V,FINOL F,PARRA N,et al.PPAR-gamma agonists andtheirroleintype2diabetesmellitus management[J].Am J Ther,2010,17(3):274-283.
[14] JAY MAREN J.Peroxisome proliferator-activated receptor (PPAR)in metabolic syndrome and type 2 diabetes mellitus[J].Curr Diabetes Rev,2007,3(1):33-39.
[15] GANDHI G R,STALIN A,BALAKRISHNA K,et al.Insulinsensitization via partial agonism of PPARgamma and glucose uptake through translocation and activation of GLUT4 in PI3K/p-Akt signaling pathway by embelin in type 2 diabetic rats[J].Biochim Biophys Acta,2013,1830(1):2243-2255.
[16] CHANG L,CHIANG SHSALTIEL A R.Insulin signaling and the regulation of glucose transport[J].Mol Med,2004, 10(7-12):65-71.
[17] THONG F S,DUGANI CBKLIP A.Turning signals on and off:GLUT4 traffic in the insulin-signaling highway[J]. Physiology(Bethesda),2005,20:271-284.
DOI 10.3870/yydb.2014.04.006
Study on the Effect of Xiaochaihu Decoction on Type 2 Diabetic Mice
QI Mi-xia1,NING Hua-lan2,YANG Yan-fang3,LV Li-ya4,HE Jing-bo1
(1.Department of Traditional Chinese Medicine;2.Department of Dermatology;3.Function Division,the People's Hospital of Bao'an,Shenzhen 518101,China;4.The Fifth People's Hospital of Shenzhen City,Shenzhen 518100,China)
Objective To study the effect ofχiaochaihudecoction on type 2 diabetes and its underlying mechanism.MethodsType 2 diabetic mice was induced by high-fat-diet and a single intraperitoneal injection of streptozotocin.The mice were orally given rosiglitazone,low,middle or high dose ofχiaochaihudecoction,or 0.9%sodium chloride solution,separately. Blood glucose was detected every week.After treatment for four weeks,oral glucose tolerance test(OGTT)was determined. Serum insulin,total cholesterol(TC),triglyceride(TG),high-density lipoprotein(HDL),and low density lipoprotein(LDL) were tested after treatment for six weeks.Expression of peroxisome proliferator-activated receptor γ(PPARγ)and glucose transporter 4(Glut4)in adipose tissue was investigated by Western blotting.ResultsXiaochaihudecoction significantly increased blood glucose and decreased serum insulin levels,and improved OGTT in type 2 diabetic mice.Treatment ofχiaochaihudecoction also exhibited lower LDL,higher HDL,but not improving TC and TG.Expression of PPARγ and Glut4 in the adipose tissue was higher afterχiaochaihudecoction treatment.ConclusionXiaochaihudecoction has hypoglycemic and hypolipidemic effects in type 2 diabetic mice,which may be related to the higher expression of PPARγ and Glut4 in adipose tissue,and enhanced insulin sensitivity in peripheral tissues.
Xiaochaihudecoction;Diabetes,type 2;Hypoglycemic effect;Peroxisome proliferator-activated receptor γ; Glucose transporter 4
R286;R285.5
A
1004-0781(2014)04-0434-05
2013-07-17
2013-09-12
齐密霞(1976-),女,河北井陉人,主治医师,硕士,主要从中医内科、妇科临床工作。电话:(0)13823643695;E-mail:qimixia@aliyun.com。
贺敬波(1968-),男,湖北随州人,主任医师,博士,研究方向:中西医结合内科临床。电话:0755-27788311,E-mail:jingboh@21cn.com。

