木瓜蛋白酶制备山杏源降糖肽工艺优化研究
王 晟,崔 洁,顾 欣,张乔会,王建中
(北京林业大学生物科学与技术学院,北京100083)
糖尿病已经成为继肿瘤、心脑血管疾病之后的第三大人类杀手,其中多为Ⅱ型糖尿病[1],目前口服使用的阿卡波糖等降血糖药物存在着价格昂贵和有恶心呕吐等不良反应的缺陷[2]。具有降血糖功效的天然产物很好地弥补了这些缺陷,其中多为多糖类,如苦瓜多糖、桑黄多糖、地参多糖等[3-4]。多肽类降血糖产物也逐渐成为研究热点,已经有苦瓜肽、人参多肽、灵芝肽、鲨鱼肝肽等被证明有降血糖活性[5-9]。山杏仁含27%的蛋白质,氨基酸种类齐全,平衡合理,是一种优良的植物源蛋白质[10],榨油之后的山杏仁粕更是蛋白含量高达41.60%[11],而这些山杏仁粕却常常被直接丢弃,没能得到充分利用。木瓜蛋白酶具有耐高温、活性强、稳定性好等特点[12],在多肽研究中是一种常用的酶。刘雪峰[13]等的研究表明杏仁肽具有降血糖活性,但原料和所使用的酶都和本研究不一样。本研究使用木瓜蛋白酶水解脱脂山杏仁粕,探究制备具有降血糖活性的肽的工艺条件,为山杏仁粕的进一步开发利用奠定基础。
1 材料与方法
1.1 材料与设备
脱脂山杏仁粕 河北省平泉县;木瓜蛋白酶(50万 U/g)、α-葡萄糖苷酶、4-硝基苯-α-D-吡喃葡萄糖苷(PNPG)Sigma Chem.Co.;其余试剂 均为分析纯。
FD-1冷冻干燥机 北京德天佑科技发展有限公司;D-37520Osterode型冷冻离心机 Thermo Scientific;Model 680 Microplate reader酶标仪 BIORAD;HHS4型恒温水浴锅 上海浦东跃新科学仪器厂;PHS-25型pH计 上海精密科学仪器有限公司;气引式粉碎机 日本佑崎有限公司;SHZ-D循环水式多用真空泵 上海振捷实验设备有限公司。
1.2 实验方法
1.2.1 脱脂 将脱脂山杏仁粕粉碎后用石油醚浸泡,每天更换石油醚反复多次直至脱脂彻底。抽滤除去石油醚后,置于通风橱中静置晾干,过80目筛,于4℃保存备用。
1.2.2 蛋白质的提取 碱提酸沉法提蛋白[14],具体工艺流程如下:脱脂山杏仁粉→碱提(液料比14∶1,37℃,60min,pH9.0)→离心(4000r/min,20min)→上清液→酸沉(pH4.1)→离心(5000r/min,15min)→沉淀→复溶(调pH至中性)→冷冻干燥→山杏仁蛋白粉
1.2.3 酶解条件
1.2.3.1 单因素实验 在其他条件一定的情况下,分别对 pH(5、6、7、8、9)、酶解时间(1、2、3、4、5、6、7、8h)、温度(40、45、50、55、60℃)、加酶量(1%、2%、3%、4%、5%、6%)、料液比(1、3、5、7、9)进行单因素实验,基本条件为pH7.0,时间6h,温度50℃,加酶量3%,料液比5%,每个实验重复3次。
1.2.3.2 响应面法实验 在单因素实验的基础上,使用Design-Expert 7.1.5软件,根据Box-Behnken中心组合实验设计原理[15],设计四因素三水平的响应面实验,以对α-葡萄糖苷酶抑制活性为指标,对酶解条件进行优化。因素水平表见表1。
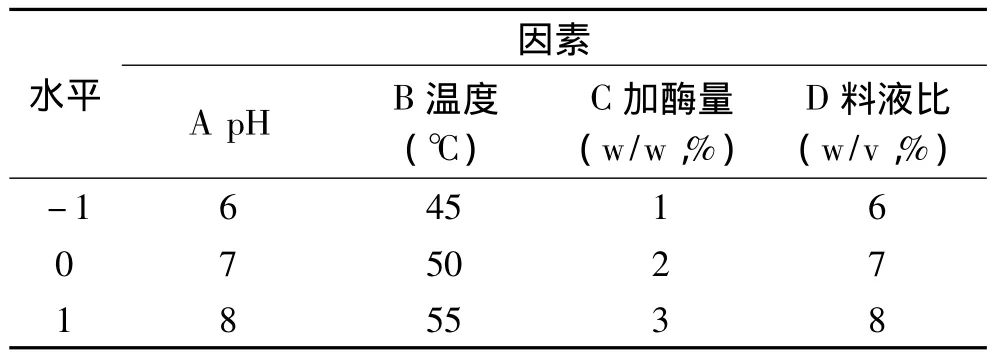
表1 响应面分析因素及水平表Table 1 Analytical factors and levels for Box-Behnken
1.2.4 α-葡萄糖糖苷酶抑制率的测定 采用分光光度法进行测定,以PNPG为底物,通过α-葡萄糖苷酶酶解反应会释放出硝基苯酚,在400nm处有最大吸光度,可以根据这一特性测定样品对α-葡萄糖苷酶的抑制活性[16]。
配制25mg/mL的α-葡萄糖苷酶溶液、0.5mol/L的磷酸盐缓冲液(pH6.7)和0.9133mg/mL的PNPG,在96孔酶标板每个小孔中依次加入缓冲液、样品溶液、PNPG和酶溶液,混匀后在37℃条件下反应1h,然后加入50μL碳酸钠溶液(0.67mol/L)终止反应,在400nm下用酶标仪测定吸光度值。测定反应体系如表2所示。
抑制率计算公式为:
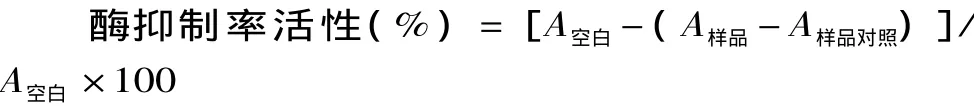
其中,A空白、A样品、A样品对照分别为空白组、样品组和样品对照组对应的吸光度值。
2 结果与分析
2.1 单因素实验
2.1.1 酶解时间对产物活性的影响 酶解时间对产物α-葡萄糖苷酶的抑制率影响如图1所示。从图1可以看出,产物对α-葡萄糖苷酶的抑制活性在6h时达到最高点,比3~5h的产物抑制率提高了1.5%左右(p<0.01)。6h后抑制活性呈下滑趋势。这可能是由于在底物蛋白中包含可溶性蛋白和不溶性蛋白,可溶性蛋白水解时,最初阶段敏感性肽键快速断裂,不敏感肽键后来断裂;在不溶性底物蛋白的酶水解中,酶吸附在不溶性蛋白表面,首先水解稀疏结合的不溶性蛋白上的聚合肽,然后再慢慢水解中心的肽键[17]。6h后活性肽被过度酶解,结构遭到破坏所致。因此,木瓜蛋白酶最佳酶解时间应控制在6h左右。
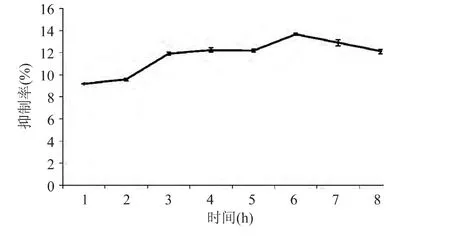
图1 时间对产物活性的影响Fig.1 Effect of time on the inhibition ratio
2.1.2 pH对产物活性的影响 pH对产物α-葡萄糖苷酶的抑制率影响如图2所示。从图2可以看出,pH为7时酶解产物对α-葡萄糖苷酶的抑制活性达到最高点。pH小于7或大于7时,酸碱条件会影响酶的活性和底物的构象[18]。因此,木瓜蛋白酶酶解工艺的最佳pH应在7左右。
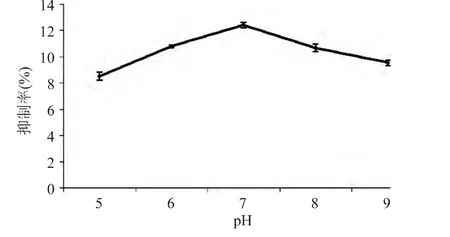
图2 pH对产物活性的影响Fig.2 Effect of pH on the inhibition ratio
2.1.3 温度对产物活性的影响 温度对产物α-葡萄糖苷酶的抑制率影响如图3所示。由图3可知,温度为50℃时,酶解产物的抑制活性达到最高,温度继续升高,酶的活性受到抑制,即有活性的酶减少,影响酶解速度。因此,在本实验条件下,酶解温度选择50℃左右。
2.1.4 加酶量对产物活性的影响 加酶量对产物α-葡萄糖苷酶的抑制率影响如图4所示。由图4可知,加酶量为2%时,酶解产物的抑制活性达到最高点,高于2%时,酶含量较高,但因为底物相对较少,产物抑制活性不会再增加。在本实验条件下,最佳加酶量选择2%。
2.1.5 料液比对产物活性的影响 料液比对产物α-葡萄糖苷酶的抑制率影响如图5所示。由图5可知,料液比在7%时,产物的抑制活性达到最高点,大于7%后,抑制率反而呈下降趋势。这可能是因为植物蛋白中含有植物蛋白酶抑制剂,能与蛋白酶作用与底物共享蛋白酶的结合基团,表现出竞争性抑制作用[18]。因此,最佳料液比选择7%。

表2 α-葡萄糖苷酶抑制率检测反应体系的组成Table 2 The composition of α-glycosidase enzyme inhibition testing system
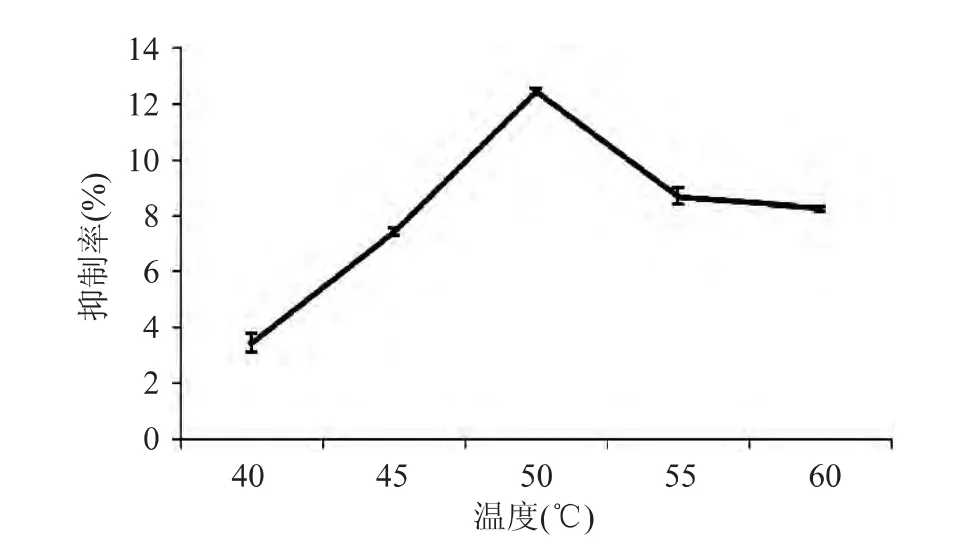
图3 温度对产物活性的影响Fig.3 Effect of temperature on the inhibition ratio

图4 加酶量对产物活性的影响Fig.4 Effect of enzyme amount on inhibition ratio
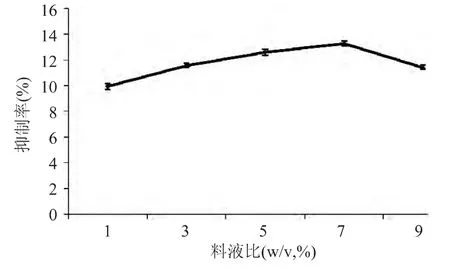
图5 料液比对产物活性的影响Fig.5 Effect of sample to solution ratio on inhibition ratio
2.2 响应面法对酶解工艺的优化
2.2.1 响应面分析结果 依据设计结果进行响应面实验,结果见表3。
采用Design-Expert 7.1.5软件程序对实验数据进行二次多元回归拟合,分析结果得出木瓜蛋白酶酶解山杏蛋白的回归方程为:

对上述回归模型进行方差分析,分析结果见表4。结果表明模型是极显著的(p<0.0001),回归方程的决定系数是0.9889,说明该模型能够解释98.89%的变化,因此可以用此模型对该实验进行分析和预测。一次项中,A、B、C 影响极显著,平方项 A2、B2影响极显著,而交互项的影响相对较小。各因素对酶解所得山杏肽活性影响的大小顺序为:pH>温度>加酶量>料液比。
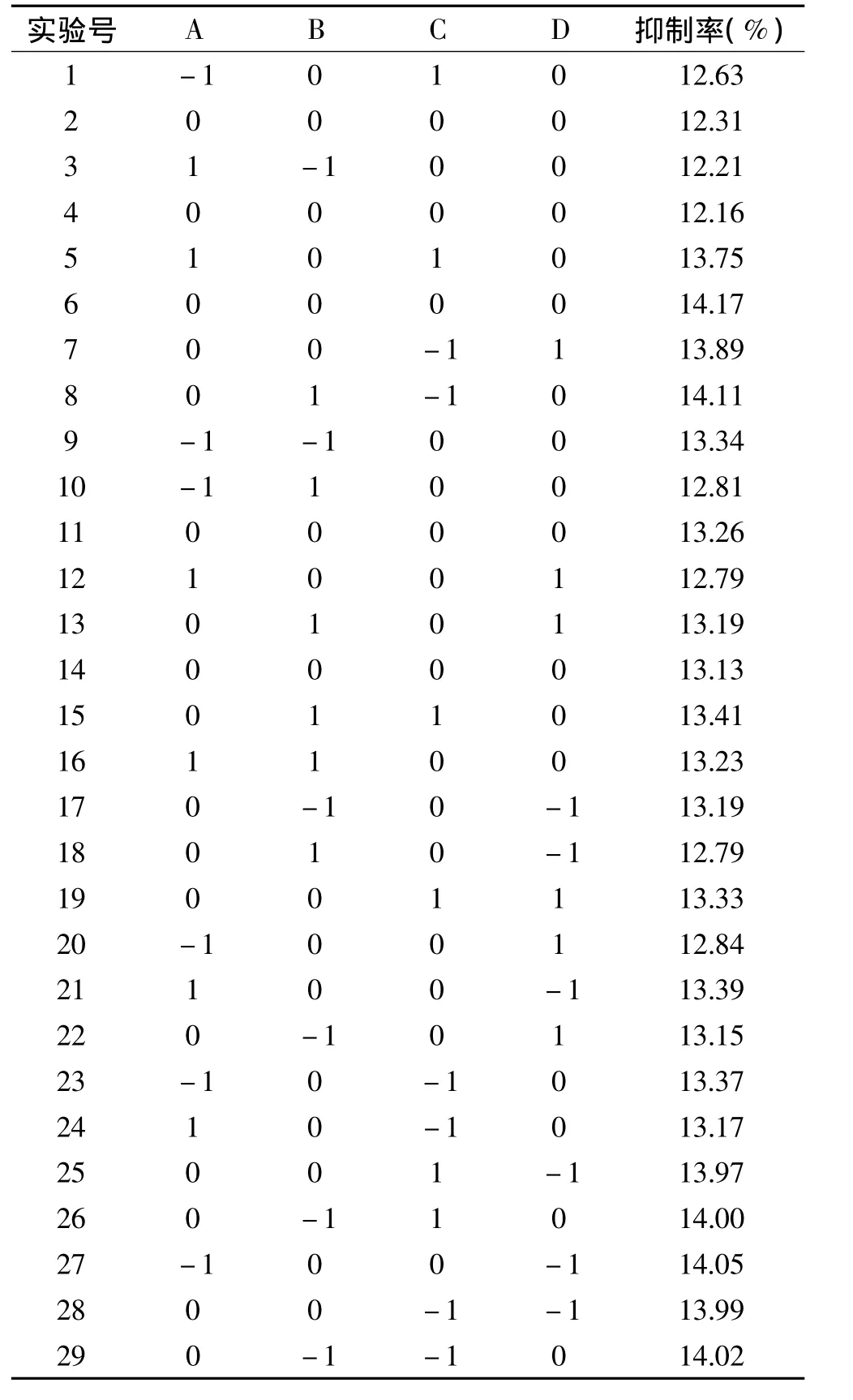
表3 响应面实验结果Table 3 Results of Box-Behnken
2.2.2 响应面分析 根据回归方程,作出响应面图,见图6~图11。

图6 pH与温度的交互作用影响的响应曲面Fig.6 Responsive surfaces of pH and temperature
考察响应曲面,可以进一步得出结论,四个因素中对酶解液降糖活性影响最大的是pH,温度次之,加酶量和料液比的影响较小,四个因素之间的交互影响较小。
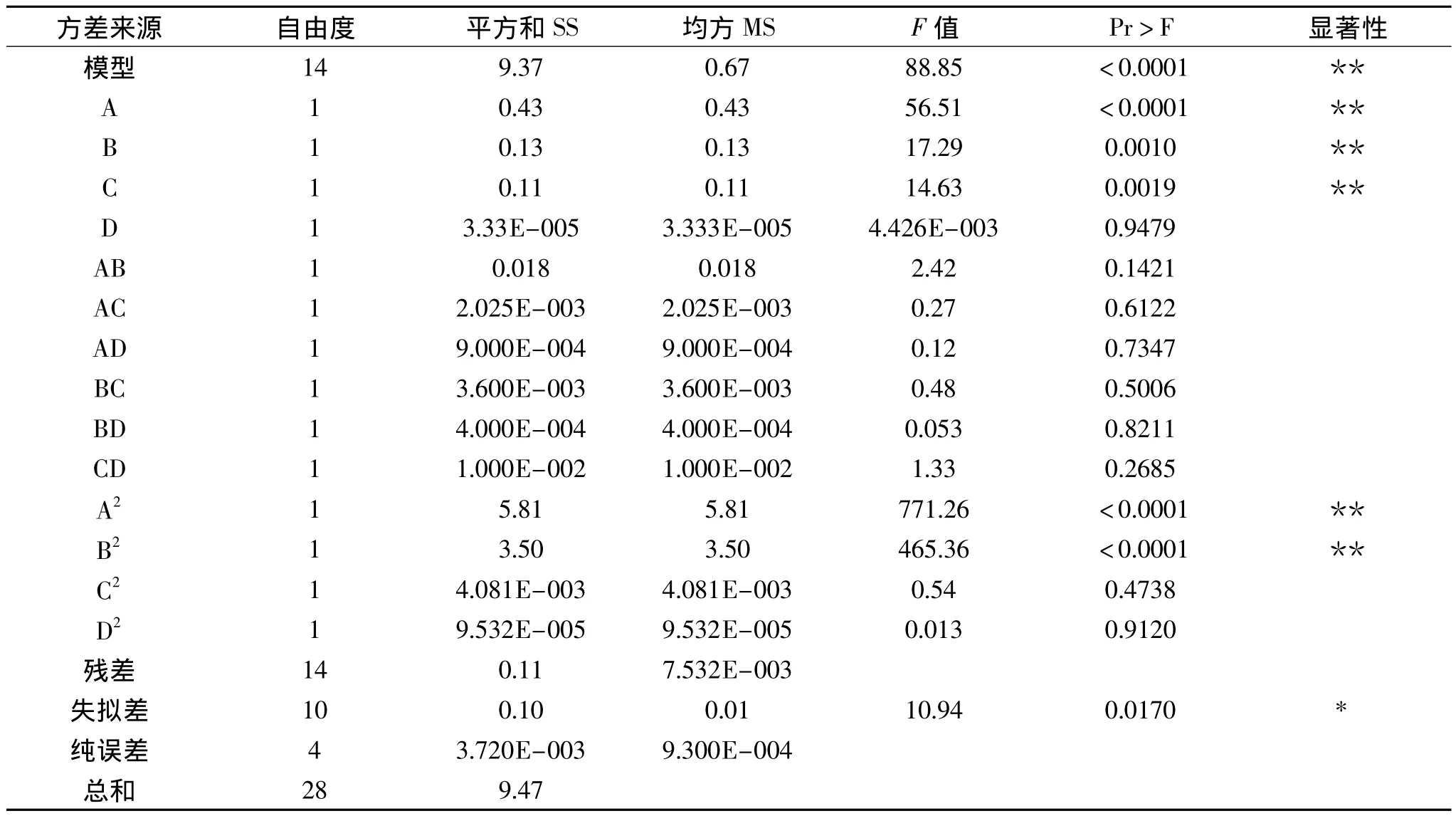
表4 响应面回归模型方差分析Table 4 ANOVA for response surface quadratic model
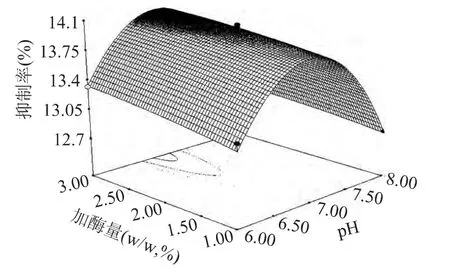
图7 pH与加酶量的交互作用影响的响应曲面Fig.7 Responsive surfaces of pH and enzyme amount
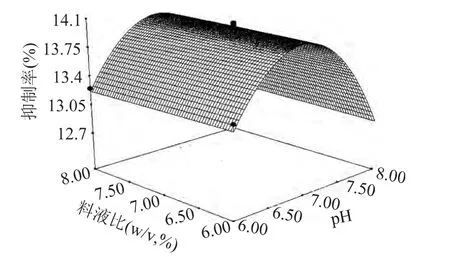
图8 pH与料液比的交互作用影响的响应曲面Fig.8 Responsive surfaces of pH and sample to solution ratio
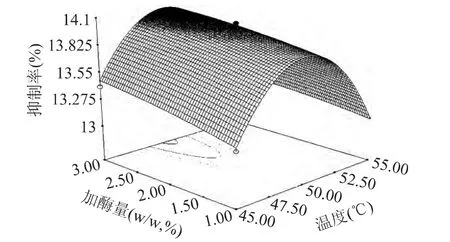
图9 温度与加酶量的交互作用影响的响应曲面Fig.9 Responsive surfaces of temperature and enzyme amount
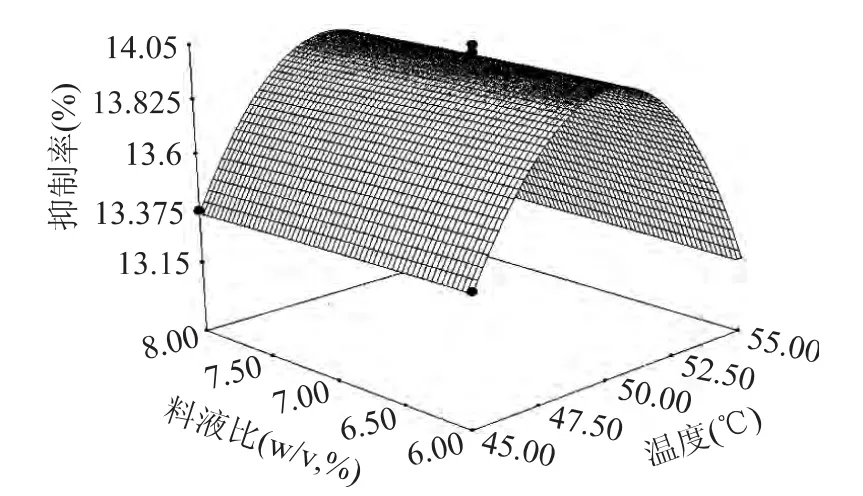
图10 温度与料液比的交互作用影响的响应曲面Fig.10 Responsive surfaces of temperature and sample to solution ratio
2.2.3 最佳酶解工艺条件的确定 为了确定最佳工艺条件,利用软件对工艺条件进行优化,得到的山杏肽最佳酶解条件为:pH6.88,温度49.49℃,加酶量3%,料液比6,在此条件下,产物抑制活性的预测值为14.15%。为了实际操作方便,将酶解工艺条件修正为:pH7,温度50℃,加酶量3%,料液比6。在此条件下进行三次平行实验,求平均值得到酶解产物对α-葡萄糖苷酶的抑制活性为14.22%,高于预测值0.07%。将此条件下得到的酶解液冻干,测定其IC50值,结果为0.08g/mL。证明响应面法对木瓜蛋白酶酶解山杏仁蛋白制备α-葡萄糖苷酶抑制肽条件的优化结果准确可靠,有实用价值。
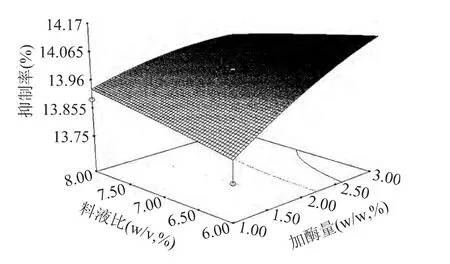
图11 加酶量与料液比的交互作用影响的响应曲面Fig.11 Responsive surfaces of enzyme amount and sample to solution ratio
3 结论
在单因素实验的基础上,利用响应面法优化木瓜蛋白酶酶解山杏仁蛋白制备α-葡萄糖苷酶抑制肽的工艺参数,获得的最佳工艺条件为:pH7,温度50℃,加酶量3%,料液比6,在此条件下产物的抑制率为14.22%。
植物蛋白的天然成分对疾病有着独特的功效却没有人工合成药物的副作用[19],本实验还可以进行进一步的深入研究:对酶解产物进行分离纯化、结构鉴定,以得到已知结构的纯品;还可以对产物进行产品开发,如功能性饮料等。
[1]Lefèbvre P.Diabetes yesterday,today and tomorrow.The action of the International Diabetes Federation[J].Rev Med Liege,2005,60(5-6):273-277.
[2]晏黎,田静.降糖药物的研究进展[J].中国医药导报,2008,5(2):22-24.
[3]冯潍,李娜娜,许继敏,等.天然活性多糖的降血糖机制研究[J].科技信息,2012,12(34):152-153.
[4]高启禹,徐光翠,仇云鹏.山药多糖对四氧喀吮致糖尿病小鼠血糖和血脂的影响[J].黑龙江畜牧兽医,2011(7):136-137.
[5]王莹,徐秀林,朱乃硕.生物活性肽降血糖功能研究[J].食品科学,2012,33(9):341-344.
[6]李国荣.蚕蛹降糖多肽的制备及活性表征[D].西安:陕西师范大学,2012.
[7]盛清凯.苦瓜降糖多肽-P的分离纯化及降糖机理研究[D].无锡:江南大学,2005.
[8]田应娟.啤酒糟多肽的分离纯化及降血糖活性的研究[D].广州:华南理工大学,2011.
[9]袁晓晴.癞葡萄降血糖肽的制备及其降糖机理研究[D].无锡:江南大学,2007.
[10]李科友,史清华,朱海兰,等.苦杏仁主要营养成分研究[J].西北农业学报,2003,12(2):119-121.
[11]宋曰钦,王建中,赵云霞,等.苦杏仁蛋白开发利用的前景[J].中国农学通报,2006,22(1):68-70.
[12]乙尹,陈平,王茜.木瓜蛋白酶应用开发的性质研究[J].贵州师范大学学报,1998,16(4):17-20.
[13]刘雪峰,李磊,闫文亮,等.杏仁多肽的降血糖活性研究[J].内蒙古农业大学学报,2010,3(2):2004-2008.
[14]顾欣,李莉,侯雅坤,等.响应面法优化山杏仁蛋白提取工艺研究[J].河北林果研究,2010,25(2):162-168.
[15]张润楚,郑海涛,兰燕,等.实验设计与分析及参数优化[M].北京:中国统计出版,2000:381-382.
[16]周琳娜.杜仲叶的发酵及其α-葡萄糖苷酶抑制活性[D].北京:北京林业大学,2012.
[17]侯雅坤,王晟,黄昆,等.核桃蛋白酶解工艺优化与酶解液抗氧化活性分析[J].食品与发酵工业,2012,38(4):99-103.
[18]刘萍,陈黎斌,杨严俊.酶解玉米蛋白制备降血压肽的研究[J].食品工业科技,2006,27(5):117-122.
[19]鲁军,任迪锋,王建中,等.螺旋藻源血管紧张素转化酶抑制肽的纯化和鉴定[J].生物化学与生物物理学进展,2010,37(5):568-574.

