土壤溶液性质对Zn的形态变化及其微生物毒性的影响
田昕竹 ,陈世宝 ,王学东 ,林 蕾 (.首都师范大学资源环境与旅游学院,北京 00048;.中国农业科学院农业资源与农业区划研究所,北京 0008)
大量研究表明[1-2],土壤中重金属的生物毒性不仅与其总量有关,更大程度上取决于其形态分布特征.进入土壤中的锌(Zn)按其存在形态可分为有机态 Zn和无机形态 Zn,其中,无机态锌包括代换态、矿物结合态及土壤溶液中的自由Zn2+等.不同结合形态的Zn在不同性质土壤中含量有很大差异,且不同形态的Zn之间可以相互转化.对大多数酸性土壤而言,交换态 Zn含量较高,无定形铁结合态较低;而中性土壤中有机结合态Zn及无定形铁结合态Zn含量较高;而石灰性土壤则以碳酸盐结合态、无定形铁结合态及松结有机态含量较高[2-4].资料表明,进入土壤中的锌大约90%以上为硅铝酸盐矿物态和氧化铁结合态形式存在,而自由离子态和交换态含量之和不足10%[5].影响土壤中Zn形态分布的因素很多,包括进入土壤中的Zn来源、数量及种类;土壤理化性质如pH值、Eh、土壤质地、阳离子交换量;土壤中胶体种类、数量及溶液离子组成等[2,5-6].
在土壤溶液中,相对其他金属离子形态,自由Zn2+更易被植物吸收而产生植物毒性[7].土壤中金属离子与可溶性有机碳化合物(DOC)的络(螯)合过程导致金属离子的生物有效性降低.目前,为了研究自由金属离子对生物体毒害的影响,在测定溶液中金属离子形态时,建立了以自由离子活度为基础的模型-自由离子活度模型(FIAM)[8].自由离子是金属生物有效性/毒性的重要离子形态[9],但是该模型仅仅基于自由离子活度,而忽视了溶液其他形态的离子对生物毒性的贡献,如Ca2+, Mg2+, Fe2+, K+, Na+, H+,, Cl-, HCO3-等对生物受体位点上离子的竞争[10].而在 Zn的生物毒性研究中,已有研究证明H+、Mg2+和K+可以减少 Zn毒害的作用[11];但针对溶液的物理化学性质及其阴离子组成对土壤中Zn的生物毒性的影响还鲜见报道.本研究利用基础诱导硝化(SIN)作为测试终点,分别利用离子色谱和 WHAM6.0模型对土壤溶液的主要离子含量特征及自由Zn2+进行测定,对不同性质土壤的溶液性质及其阴离子组成与土壤Zn的微生物毒性间的相互关系进行了研究,以期为 Zn污染土壤的环境风险提供参考依据.
1 材料与方法
1.1 供试土壤及处理
根据我国地带性土壤分布特征,采集了全国范围内 12个不同地区的地带性耕层土壤(0~20cm).所有土样经室内风干后剔除植物残体、根系、石块等杂物,然后过2mm尼龙筛后备用,土壤基本理化性质见表1.
按照预备实验的结果,向不同 pH值的土壤添加不同浓度的Zn(ZnCl2母液)制备成二份不同浓度 Zn污染的土壤,一份用于微生物毒性测定,另外一份用于土壤溶液提取.具体添加浓度为:pH<4.5:0, 50, 100, 200, 400, 600, 800,1000mg/kg;pH 4.5~7.0:0, 100, 200, 400, 600, 800,1200, 1600mg/kg;pH > 7.0:0, 200, 400, 600, 800,1200, 1600, 2400mg/kg. 添加方法为:按照每种土壤的 70%最大田间持水量(WHC)分别向1000g土壤中喷施不同体积ZnCl2的母液,充分搅拌均匀,平衡2周后分成2份,使用原子吸收分光光度计测定土壤中 Zn的准确含量,以标准土壤(GSS-6)进行测定质量控制[12].
1.2 土壤微生物毒性测定
土壤微生物毒性常用测定方法包括基础诱导呼吸(SIR)及基础诱导硝化(SIN)等,而根据前期实验结果,SIN测试方法对土壤中重金属微生物毒性具有较高的敏感性. 对不同Zn污染土壤潜在硝化速率的测定参考文献方法进行[6,13]:称取不同Zn处理土壤7.0g于50mL塑料离心管中进行微宇宙培养,管号为1、2、3号,培养条件为黑暗,通风,(20±2)℃恒温,14d 预培养后,利用SAN++连续流动分析仪(SKALAR 公司,荷兰)测定1号样品中和.剩下2号、3号样品添加0.5mL 0.044M (NH4)2SO4,继续培养7d,培养结束,添加 KCl溶液、振荡、离心,测定、含量,并将平均值记为N2.
土壤基础诱导硝化(SIN)的计算方法如式(1):
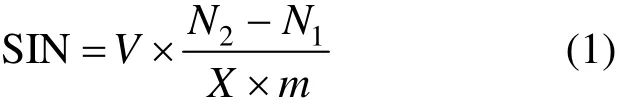
式中:SIN为基础诱导硝化速率,mgN/(kg·d);V为KCl的体积, mL;m为土壤样品的质量, g;N2和Nl均为土壤N的含量, mg/L.
1.3 土壤溶液离子测定
土壤溶液的提取按照以下方法进行[14]:称取不同Zn处理土壤20g于垫有玻璃棉的过滤针筒中,添加 100%的土壤田间最大持水量后,将装有不同处理土壤的针筒,放入底部有PVC圆圈的50mL离心管中,平衡24h后,于4500r/min离心15min,将滤液通过0.22µm的滤膜后,放置冰箱中待测.
土壤溶液中离子测定方法[15]:使用850离子色谱仪,用英蓝超滤前处理技术,用 Metrosep A Supp 5-250色谱柱,淋洗液采用 Na2CO33.2mmol/L+1.0mmol/L NaHCO3,定量环 20μL,流速 0.7mL/min,采用 919自动进样器进样进行溶液阴离子测定.本实验土壤溶液的离子测定是按照标准方法配制一系列标准溶液,然后在上述色谱条件下进行测定,以不同吸收峰面积对离子浓度做回归后,得到F-, Cl-,B-,,,等6种阴离子和Li+,Na+,K+,Ca2+,Mg2+5种阳离子的线性范围和相关系数.由于篇幅限制,本文只讨论了溶液中阴离子(F-, Cl-,B-,,,)的含量及其对Zn形态的影响,溶液阳离子(Li+,Na+,K+,Ca2+,Mg2+)的测定与影响结果没有列出.
1.4 溶液中自由Zn2+含量测定
目前,测定溶液中自由离子方法较多,而稳态数学模型仍然是测定离子形态分布最常用的手段.在进行溶液中金属离子浓度测定时,WHAM(Windermere Humic Aqueous Model)是计算金属离子与可溶性有机碳(DOC)络合的最常用模型软件.本实验中,土壤溶液自由Zn2+含量测定采用WHAM 6.0模型进行计算.在利用WHAM模型进行自由 Zn2+浓度[p(Zn2+)]计算中,由于实验属于开放系统,溶液 CO2浓度采用 3.5×10-4标准大气压进行计算.在溶液中自由Zn2+含量测定时,输入溶液pH值、OC及其他离子浓度包括Na+,K+,Ca2+,Mg2+,F-,Cl-,B-,,等进行模型计算.
1.5 数据的处理
土壤 Zn对微生物毒性的剂量-效应曲线采用逻辑斯蒂克分布模型(Log-logistic distribution)进行拟合[16],logistic回归模型是目前应用最广泛的分类模型之一,主要用来预测离散因变量与一组解释变量之间的关系,见式(2)
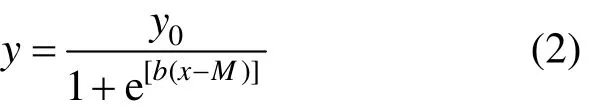
式中:y为各不同 Zn处理土壤的 SIN与对照的SIN 的比值,即相对基础诱导硝化速率(%),y0、b为拟合的参数,x为土壤中Zn浓度值, mg/kg;M为ECx的自然对数值.方程通过Sigmaplot10.0软件来进行拟合,所拟合的曲线来预测基础诱导硝化速率的EC50和EC10值.EC50和EC10分别为硝化速率降低至未污染土壤的一半和 10%时土壤中锌的浓度.
当土壤中低浓度Zn对微生物毒性产生低剂量刺激效应时,采用Schabenberger等[17]的低剂量毒物刺激效应(hormesis)曲线拟合,通过Tablecurve 2D V5.01软件来完成,见式(3):
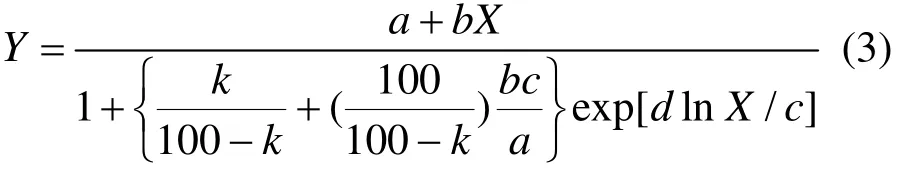
式中:Y是不同Zn处理土壤的相对潜在硝化速率, %;X是Zn的浓度, mg/kg;a、b、c、d是方程参数.当k为 10、50时,参数c定义为 EC10及EC50.
论文其他它数据采用Excel 2003、SPSS16.0进行方差分析,采用新复极差分析法P<0.05.
2 结果与讨论
2.1 土壤溶液性质及离子组成分析
本实验将采集的12种不同性质土壤,按照文献[14]方法提取了不同土壤溶液,并对土壤溶液进行基本物理化学性质的测定和离子含量分析.测定结果表明,土壤溶液的 pH值范围为 4.21~7.85,土壤溶液的电导值范围为 31~322µS/cm,土壤阳离子交换量为 6.36~28.81cmol+/kg,有机碳含量为0.62%~2.46%(表1),上述土壤理化性质代表了我国大部分地带性土壤基本特征.
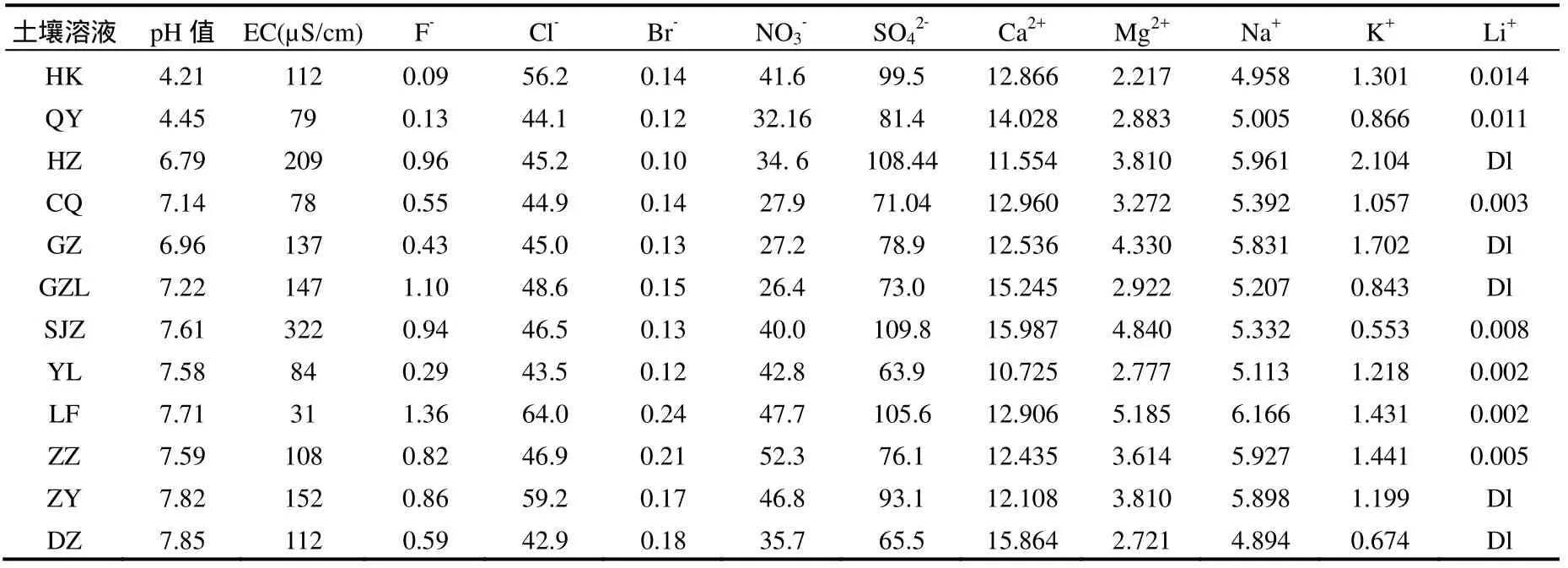
表2 土壤溶液理化性质及阴离子含量(mg/L)Table 2 Basic properties and anion contents of the soil solutions (mg/L)
土壤溶液的离子组成在一定程度上影响了Zn的形态特征及其生物有效性.实验结果见表2.由表2可见,相对于其他4种阴离子,土壤提取液中F-、Br-含量均较低,其中只在一个样品中检出(结果没有列出),在检测的 6种常见阴离子中,含量较高,变化从 63.9~109.8mg/L.土壤溶液中,F-,Cl-,,的来源主要有两个方面,一个是土壤母质发育来源,另一个是农田土壤中肥料中所带入的副成分或转化物.土壤中的离子含量过高,容易导致土壤次生盐渍化和盐害,造成农作物减产.在不同土壤溶液的5种阳离子中,总体而言,Ca2+含量最高,含量范围为 10.725~15.987mg/L,而 Li+最低;不同阳离子含量基本顺序是Ca2+>Na+>Mg2+>K+>Li+.
2.2 基于SIN测试的土壤中Zn的毒性阈值
从图1可见,随着土壤中Zn浓度的增大,12种不同土壤的相对基础诱导硝化速率均呈阶梯状降低.当土壤中 Zn浓度相对较低(<800mg/kg)时,SIN降低缓慢,而随着土壤中 Zn浓度的增加,SIN急剧下降,Zn浓度较高时,SIN降低又趋缓慢,这一结果表明,土壤中硝化细菌对中等 Zn浓度毒性比较敏感,而随着Zn浓度的增加,Zn对土壤中硝化细菌的毒害进一步加剧. Zn是生物体微量元素之一,但吸收过量的 Zn则会产生毒害作用.土壤微生物富集过量 Zn后,Zn2+与微生物体内带负电荷的核酸结合引起染色体畸变,降低DNA和RNA活性,干扰核酸代谢;影响蛋白质活性而产生生理毒性[15].在测试的 12种土壤中,有83.3%的土壤 Zn添加浓度达到 EC90.在不同 Zn处理中,基于SIN测定的不同土壤Zn毒性阈值间有显著差异,EC50值变化从 195.9mg/kg至1310.2mg/kg;EC10值从 47.7mg/kg增加至681.8mg/kg,不同土壤EC50与EC10的最大值与最小值的比例分别达到了6.68及14.3倍,这一结果表明土壤性质对土壤中Zn的微生物毒性有非常显著的影响.
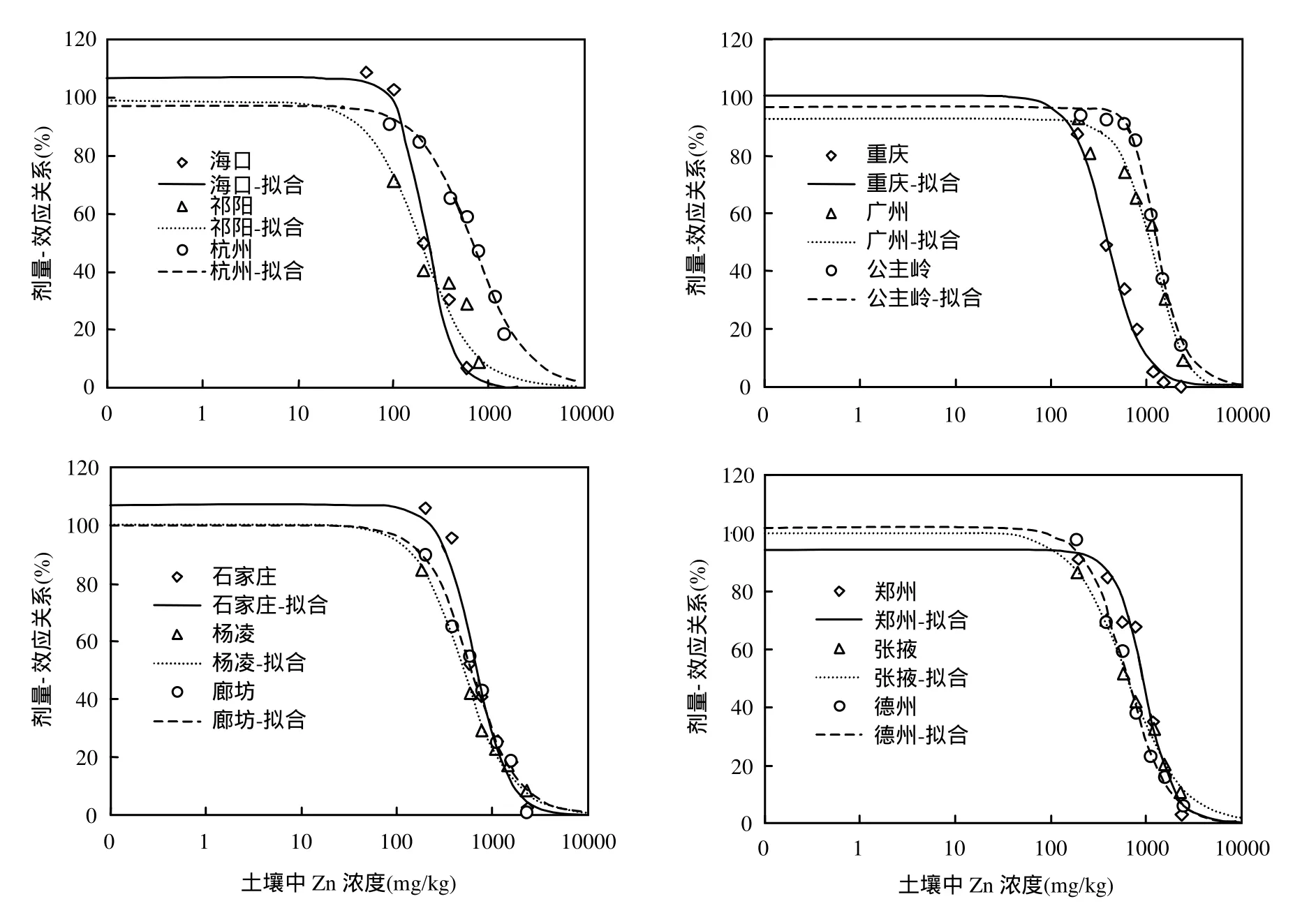
图1 不同土壤中Zn对基础诱导硝化速率毒性的剂量-效应曲线Fig.1 Dose-response curves for Zn toxicity as determined by SIN in the soils
在土壤溶液中,相对于其他 Zn的结合形态,自由 Zn2+更易被微生物吸收而产生生物毒性.基于SIN测试的12种不同土壤中Zn毒性的EC50及 EC10与溶液中自由离子 Zn(p(Zn2+)为土壤溶液中 Zn2+浓度(μmol/L)的负对数)的关系见图 2.图3可见,总体而言,随着土壤溶液中p(Zn2+)浓度的升高(x轴由右向左),基于 SIN的毒性阈值ECx(x=10,50)值也逐渐降低,意味着土壤中Zn的毒性增加,ECx与p(Zn2+)间呈现出负相关关系.有资料表明,土壤 Zn胁迫对基础硝化速率的抑制主要与硝化限速步骤氨氧化过程中的氨单加氧酶(AMO)的活性受到抑制有关[13,18-20].土壤Zn胁迫抑制基础诱导硝化作用的主要机制可能包括[21-23]:1)Zn与硝化细菌酶分子的活性部位相结合后形成较稳定的络合物,产生了与底物的竞争性抑制作用;2)Zn通过抑制土壤微生物的生长和繁殖,减少体内酶的合成和分泌,导致土壤酶活性下降;3)Zn2+与微生物体蛋白质-SH基团结合形成 Zn-螯合物,使某些酶转录激活而使信号传递系统中毒.
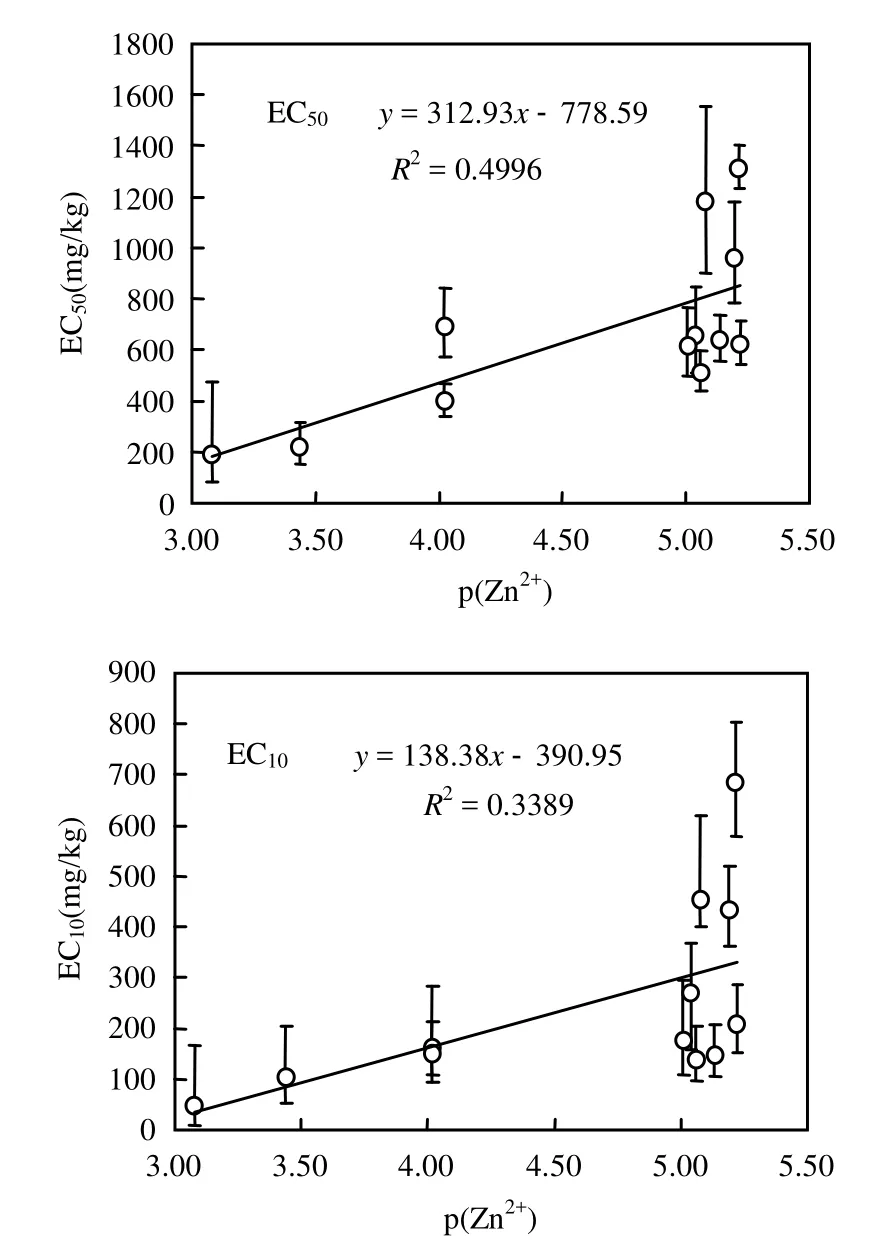
图2 基于SIN测试的ECx与溶液自由Zn2+间的关系Fig.2 Relationship curves between the ECx(x=10,50) and the p(Zn2+) in soil solutions
2.3 土壤性质对 Zn的 p(Zn2+)形态变化、毒性阈值的影响及其预测模型
通过对 Zn的微生物毒性测定结果表明,土壤性质及溶液离子组成对ECx有显著影响,为此,实验采用SPSS16.0软件对影响土壤中Zn生物毒性的主控因子做了偏相关分析(表3).通过计算表明,土壤pH值、CEC及OC含量与土壤中Zn的毒性阈值ECx及溶液中 p(Zn2+)呈现出正相关关系,在5种不同阴离子中,F-和Cl-含量也呈现正相关关系,而 Br-,,,与 ECx及p(Zn2+)呈现出负相关关系.从表3可以看出,影响土壤中Zn的毒性阈值ECx及溶液p(Zn2+)的不同变量中,最重要的因子为土壤 pH,偏相关系数均达到P<0.01显著水平,尤其在p(Zn2+)~pH关系中最突出,其次依次为OC~CEC>F->Ca2+>Mg2+.
研究表明,土壤 pH值对进入到土壤胶体中Zn的结合形态及其变化有很大影响[4,21].通常情况下,土壤中生物有效态 Zn主要与溶液中可交换 Zn的含量直接相关.通常在土壤溶液中可交换态 Zn包括:自由 Zn2+, ZnOH+, Zn(OH)2·,,, Zn(NO3)+,,Zn(H2PO4)+, Zn(HPO4)等.Robert 等[23]利用WHAM模型对不同土壤中Zn形态分布计算结果表明,当土壤pH<7.1时,可溶性Zn主要以自由Zn2+为主,在无机可交换态锌中不到2%,当溶液 pH值 7.1~9.1时,可溶性锌离子则以ZnOH+为主,而当土壤溶液 pH>9.1时,土壤溶液中的可溶性锌离子又被所代替.本研究结果表明,溶液中自由 Zn2+浓度与 pH呈显著负相关,方程为p(Zn2+) = 0.5659pH + 0.7211,R2=0.8266 (n=24),尤其在pH>7.5的6种土壤中更为明显.
土壤溶液中可交换态Zn浓度还与溶液中有机、无机配位体浓度相关,与其竞争阳离子(Ca2+,Mg2+等)成负相关[4,24-25].本研究中,ECx与土壤溶液中B-,,无机配位离子浓度呈负相关,与 F-和 Cl-含量呈正相关(除 EC10中,显著负相关外,其它都不显著,见表 3),这说明溶液不同阴离子配位体对Zn的生物有效性影响作用不尽相同,其中F-和Cl-可以降低土壤胶体中Zn的可移动性,而B-,增加了土壤中Zn的可交换性.而对于同族络合阴离子F-,Cl-和 B-而言,其对 Zn有效性差异结果可能与上述离子与Zn络合稳定性有关[4-5],上述离子在25℃离子强度I=0时与 Zn络合稳定常数分别为logKZn-F(0.78)>logKZn-Cl(0.61)>logKZn-Br(0.43),而络合稳定常数的差异性可能是不同络合阴离子对Zn生物有效性差异的机制所在[26-28].

表3 基于不同毒性终点的Zn浓度值与土壤性质及阴离子间Pearson相关性分析Table 3 Pearson correlation between Zn toxicity thresholds and soil properties, soil solution anions
通过多元逐步回归数据分析,得出了基于不同主控因子(pH、OC、CEC、F-)的土壤中Zn微生物毒性(ECx)及溶液 p(Zn2+)的预测模型(表 4).对于上述4个不同影响因子而言,土壤pH值是影响土壤Zn对潜在硝化速率抑制作用的最主要因子,其次为 OC、CEC含量.由表 4可见,土壤 pH值和OC两因子对EC50回归模型变异的决定系数(R2)达到0.597和0.615,对 p(Zn2+)的预测模型的决定系数达 0.755;当引入第三个土壤因子(CEC)及溶液 F-变量后,ECx和 p(Zn2+)的预测模型的决定系数进一步提高,4个变量因子分别解释了预测模型变异的89.9%、81.2%和92.3%.

表4 基于不同主控因子和土壤Zn毒性阈值及自由Zn离子的预测模型Table 4 Predicted models for Zn toxicity thresholds (EC10, EC50) and the free Zn2+ in solution based on the main influence factors
3 结论
3.1 基于SIN测定的不同土壤中Zn的毒性阈值结果表明,不同测试土壤 Zn的毒性阈值间有显著差异,EC50值变化从 195.9mg/kg至1310.2mg/kg;EC10值从 47.7mg/kg增加至681.8mg/kg,不同土壤EC50与EC10的最大值与最小值的比例分别达到了6.68及14.3倍,表明土壤性质对土壤中Zn的微生物毒性影响显著.
3.2 相关关系分析表明,土壤pH值、OC、CEC、F-及Cl-与Zn的毒性阈值ECx(x=10,50)及p(Zn2+)呈正相关关系,其中土壤pH为最重要的影响因子,偏相关系数均达到极显著水平(P<0.01),其次为OC、CEC及F-,ECx与溶液中Br-,呈负相关关系,溶液F-, Cl-和B-对Zn有效性差异结果可能与上述离子与Zn络合稳定常数差异有关.
3.3 建立了基于不同主控因子(pH、OC、CEC、F-)的土壤中Zn微生物毒性(ECx)及溶液p(Zn2+)的预测模型.在上述影响因子中,土壤pH值和OC两因子对 EC50、EC10回归模型变异的决定系数(R2)分别为0.615和0.597,对 p(Zn2+)的预测模型的决定系数达0.755;当引入CEC及溶液F-变量因子后,pH值、OC、CEC、F-分别解释了预测模型变异的89.9%、81.2%和92.3%,达到了很好的预测效果.
[1]Bonten L T C, Groenenberg J E, Weng L P. Use of speciation and complexation models to estimate heavy metal sorption in soils [J].Geoderma, 2008,146(1):303-310.
[2]林 蕾,陈世宝,马义兵.土壤中锌的形态转化影响因素及有效性研究进展 [J]. 农业环境科学学报, 2012,31(2):221-229.
[3]Suhadolic M, Schroll R. Effects of modified Pb, Zn, and Cd availability on the microbial communities and on the degradation of isoproturon in a heavy metal contaminated soil [J]. Soil Biology and Biochemistry, 2004,36:1943-1954.
[4]Chadi H S. Speciation of zinc in contaminated soils [J].Environmental Pollution, 2008,155:208-216.
[5]Ma Y B, Uren N C. The fate and transformation of zinc added to soils [J]. Australian Journal of Soil Research, 1997,53:727-738.
[6]林 蕾,陈世宝.基于基质诱导硝化测定的土壤中锌的毒性阈值主控因子及预测模型研究 [J]. 生态毒理学报, 2012,7(6):647-653.
[7]Wang X D, Li B, Ma Y B, et al. Development of a biotic ligand model for acute zinc toxicity to barely root elongation [J].Ecotoxicology and Environmental Safety, 2010,73(6):1272-1278.
[8]Niyogi S, Wood C M. Biotic ligand model, a flexible tool for developing site-specific water quality guidelines for metals [J].Environ. Sci. Techol., 2004,38:6177-6192.
[9]Maderova L, Paton G I. Deployment of microbial sensors to assess zinc bioavailability and toxicity in soils, Soil Biology and Biochemistry, 2013,66:222-228.
[10]Markich S J, Brown P L, Jeffree R A, Lim R P. The Effects of pH and dissolved organic carbon on the toxicity of cadmium and copper to a freshwater bivalve: further support for the extended free ion activity model [J]. Arch. Environ. Contam. Toxicol.,2003,45:479-491.
[11]Jansen S, Blust R, Van Leeuwen H P. Metal speciation dynamics and bioavailability: Zn (II) and Cd (II) uptake by mussel (Mytilus edulis) and carp (Cyprinus carpio) [J]. Environ. Sci. Technol.,2002,36:2164-2170.
[12]鲁如坤.土壤农业化学分析方法 [M]. 北京:中国农业科技出版社, 1999.
[13]Smolders E, Brans K, Coppens F, Merckx R. Potential nitrification rate as a tool for screening toxicity in metalcontaminated soils [J]. Environ. Toxicol. Chem., 2001,20(11):2469-2474.
[14]Meers E, Unamuno V R, Laing G D. Zn in the soil solution of unpolluted and polluted soils as affected by soil characteristics [J].Geoderma, 2006,136(2):107-119.
[15]Kapusta P, Lukaszewska GS, Stefanowicz AM. Direct and indirect effects of metal contamination on soil biota in a Zn-Pb post-mining and smelting area [J]. Environ. Poll., 2011,159:1516-1522.
[16]牟世芬,刘克纳.离子色谱方法及应用 [M]. 2版.北京:化学工业出版社, 2005.
[17]Schabenberger O, Tharp B E, Kells J J. Statistical test for hormesis and effective dosages in herbicide dose–response [J].Agronomy Journal, 1999,91:713-721.
[18]Smolders E, Mcgrath S P, Lomb E, et al. Comparision of toxicity of Zinc for soil microbial processes between laboratorycontaminated and polluted field soils [J]. Environ. Toxicol. Chem.,2003,22(11):2592-2598.
[19]Naidu R, Bolan N S. Contaminant chemistry in soils: key concepts and bioavailability [J]. Developments in Soil Science,2008, 32:9-37.
[20]Stuczynski T, Mccartyg W, Siebiei E C. Response of soil microbiological activities to cadmium, lead, and zinc salt amendments [J]. J. Environ. Qual., 2003,32(4):1346-1355.
[21]Bruce F M. Zinc contamination decreases the bacterial diversity of agricultural soil [J]. FEMS Microbiology Ecology, 2003,43(1):13-19.
[22]Vranova V, Rejsek K, Formanek P. Proteolytic activity in soil: a review [J]. Applied Soil Ecology, 2013,70:23-32.
[23]陈世宝,林 蕾.基于不同测试终点评价我国土壤中锌的毒性阈值(ECx)及其预测模型 [J]. 中国环境科学, 2013,33(5):922-930.
[24]Robert C S, Rooni M, Paul R P et al. Application of the biotic ligand model to predicting zinc toxicity to rainbow trout,fathead minnow and daphnia magna, comparative biochemistry and physiology part C[J]. Toxicology & Pharmacology, 2002,133,(12):271-285.
[25]Stuczynski T, Mccartyg W, Siebiei E C. Response of soil microbiological activities to cadmium, lead, and zinc salt amendments [J]. J. Environ. Qual., 2003,32(4):1346-1355.
[26]Van Beelen P, Fleuren-Kemila A K. Influence of pH on the toxic effects of zinc, cadmium and pentachlorophenol on pure cultures of soil microorganisms [J]. Environ. Toxicol. Chem., 2007,16:146-153.
[27]Smolders E, Buekers J, Oliver I, Mclaughlin M J. Soil properties affecting toxicity of zinc to soil microbial properties in laboratory-spiked and field-contaminated soils [J]. Environ Toxicol Chem, 2004,23(11):2633-2640.
[28]Coppolecchia D, Puglisi E, Vasileiadis S et al. Relative sensitivity of different soil biological properties to Zn [J]. Soil Biology Biochemistry, 2011,(43):1798-1807.

