麝香酮对血瘀证乳腺癌生长及对VEGF表达的影响
刘永惠,常 靖,,薛陆军,郭少贤,3,王 瑞,孙 烨,夏欣欣,李恩孝
(1. 西安交通大学医学院第一附属医院中医科,陕西西安 710061; 2. 西安市中医医院肿瘤科,陕西西安 710001;3.中国人民解放军第266医院肿瘤科,河北承德 067000)
乳腺癌是多种因素、多种机制共同作用的结果,某些癌基因、细胞因子等对肿瘤的发生、发展、转移及预后影响十分显著。癌基因血管内皮生长因子(vascular endothelial growth factor, VEGF)是目前公认的与肿瘤发生密切相关的因子,其对维持基因稳定性和对细胞生长有着重要调节作用。现代中医研究发现,血瘀证是恶性肿瘤的一种常见类型,血瘀是导致癌症转移、复发的重要病理基础[1]。近几年来,多项研究发现,活血化瘀药物对恶性肿瘤转移有明显抑制作用[2]。我们应用活血化瘀药试图通过调节VEGF的表达和活性,抑制肿瘤细胞的过度增殖。本实验选取活血化瘀药物麝香的活性物质麝香酮(musk ketone),检测麝香酮对血瘀证裸鼠皮下移植瘤的VEGF表达是否存在影响,以探讨麝香酮在抗癌方面的作用及其机制。
1 材料与方法
1.1动物、细胞系、主要试剂及仪器5周龄雌性裸小鼠60只,体重(20±1)g,购自上海斯莱克实验动物有限责任公司(许可证号码:SCXK(沪)2007-0005)。饲料提供来自西安交通大学医学院实验动物中心提供。实验和饲养于西安交通大学医学院实验动物中心动物实验室SPF环境下进行。乳腺癌细胞株MDA-MB-231s购自北京康为世纪生物科技有限公司。麝香酮标准品购自德国Dr(批号:90527CY),胎牛血清购自杭州四季青生物工程材料有限公司,VEGF一抗、VEGF一抗试剂盒购自北京康为世纪生物科技有限公司,VEGF二抗、VEGF二抗试剂盒购自北京中杉金桥生物技术有限公司,盐酸肾上腺素(1 mL∶1 mg)购自上海禾丰制药有限公司(批号:H31021062)。普通光学显微镜(日本Olympus公司)。
1.2细胞培养人乳腺癌细胞系MDA-MB-231s按常规进行传代培养,在含100 mL/L胎牛血清的培养基中50 mL/L CO2、37 ℃条件下培养,待细胞长至瓶底80%~90%,用2.5 g/L胰蛋白酶消化,3~5 d传代1次。取对数生长期的细胞进行实验。
1.3血瘀动物模型的建立将40只雌性裸鼠随机分为血瘀组(n=30)和空白组(n=10)。空白组连7 d皮下注射0.2 mL生理盐水;血瘀组连续7 d皮下注射0.01%肾上腺素0.2 mL[3]。
1.4测定指标与方法本实验采用眼球取血法,分别从血瘀组(n=10)和空白组(n=10)中留取血液样本。取血后及时用肝素抗凝(20 IU/mL血液),并由西安交通大学医学院第一附属医院检验科测定在切变率为1 S-1、10 S-1、50 S-1、200 S-1的全血黏度。
1.5接种与给药将0.2 mL(1×107个)人乳腺癌细胞MDA-MB-231s细胞悬液注入于血瘀组中剩余的20只裸鼠背部的外上方皮下,并随机分为血瘀荷瘤组(n=10)和麝香酮组(n=10)两组。随后对麝香酮组给予2 mg/(kg·d)麝香酮灌胃处理,血瘀荷瘤组给予生理盐水灌胃作为对照,连续灌胃处理14 d。
1.6HE染色法组织切片后进行HE染色。实验具体步骤:肿瘤组织石蜡切片厚度为5 μm,二甲苯Ⅰ、二甲苯Ⅱ依次脱蜡,乙醇梯度水化;苏木素染色,淡氨水(10 mL/L)分化,伊红染色;乙醇梯度脱水;二甲苯Ⅰ、二甲苯Ⅱ透明,中性树胶封片。
1.7免疫组化法检测VEGF表达按常规处理待检测的石蜡或冰冻组织切片或细胞爬片等样本,依次在试剂1、试剂2、试剂3、试剂4中室温孵育,PBS充分漂洗,完成后滴加显色工作液显色,最后复染,脱水透明,封片。
VEGF阳性细胞数计数:光学显微镜下,细胞质为棕黄色颗粒的细胞定为阳性染色细胞。参照文献[4]计数方法,在高倍镜(×400)视野下对每张切片随机选取4个视野,读取阳性细胞数,计算其平均值。
免疫组织化学评分标准:阳性细胞分为0~3四个级:无棕黄色颗粒为0,1%~10%定为1,11%~50%为2,51%以上定为3;染色强度分0~3级,阴性定为0,弱阳性定为1,中度阳性定为2,强阳性定为3。这2项数值之和即为该片的免疫组化评分。
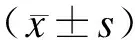
2 结 果
2.1两组裸鼠血液流变学的比较对裸鼠进行了血液流变学的检测,结果表明,空白组与血瘀组比较,4个切变率下的血流变结果差异均具有统计学意义(P<0.05,表1)。提示两组本实验血瘀动物模型造模成功,可以进行下一步实验。
表1两组裸鼠血液流变学结果的比较
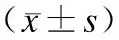

检测指标空白组(mPa.s)血瘀组(mPa.s)1S-129.47±7.2846.02±10.94#5S-19.66±2.7114.54±3.08#30S-14.21±1.506.11±3.46#200S-12.09±1.343.97±1.67#
与空白组比较,#P<0.05。
2.2大体形态学观察、裸鼠体重及瘤体的变化从造模开始,裸鼠生长状态良好,饮食、饮水、排便正常,未有拒食,对外刺激反应正常。种植瘤体后接种5 d后可见背部米粒大小肿块形成,7 d后瘤达100 mm3左右,成瘤率100%。瘤体生长于裸鼠外侧背部皮下,色苍白、质硬、活动性较差、表面光滑,裸鼠体重稍有降低,估计与肿瘤负荷大、消耗增加有关;解剖全部裸鼠未见明显胸腔及腹腔脏转移灶。实验中不同时间点对全部入组裸鼠进行了体重测量。肿瘤体积(mm3)=1/2×肿瘤最长径×(肿瘤最短径)2。造模裸鼠肿瘤体积见表2。比较血瘀荷瘤组与麝香酮两组,结果差别具有统计学意义(P<0.05)。提示麝香酮可抑制瘤体生长。
表2两组裸鼠体质量及瘤体体积的比较
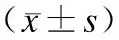
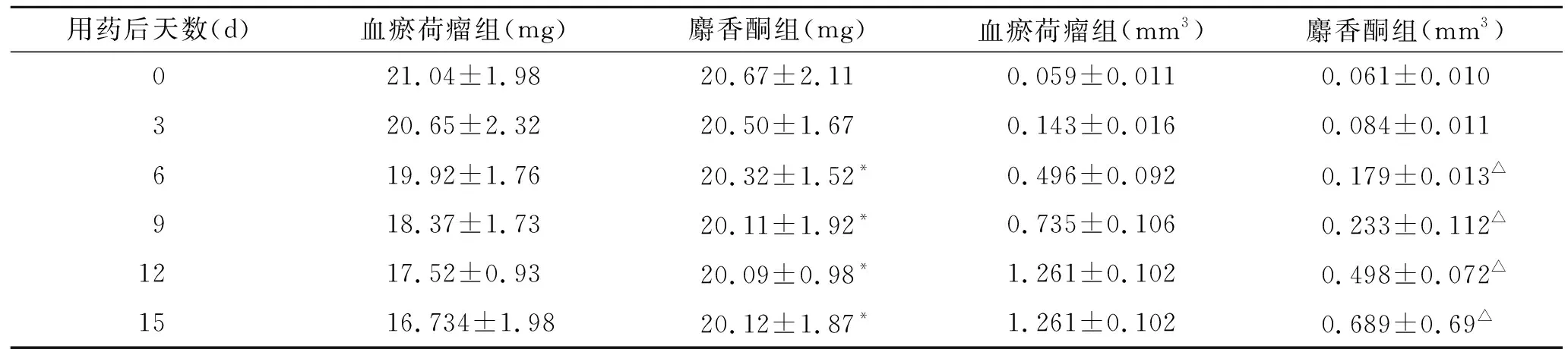
用药后天数(d)血瘀荷瘤组(mg)麝香酮组(mg)血瘀荷瘤组(mm3)麝香酮组(mm3)021.04±1.9820.67±2.110.059±0.0110.061±0.010320.65±2.3220.50±1.670.143±0.0160.084±0.011619.92±1.7620.32±1.52*0.496±0.0920.179±0.013△918.37±1.7320.11±1.92*0.735±0.1060.233±0.112△1217.52±0.9320.09±0.98*1.261±0.1020.498±0.072△1516.734±1.9820.12±1.87*1.261±0.1020.689±0.69△
与血瘀荷瘤组比较,*P<0.05,△P<0.05。
2.3两组抑瘤率的比较计算抑瘤率:抑瘤率(%)=[模型组瘤重-实验组瘤重]/模型组瘤重×100%。对造模裸鼠抑瘤率进行换算,比较以下两组抑瘤率。结果显示,血瘀加瘤组和麝香酮组用药14 d后的瘤重分别为:(1.452 2±0.363 9)g、(0.868 7±0.144 7)g,抑瘤率分别为-%和40.18%,差异具有统计学意义(P<0.05)。
2.4免疫组织化学VEGF表达及分析免疫组化结果显示,在血瘀荷瘤组中,VEGF在瘤体中呈高表达,而在麝香酮组中,瘤体中VEGF的表达显著降低。经过统计分析,麝香酮组瘤体VEGF评分(2.90±0.25)显著低于血瘀荷瘤组(5.08±0.35),(P<0.05,图1)。
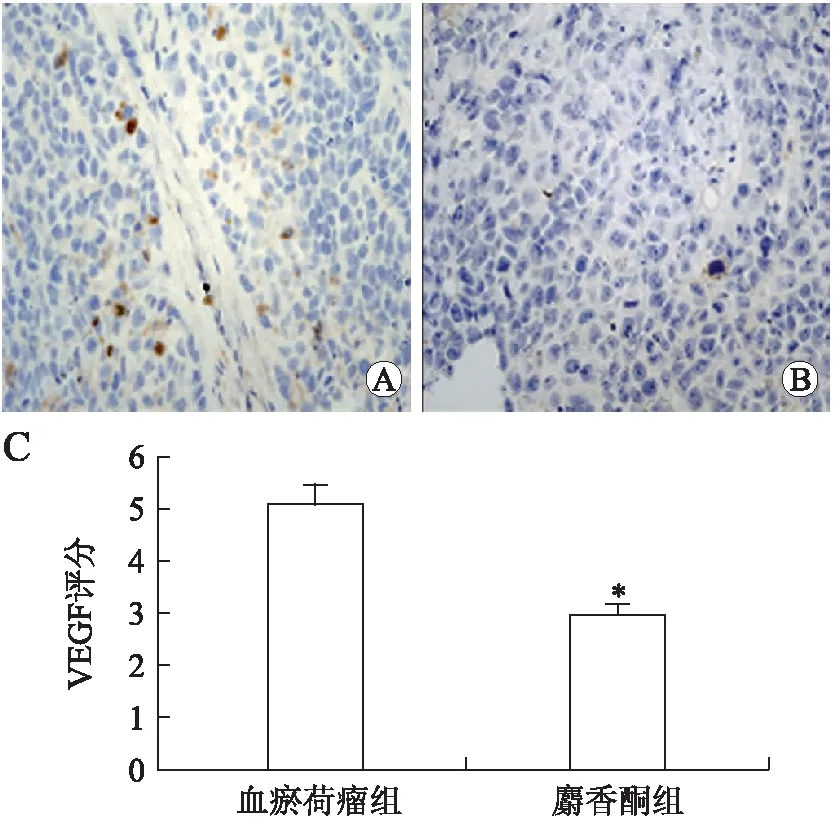
图1两组裸鼠肿瘤的VEGF免疫组化染色
Fig.1 Immunohistochemical staining of VEGF in the tumor of the two groups of nude mice (×400)
A:血瘀荷瘤组;B:麝香酮组;C:两组VEGF评分的比较。
3 讨 论
乳腺癌是女性最常见的恶性肿瘤之一,现每年全球新增乳腺癌的患者已超过100万[5],在我国乳腺癌已居妇女恶性肿瘤第1位[6]。目前治疗乳腺癌的手术、化疗存在一定的局限性且副作用较大,如果配合生物靶向治疗有可能推动综合疗法向更高的层次发展[7-8]。
乳腺癌属于中医的“乳石痈”、“奶岩”等范畴。辨证分为肝郁痰凝证、冲任失调证、正虚毒炽证、气血两亏证这四种证型。但在临床上,依据现代中医理论,结合乳腺癌的特点,我们发现肿瘤多以血瘀证特征为多见,血瘀与肿瘤转移关系极为密切。临床及实验室已证实肿瘤患者的血小板功能异常活化;血小板聚集、黏附功能呈现亢进状态[9],即血液的浓、黏、聚、凝状态,认为这种现象类似于中医所阐述的“血瘀证”。当血液处于血瘀证的高凝状态,血液流动或减缓,或滞而不畅,甚或瘀阻。这样游离在血管中的肿瘤细胞就有条件从血管壁的湍流区贴附于管壁,使其得以着床,继而肿瘤细胞大量增殖再通过血液或淋巴系统进行散播,最终导致转移的形成。因此,可以认为血瘀证存在于癌症的各个阶段,它是肿瘤转移的条件和结果。这就相当于种子与土壤的关系。血液高度凝聚的血瘀状态为大量增殖、积聚的肿瘤细胞提供良好的散播途径。血瘀是恶性肿瘤转移的重要病理基础。
VEGF是刺激肿瘤血管生成最重要和作用最强的因子[10]。有研究显示,乳腺癌转移和预后与VEGF关系密切[11-12]。LINDERHOLM等[13-14]认为,VEGF在乳腺癌细胞中呈高表达,其表达对乳腺癌病人预后的判断有重要意义。故可通过检测乳腺癌组织中VEGF以间接通过观测乳腺癌病理进程和预后。
肿瘤生长所需的营养物质主要依靠血液。肿瘤血管形成是肿瘤生长、转移的基础。 若抑制肿瘤血管生成,阻断其赖以生存的“关卡”,就可以切断肿瘤营养供给的途径,肿瘤就会处于静止休眠状态[15]。所以血管已成为肿瘤治疗新的靶点,这将是肿瘤治疗的重要策略[16-17]。现在一些研究人员尝试通过使用一些化疗药物抑制VEGF表达,以期达到抗肿瘤作用[18-19]。因此,降低VEGF的异常表达是降低乳腺癌发生、发展的重要因素。
麝香作为药物已有两千多年的历史,其性辛温,气味芳香、善走窜,性味辛温,归心脾二经,有醒脑开窍、活血化瘀、消肿止痛之功效。清代许克昌在《外科证治全书》中已对乳岩的治疗预后有具体的阐述。现代研究证明,麝香有兴奋中枢系统,抗缺氧、强心、抗炎,抑制人体肿瘤细胞及提高免疫力等作用。药理学研究显示,麝香的提取成分麝香酮亦称3-甲基环十五烷酮(C16H30O),是麝香的重要成分部分和主要生理活性物质。我们选用活血化瘀药物麝香的提取成分麝香酮治疗肿瘤,探讨麝香酮、血瘀证和乳腺癌相关因子之间联系,为乳腺癌的治疗提供新的方法。
在本实验中我们发现,不同组中的裸鼠体质量、瘤体体积、肿块质量与对照组的差异都有明显差异。经麝香酮药物的干预后,裸鼠皮毛较光滑,行动相对敏捷,饮食、排便较规律,各脏器未见明显改变,麝香酮的抑瘤率达到40.18%,且麝香酮抑制VEGF的表达。这初步说明通过麝香酮可下调乳腺癌细胞的VEGF的表达,阻止新生血管生成。通过本次实验,我们初步证实了麝香酮的部分抑瘤作用,它通过阻断肿瘤所需的血管系统形成、降低血管通透性,消除细胞赖以生存的基础,以发挥抑制肿瘤生长、侵袭及转移的作用。
参考文献:
[1] 罗晓琴,徐咏梅,唐勇. 从肿瘤转移相关因子探讨非小细胞肺癌气虚血瘀证的病理基础[J]. 中国中西医结合杂志, 2009, 29(10):886-887.
[2] 张国荣,齐元富. 活血化瘀法治疗恶性肿瘤作用机制探讨[J]. 山西中医,2010,26(5):60-62.
[3] 和岚,蒋文跃,毛腾敏. 注射肾上腺素模拟“气滞”复制急、慢性血瘀模型初探[J]. 中国中西医结合杂志,2004,24(3):244-245.
[4] NICOLELLA D, MAIONE P, GRIDELLI C. Targeted therapies: focus on a new strategy for gastrointestinal tumors[J]. Crit Rev Oncol Hematol, 2003, 47(3):261-271.
[5] WESTEEL V, DEPIERRE A. Combined modality treatment of breast cancer[J]. Am J Respir Med, 2003, 12(2):477-490.
[6] 李国利,刘惠,程建. 乳腺癌钙化点的计算机辅助诊断[J]. 生物医学工程学志, 2011, 28(1):171-173.
[7] EPISTOLATO MC, DISCIGLIO V, LIVIDE G, et al. p53 Ar972Pro and MDM2 309 SNPs in hereditary retinoblastoma[J]. J Hum Genet, 2011, 56(9):685-686.
[8] 杨宁,刘艳. 乳腺癌内科综合治疗的现状[J]. 黑龙江医学,2010,34(10):749-750.
[9] 刘永惠,杨晓峰,周冬枝,等. 肿瘤转移与血瘀证的临床研究[J]. 中国中医基础医学杂志,2002, 8(4):50-58.
[10]GINSBERG MD. Models of cerebral hernia in the rodent[M]. Cerebralischeia Berlin: Springer Vedag, 1991: 2.
[11] 陈文垲,黄玉芳. 麝香“归经入脑”的实验研究[J]. 中西医结合报, 2004, 2(4):288-291.
[12] Newton. Phage peptide display[J]. Handb Exp Pharmacol, 2008, (185 Pt 2):145-163.
[13]WANG PL, XU WG, DU Y, et al. Primary study of anti-angiogenic effect on human breast cancer metastasis [J]. Clin Med China, 2006, 22(1):26-28.
[14] 李凤和. 细胞外基质与肿瘤转移[J]. 现代口腔医学杂志, 2000, 14(3):206-208.
[15] 朱秀媛. 人工麝香的药用潜力[J]. 百科知识,1995,(7):11.
[16] 石进峰,张博爱. 麝香提取物对大鼠皮层神经细胞炎性损伤的保护作用[J]. 中国中西医结合杂志, 2010, 30(6):626-628.
[17] LEMAY R. Insulin administration protects neurologic function in cerebral ischemia in rats[J]. Stroke,1998, 19:11-14.
[18] 柳光字,邵志敏,沈镇宙. 紫杉醇诱导乳腺癌细胞凋亡的分子生物学机制[J].中国癌症杂志, 2000, 10(1):93-96.
[19] SHARIFI-SISTANI N, ZARTAB H, BABAKOOHI S, et al. Immunohistochemical comparison of the expression of p53 and MDM2 proteins in arneloblastonma and keratocystic odontogenie tumors[J]. J Craniofac Surg, 2011, 22(5):1652-1656.

