岷江百合单萜合酶基因克隆与表达分析
李路路, 王 欢, 孙 明, 张启翔
(花卉种质创新与分子育种北京市重点实验室,国家花卉工程技术研究中心,北京林业大学园林学院,北京 100083)
岷江百合单萜合酶基因克隆与表达分析
李路路, 王 欢, 孙 明, 张启翔
(花卉种质创新与分子育种北京市重点实验室,国家花卉工程技术研究中心,北京林业大学园林学院,北京 100083)
以岷江百合花被片为材料,通过RT-PCR方法,克隆单萜合酶基因,命名为LreTPS.该基因包含1770 bp的开放阅读框,编码590个氨基酸,编码蛋白质分子质量为68.18 ku,等电点为5.77.LreTPS编码的蛋白含有单萜合酶蛋白特有的DDXXD、RRX8W保守基序,氨基酸序列N端含有一段转运肽,与其他植物的单萜合酶基因蛋白同源性为40%-50%.系统进化树分析表明,LreTPS基因属于TPS-b亚家族.荧光定量表达结果表明,LreTPS在岷江百合花被片中表达量最高,其次在叶片中,在雄蕊与柱头中微量表达.
单萜合酶; 基因克隆; 基因表达; 岷江百合
花香是继花色之后,对观赏植物和切花又一重要性状,是现代观赏植物育种的新的研究方向[1].萜类是花香挥发物的主要成分之一[2],这些挥发物在植物与动物之间存在复杂的相互关系,能够吸引并指导特定的昆虫进行授粉,同时可防御昆虫或动物对植物的伤害,具有防御保护作用[3-5].
单萜是C10类由二分子异戊二烯聚合而成的萜类化合物及其衍生物,是花香萜类物质的主要成分之一.目前,单萜物质的代谢途径研究已取得较大进展.香叶基焦磷酸(geranyl diphosphate, GPP)是单萜化合物的直接前提物质[6].在单萜合酶的催化作用下,由金属阳离子辅助,GPP发生电离,产生的碳正阳离子经过一系列的环化、异构化和重新排列产生碳正阳离子中间体,这些碳阳离子中间体通过去质子化或被水捕获而终止反应,生成相应的单萜化合物[7].该途径主要在质体中发生,其中单萜合酶基因起到关键作用.很多单萜合酶能催化产生多种单萜物质,以主产物命名[8].在被子植物和裸子植物中克隆的萜类合酶基因,大多数来源于植物营养组织器官,如叶片、茎等, 随着花香研究的深入,与花朵香味生物合成相关的萜类基因,逐渐被报导.自第一个芳樟醇单萜合酶基因LIS在仙女扇(Clarkiabreweri)花朵中被克隆后[9],相继在现代月季(Rosahybrida)[10]、金鱼草[11,12]、拟南芥[13,14]、烟草[15]、猕猴桃(Actinidiachinensis)[16]、六出花(Alstroemgeriacv. ‘Sweet Laura’)[17]等植物中发现与花朵香味合成相关的萜烯类合酶基因.
百合是世界重要切花之一,其花香类型多样.有研究表明[18-19]:不香型百合品种挥发物释放量极低,而芳香型百合则释放较高量挥发物.其中月桂烯、(E)-β-罗勒烯、芳樟醇等单萜类化合物是芳香型百合品种的主要挥发物.岷江百合是我国重要的野生百合资源,香味浓郁,其中1,8-桉树脑、(E)-β-罗勒烯等单萜化合物是其主要挥发物[18].本研究以岷江百合花被片为材料,用RT-PCR技术克隆单萜合酶基因,为深入研究百合花香调控机制和百合花香育种提供依据.
1 材料与方法
1.1 材料
岷江百合生长于北京林业大学小汤山花卉基地荫棚中.在花朵完全张开时取花朵不同部位(内轮花被片、外轮花被片、雄蕊、柱头、叶片),经液氮速冻后存于-80 ℃冰箱中备用.
1.2 主要试剂
植物RNA提取试剂盒购自艾德莱生物有限公司,第一链cDNA合成试剂盒购自天根生化科技有限公司,荧光定量试剂SYBR® Premix Ex TaqTMGC、克隆载体pMD-18T及rTaq酶均购自TaKaRa公司;引物合成和基因测序由北京睿博兴科有限公司完成.
1.3 克隆与序列分析
花被片总RNA提取参照艾德莱EASYspin Plus植物RNA提取试剂盒说明书进行.取5 μg总RNA按照天根cDNA第一链合成说明书进行cDNA第一链的合成.根据已克隆的‘西伯利亚’百合(Lilium‘Siberia’)LiTPS单萜合酶基因序列(KF734591),在5′端非编码区与3′末端设计引物LreF1:5′ GAGGTTGCTGAGAAGAACACCAAAC 3′与LreR1:5′ TCATTCCAATGGGACATTATTGACAAAT 3′,通过RT-PCR方法克隆基因全长.PCR反应程序为94 ℃热变性5 min;95 ℃变性30 s,57 ℃退火30 s,72 ℃延伸2 min,35个循环;72 ℃延伸10 min.扩增产物用1%琼脂糖凝胶电泳检测,回收纯化后连接到pMD-18T克隆载体上,转化TOP10感受态大肠杆菌,进行蓝白斑筛选,挑取阳性克隆单菌落用于检测和测序.
通过DNAMAN软件对所得的核苷酸序列片段进行拼接,获得全长cDNA序列.用NCBI中ORF程序分析该基因的开放阅读框并推导出其氨基酸序列.采用ProtParam(http://web.expasy.org/protparam/)计算蛋白分子量及等电点,用ChloroP 1.1 Server(http://www.cbs.dtu.dk/services/ChloroP/)和TargetP 1.1 Server(http://www.cbs.dtu.dk/services/TargetP/)进行亚细胞定位.使用NCBI中的Blast对所得基因的氨基酸序列进行比对,用Clustal X软件和Mega 5.0软件的Bootstrap算法绘制系统发育树.
1.4 不同器官的表达分析
提取岷江百合不同组织部位的总RNA,取1 μg总RNA按照天根cDNA第一链合成说明书进行cDNA第一链的合成.设计特异引物qLreF2:5′ CTATTCAACGGCTTGGCATCG 3′与qLreR2:5′ CCCAGCATTCCTTTCACATCG 3′进行实时荧光定量实验.用百合LhActin mRNA(AB438963)作为内参基因,引物为LhAF:5′ TGTGCTTTCCCTCTACGCCAGT 3′与LhAR:5′ TCCCTCACGATTTCCCGCTCT 3′.实时荧光定量PCR反应程序为:95 ℃预变性30 s;95 ℃变性5 s,53 ℃退火30 s,72 ℃延伸30 s,40个循环;60 ℃延伸30 s.相对定量计算方法按照2-△△CT,数据用PikoRealTM2.0和excel 2007进行分析.
2 结果与分析
2.1 基因克隆与序列分析
以岷江百合盛花期内轮花被片cDNA为模板,得到含开放阅读框全长为1803 bp的cDNA序列,将该基因命名为LreTPS.LreTPS基因的开放阅读框为1770 bp,编码590个氨基酸(图1).LreTPS编码蛋白质分子质量为68.18 ku,等电点为5.77,分子式为C3056H4794N818O891S29.结构分析表明,LreTPS编码的蛋白质基因属于萜类基因家族.该基因N端含有一个精氨酸保守域RRX8W,推测与GPP离子化形成环状中间产物有关[20];C端含有一个天冬氨酸富集的DDXXD基序,该基序几乎存在于所有单萜合酶中,被认为是二磷酸酯结合部位,下游的(D)D(L,I,V)X(S,T)XXXE结构域,同DDXXD一样负责金属阳离子的配位,对底物的结合与电离有重要作用[7,8].这些结构域均是萜类基因特有的保守结构域,与之前文献报道相符[7,21].经CHLOROP 、TARGETP预测,LreTPS基因编码蛋白N端含有一段转运肽,该蛋白被定位于叶绿体上.

图1 岷江百合单萜合酶基因LreTPS全长序列与对应氨基酸序列Fig.1 Nucleotide sequence and deduced amino acid sequence of LreTPS from Lilium regale
通过BLAST比对,LreTPS基因推导的氨基酸序列与其他植物物种的萜烯合酶蛋白序列同源性多集中在40%-50%.与‘西伯利亚’百合花被片单萜合酶LiTPS基因(KF734591)氨基酸同源性为85%,与樟科植物山鸡椒(Litseacubeba)的反式罗勒烯合酶(AEJ91554)同源性为49%,与葡萄(Vitisvinifera)的芳樟醇合酶(ADR74209)和E-β-罗勒烯/月桂烯合酶(ADR74206)同源性分别为49%和46%.
2.2 系统进化树分析
采用软件Clustal X和Mega 5.0,选取已发表的植物萜类基因氨基酸,运用最邻近构树法构建系统进化树(图2).LreTPS基因被分类于TPS-b亚家族.萜类基因家族被划分为7个亚家族:TPS-a至TPS-g[12,21],有研究人员在这种划分方式的基础上,提出了新的划分方式[22],该方法仍然分为7个亚家族,将原来的TPS-e和TPS-f亚家族归为1个亚家族TPS-e/f,增加1个TPS-h亚家族.TPS-b亚家族不仅是被子植物中显花植物特有的家族,也是单萜合酶基因和异戊二烯合酶基因特有的亚家族,该亚家族的单萜合酶主要催化合成环形单萜.
2.3 表达分析
在岷江百合盛花期,LreTPS基因在花器官的不同部位以及叶片中的表达均差异显著(图3).LreTPS在花被片中表达量最高,且内轮花被片高于外轮花被片.在叶片中也有一定表达,在雄蕊与柱头中仅有微量表达.

图2 岷江百合LreTPS基因与其他植物萜烯合酶蛋白的系统进化树分析该进化树(不包含TPS-c和TPS-h亚家族)Fig.2 Phylogeny analysis of LreTPS protein with terpene synthase proteins selected from other plant species Subfamily TPS-c and TPS-h were not in this phylogeny tree
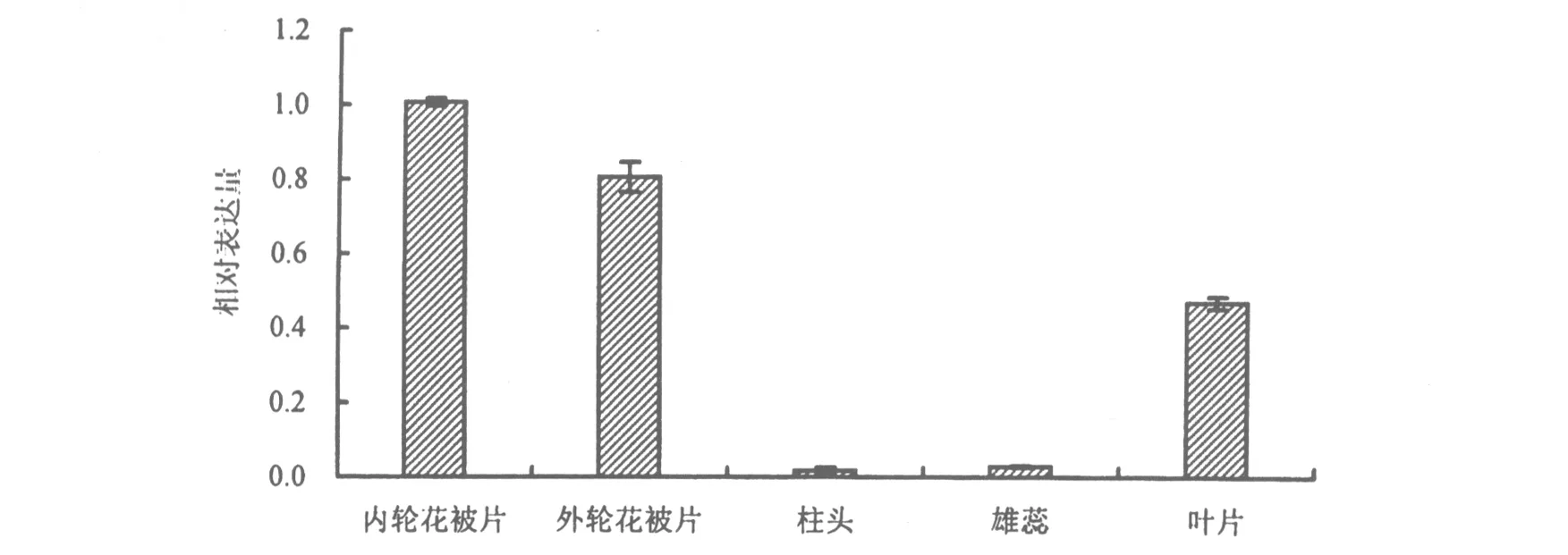
图3 LreTPS在岷江百合不同组织器官中的表达情况Fig.3 Expression of LreTPS in different tissues of Lilium regale
3 讨论
萜类合酶基因在植物中多以基因家族形式存在.目前,萜类基因家族已在多个物种中报导,如拟南芥(Arabidopsisthaliana)、葡萄(Vitisvinifera)、番茄(Solanumlycopersicum)、苹果(Malusdomestica)等[23-26].在植物中,烯萜类基因家族是含有20-150个烯萜基因的中型家族[22].本研究采用RT-PCR方法,在岷江百合花被片中克隆单萜合酶基因LreTPS.LreTPS基因含有单萜合酶基因特有的RRX8W、DDXXD、(D)D(L,I,V)X(S,T)XXXE保守基序,与其他植物的单萜合酶基因同源性为40%-50%.系统进化树分析表明,LreTPS基因属于TPS-b亚家族.萜烯合酶起源于古萜类合酶,经高度进化,不同物种间相同功能的萜烯合酶同源性低,但相同物种不同功能的萜烯合酶同源性高.如金鱼草花中的芳樟醇合酶基因与金鱼草的橙花叔醇合酶基因的同源性高达95%,与月桂烯合酶同源性达62%,但与拟南芥的芳樟醇合酶基因的同源性为42%[11].系统进化树结果表明,LreTPS与‘西伯利亚’百合单萜合酶LiTPS基因亲缘关系最近,同源性高达85%,同时,与葡萄(单子叶植物)的芳樟醇合酶聚为一类.
花被片是‘西伯利亚’百合花香挥发物的主要释放部位,其他部位如柱头、花药、花丝子房和花梗等基本不释放挥发物[19].张辉秀等[27]对‘西伯利亚’百合不同开花时期的花香进行检测,结果表明,盛花期时,花香挥发物释放量和化合物种类最多.Dudareva et al[28]推测,花香基因的表达水平对花香挥发物的生物合成有重要作用.在岷江百合盛花期,LreTPS基因在花被片中高度表达,该基因在转录水平上的表达量与花香挥发物释放量程正相关,这与仙女扇、金鱼草花中的单萜合酶基因表达模式相一致[9,12].由此推测,LreTPS基因对岷江百合花香单萜类物质的生物合成有重要作用.
岷江百合花香成分多样,LreTPS基因可能是控制其单萜类花香物质的众多基因中的1个.根据萜烯合酶按亲缘关系聚类而非功能聚类的特点以及萜烯类合酶基因的结构特点,仅能判断LreTPS基因属于萜烯类合酶基因家族,关于LreTPS基因的功能和该家族其他基因的挖掘有待进一步研究.
[1] CHANDLER S, BRUGLIERA F. Genetic modification in floriculture[J]. Biotechnology Letters, 2011,33(2):207-214.
[2] DUDAREVA N, PICHERSKY E. Biochemical and molecular genetic aspects of floral scents[J]. Plant Physiol , 2000,122(3):627-634.
[3] DICKE M, VAN LOON J J A. Multitrophic effects of herbivore-induced plant volatiles in an evolutionary context[J]. Entomologia Experimentalis et Applicata, 2000,97(3):237-249.
[4] PIECHULLA B, POTT M B. Plant scents-mediators of inter-and intraorganismic communication[J]. Planta, 2003,217(5):687-689.
[5] HEIL M. Direct defense or ecological costs: Responses of herbivorous beetles to volatiles released by wild lima bean (Phaseoluslunatus)[J]. Journal of Chemical Ecology, 2004,30(6):1289-1295.
[6] DUDAREVA N, PICHERSKY E. Biology of Floral Scent[M]. Boca Raton: CRC Press/Taylor and Francis Group, 2006:55-104.
[7] DEGENHARDT J, KOLLNER T, GERSHENZON J. Monoterpene and sesquiterpene synthases and the origin of terpene skeletal diversity in plants[J]. Phytochemistry, 2009,70:1621-1637.
[8] 徐应文,吕季娟, 吴卫,等.植物单萜合酶研究进展[J].生态学报,2009,29(6):3188-3197.
[9] DUDAREVA N, CSEKE L, BLANC V M, et al. Evolution of floral scent in Clarkia: novel patterns of S-linalool synthase gene expression in the C.breweri flower[J]. Plant Cell, 1996,8(7):1137-1148.
[10] GUTERMAN I, SHALIT M, MENDA N, et al. Rose scent: Genomics approach to discovering novel floral fragrance-related genes[J]. The Plant Cell Online, 2002,14(10):2325-2338.
[11] NAGEGOWDA D A, GUTENSOHN M, WILKERSON C G, et al. Two nearly identical terpene synthases catalyze the formation of nerolidol and linalool in snapdragon flowers[J]. Plant J, 2008,55(2):224-239.
[12] DUDAREVA N, MARTIN D, KISH C M, et al. (E)-beta-ocimene and myrcene synthase genes of floral scent biosynthesis in snapdragon: Function and expression of three terpene synthase genes of a new terpene synthase subfamily[J]. Plant Cell, 2003,15(5):1227-1241.
[13] CHEN F, THOLL D, D′AURIA J C, et al. Biosynthesis and emission of terpenoid volatiles from Arabidopsis flowers[J]. The Plant Cell Online, 2003,15(2):481-494.
[14] THOLL D, CHEN F, PETRI J, et al. Two sesquiterpene synthases are responsible for the complex mixture of sesquiterpenes emitted from Arabidopsis flowers[J]. The Plant Journal, 2005,42(5):757-771.
[15] ROEDER S, HARTMANN A M, EFFMERT U, et al. Regulation of simultaneous synthesis of floral scent terpenoids by the 1,8-cineole synthase of Nicotiana suaveolens[J]. Plant Mol Biol, 2007,65(1-2):107-124.
[16] CHEN X, YAUK Y-K, NIEUWENHUIZEN N J, et al. Characterisation of an (S)-linalool synthase from kiwifruit (Actinidia arguta) that catalyses the first committed step in the production of floral lilac compounds[J] . Funct Plant Biol, 2010,37(3):232-243.
[17] AROS D, GONZALEZ V, ALLEMANN R K, et al. Volatile emissions of scented Alstroemeria genotypes are dominated by terpenes, and a myrcene synthase gene is highly expressed in scented Alstroemeria flowers[J]. J Exp Bot, 2012,63(7):2739-2752.
[18] 孔滢.百合花香组成成分及时空释放规律研究[D].北京:北京林业大学,2012.
[19] KONG Y, SUN M, PAN H T, et al. Composition and emission rhythm of floral scent volatiles from eight lily cut flowers[J]. J Am Soc Hortic Sci, 2012,137(6):376-382.
[20] WILLIAMS D C, MCGARVEY D J, KATAHIRA E J, et al. Truncation of limonene synthase preprotein provides a fully active ‘pseudomature’ form of this monoterpene cyclase and reveals the function of the amino-terminal arginine pair[J]. Biochemistry, 1998,37(35):12213-12220.
[21] BOHLMANN J, MEYER-GAUEN G, CROTEAU R. Plant terpenoid synthases: Molecular biology and phylogenetic analysis[J]. Proceedings of the National Academy of Sciences, 1998,95(8):4126-4133.
[22] CHEN F, THOLL D, BOHLMANN J, et al. The family of terpene synthases in plants: a mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom[J]. Plant, 2011,66(1):212-229.
[23] AUBOURG S, LECHARNY A, BOHLMANN J. Genomic analysis of the terpenoid synthase (AtTPS) gene family ofArabidopsisthaliana[J]. Mol Genet Genomics, 2002,267:730-745.
[24] MARTIN D, AUBOURG S, SCHOUWEY M, et al. Functional annotation, genome organization and phylogeny of the grapevine (Vitisvinifera) terpene synthase gene family based on genome assembly, FLcDNA cloning, and enzyme assays[J]. Bmc Plant Biol, 2010,10(1):226.
[25] FALARA V, AKHTAR T A, NGUYEN T T, et al. The tomato terpene synthase gene family[J]. Plant Physiol, 2011,157(2):770-789.
[26] NIEUWENHUIZEN N J, GREEN S A, CHEN X, et al. Functional genomics reveals that a compact terpene synthase gene family can account for terpene volatile production in apple[J]. Plant Physiol, 2013,161(2):787-804.
[27] 张辉秀,冷平生,胡增辉,等.‘西伯利亚’百合花香随开花进程变化及日变化规律[J].园艺学报,2013,40(4):693-702.
[28] DUDAREVA N, PICHERSKY E, GERSHENZON J. Biochemistry of plant volatiles[J]. Plant Physiol, 2004,135(4):1893-1902.
(责任编辑:吴显达)
Molecular cloning and expression analysis of a monoerpene synthase gene inLiliumregale
LI Lu-lu, WANG Huan, SUN Ming, ZHANG Qi-xiang
(Beijing Key Laboratory of Ornamental Plants Germplasm Innovation and Molecular Breeding, National Engineering Research Center for Floriculture, College of Landscape Architecture, Beijing Forestry University, Beijing 100083, China)
Using a homology-based PCR strategy, a monoterpene syntheses namedLreTPSwas cloned from the petal ofLiliumregale. The ORF (open reading frame) of this gene was 1770 nucleotides encoding a protein of 590 amino acids with a calculated molecular mass of 68.18 ku. The deduced amino acid sequence contained the highly conserved DDXXD and RRX8W motifs, which were both characteristic features of terpene synthase genes.LreTPSwas predicted to contain an organelle targeting peptide and showed 40% to 50% identity with known monoterpene synthases in other plants. Phylogenetic analysis ofLreTPSpositioned it in the TPS-b terpene synthase subfamily. Tissue analysis showed thatLreTPSwas highly expressed in the tepals and also expressed at a low level in leaves. Only detectable signal was found in stamen and style.
monoterpene synthase; clone; gene expression;Liliumregale
2013-10-22
2014-03-16
国家“十二五”科技支撑计划课题(2012BAD01B07,2013BAD01B07);北京市共建项目专项:森林质量升级及高效利用产学研联合研究生培养基地建设.
李路路(1989-),女,硕士研究生.研究方向:园林植物与观赏园艺.Email:lululi_anyang@163.com.通讯作者张启翔(1956-),男,教授,博士生导师.研究方向:园林植物资源与育种.Email:zqxbjfu@126.com.
S682.29
A
1671-5470(2014)04-0397-06

