葡聚糖凝胶过滤-HPLC法测定阿苯达唑前体胶束的包封率
陈 迹, 王建华
(新疆医科大学第一附属医院药学部, 乌鲁木齐 830054)
阿苯达唑被广泛应用于临床治疗钩虫病、蛔虫病、鞭虫病、蛲虫病、旋毛虫病、绦虫病、囊虫病等寄生虫病,临床疗效良好。国内外学者研究证实阿苯达唑也是一种较为有效的治疗包虫病的药物[1]。但由于阿苯达唑属于难溶性药物,口服后肠道吸收差,生物利用度相对较低,治疗包虫病病灶局部药物浓度低,长期用药则毒副作用增加[2],在一定程度上影响了阿苯达唑的抗包虫的作用。本研究将阿苯达唑制成前体胶束制剂(ZL200610200344.2),通过增加阿苯达唑的溶解度来提高阿苯达唑的体内吸收,增加其生物利用度,并利用其纳米特性使其具有一定的靶向性。阿苯达唑前体胶束在使用前为一无水的均匀混合物,由于使用前不是以胶束形式存在,只在使用或口服时才形成胶束,因而不存在微粒给药剂型普遍存在的物理稳定性问题。阿苯达唑前体胶束水化后的包封率是阿苯达唑前体胶束质量标准中比较重要一项内容。但目前还没有一种比较公认行之有效的测定前体胶束水化后的包封率方法,本研究采用葡聚糖凝胶过滤法分离胶束与游离药物,使用HPLC法测定阿苯达唑前体胶束的包封率,获得了较好效果,现报道如下。
1仪器与试剂UV-2550岛津紫外可见分光光度计(日本),BP211D Sarturius电子天平(美国),Waters Alliance2695/2487高效液相色谱系统(美国),电热恒温干燥箱(上海跃进医疗器械厂),高速自动平衡离心机(北京医用离心机厂)。阿苯达唑前体胶束(实验室自制批号:060530-1、060530-2、060530-3),阿苯达唑原料药(广西桂林制药厂,批号:20040301),阿苯达就唑标准品 (中国药品生物制品检定所,批号:100373-200301),sephdexG-50(中国医药上海化学试剂公司,粒度100~300 μm),硝酸钾、冰乙酸、无水乙醇、三乙胺、磷酸均为分析醇,甲醇、乙腈均为色谱醇,水为重蒸馏水。
2实验方法
2.1含量测定方法的建立
2.1.1 色谱条件 色谱柱ODS C18柱(150 mm×3.9 mm,5 μm),流动相为甲醇∶乙腈∶三乙胺-磷酸缓冲液(24∶20∶56),检测波长295 nm,流速1.0 mL/min,柱温30℃,进样量20 μL。
2.1.2 三乙胺-磷酸缓冲液的配制 精密吸取三乙胺35.68 mL,加入1 600 mL重蒸水,用磷酸调节pH值至3.0,置2 000 mL容量瓶中,加水稀释至刻度,备用。
2.1.3 贮备液的配制 精密称取阿苯达唑标准品4 mg置2 mL 容量瓶中,加入冰乙酸溶解,用甲醇稀释至刻度,得到2 mg/mL的贮备液。
2.1.4 标准曲线的绘制 精密吸取阿苯达唑贮备液0.02、0.04、0.06、0.08、0.10 mL分别置于10 mL容量瓶中,用甲醇稀释至刻度,配制浓度为4、8、12、16、20 μg/mL系列标准液,分别进样,记录色谱峰面积,以峰面积对浓度回归,得回归方程:A=48 259C+1 249.3,r2=0.999 8,线性范围:4~20 μg/mL,4、12、20 μg/mL的RSD值分别为3.9%、0.85%、2.5%(n=5)。
2.1.5 回收率试验 按处方剂量配制空白前体胶束,精密称取样品量的空白前体胶束于10 mL容量瓶中,加冰乙酸溶解,加甲醇稀释至刻度,再吸取0.1 mL溶液置10 mL容量瓶中,分别加入0.02、0.06、0.1 mL贮备液,加甲醇稀释至刻度,摇匀,得4、12 、20 μg/mL的含辅料标准液,分别进样20 μL,测峰面积,代入标准曲线换算成实际测定浓度,计算回收率,结果回收率分别为95.75%、98.11%、97.62%,RSD分别为3.27%、0.30%、1.49%(n=5)。
2.2阿苯达唑前体胶束包封率的测定
2.2.1 葡聚糖凝胶的洗脱曲线测定 取12 h被溶胀的sephdexG-50装柱10 cm,上样量为0.5 mL,流速为1 mL/min,用水洗脱。以1 mL为1个流份,收集前20 mL,共计20个流份。从收集的样品中分别吸取0.5 mL加1 mL冰醋酸再加3 mL甲醇稀释。采用HPLC法测定其含量,绘制阿苯达唑胶束洗脱曲线,见图1。
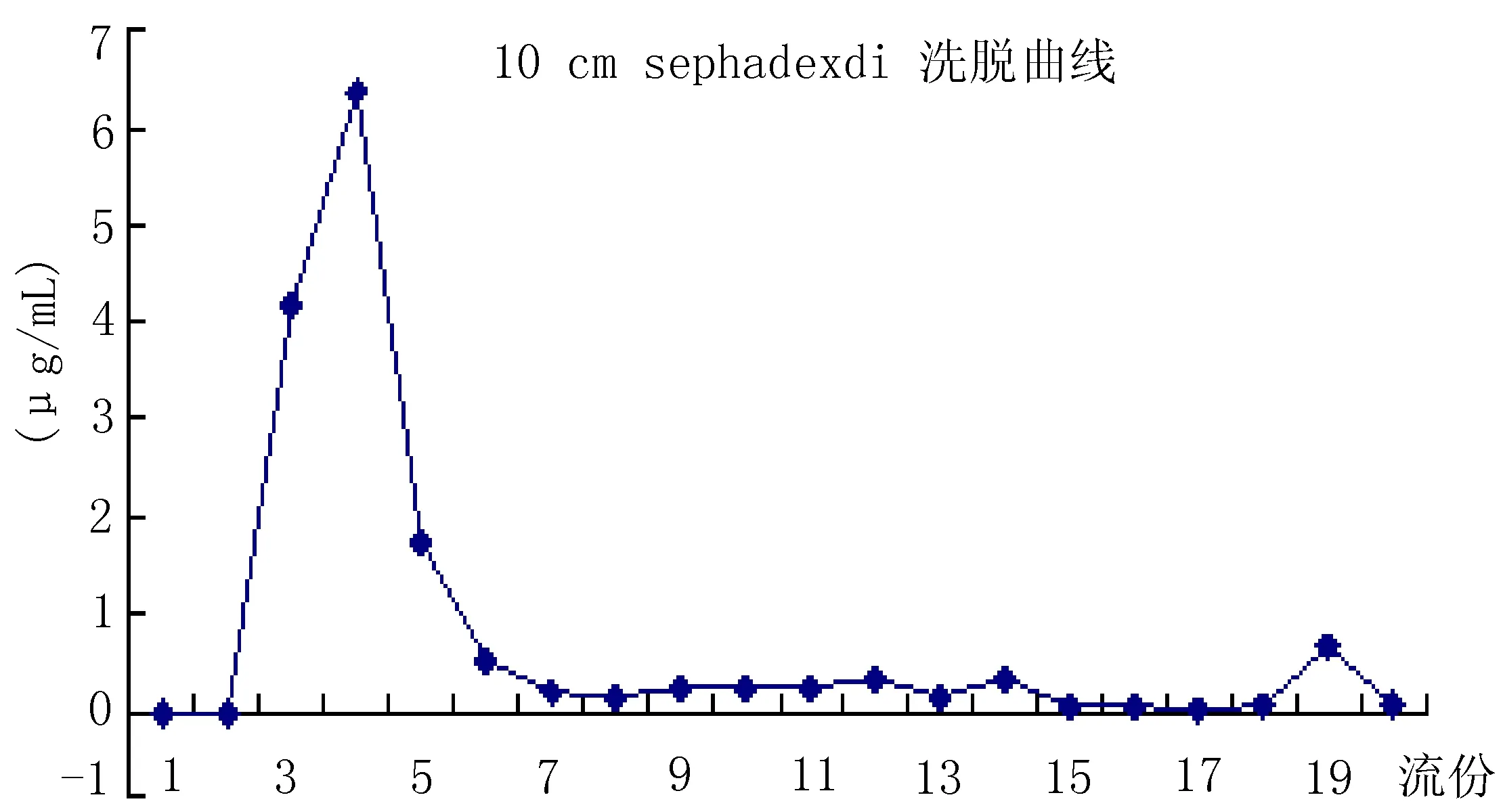
图1 阿苯达唑胶束洗脱曲线
2.2.2 阿苯达唑胶束溶液、阿苯达唑水饱和溶液通过葡聚糖凝胶的情况比较 分别配制含有相同含量的阿苯达唑胶束水化溶液、阿苯达唑水溶液。分别吸取0.5 mL上柱(高度为10 cm),用水洗脱,流速为1 mL/min。以1 mL流份为1个点,收集前15 mL。然后从每一份中吸取0.2 mL加1 mL冰醋酸加3 mL甲醇稀释,采用HPLC法测定其含量。
由于阿苯达唑前体胶束水化溶液中含有包裹药物的胶束、以分子形式存在的游离的阿苯达唑 以及可能析出的阿苯达唑颗粒,而阿苯达唑水溶液中含有分子形式存在的游离的阿苯达唑以及阿苯达唑颗粒。由阿苯达唑前体胶束水化溶液、阿苯达唑水溶液洗脱曲线可以看出阿苯达唑水溶液中游离的阿苯达唑被葡聚糖凝胶吸附,阿苯达唑颗粒被葡聚糖凝胶阻挡都无法通过葡聚糖凝胶柱,洗脱曲线基本为1条直线。而阿苯达唑前体胶束水化溶液中的阿苯达唑胶束可以通过葡聚糖凝胶柱,在前10 mL流份就可以基本洗脱完全,阿苯达唑胶束和游离的阿苯达唑得到很好分离(图2)。
2.2.3 阿苯达唑前体胶束包封率的测定方法的确定 根据以上实验初步确定葡聚糖凝胶法测定阿苯达唑前体胶束方法为:称取适量阿苯达唑前体胶束于100 mL容量瓶中,配制阿苯达唑浓度为0.05 mg/mL水化液作为样品,取水化液0.1 mL于10 mL容量瓶中,2 mL冰醋酸溶解,甲醇定容,采用HPLC法测定其含量,计算浓度C0。另取0.5 mL水化液样品上柱,用水洗脱,流速控制为3 mL/min;接取10 mL洗脱液,取2 mL于10 mL容量瓶中,2 mL冰醋酸溶解,甲醇定容,采用HPLC法测定其含量,计算浓度C1,按公式包封率 (%)= (经柱分离的胶束含药量/总药量)×100%计算包封率,即包封率(%)=(C1/C0)×100%。

图2 阿苯达唑洗脱曲线
2.2.4 阿苯达唑前体胶束包封率测定 按“2.2.3”项下方法测定3批前体胶束(060530-1、 060530-2、060530-3)的包封率,结果包封率为76.38%~81.08%, RSD=6.81%,回收率为(92.23±3.57)%,见表1。

表1 阿苯达唑前体胶束水化后的包封率(n=3)
2.3包封率测定方法的回收率测定称取适量阿苯达唑前体胶束于100 mL容量瓶中,配制阿苯达唑浓度为0.05 mg/mL水化液作为样品,取0.5 mL水化液样品上柱,用水洗脱,流速控制为1 mL/min;接取10 mL洗脱液,作为去除了游离药物的胶束,精密吸取2 mL于10 mL容量瓶中,2 mL冰醋酸溶解,甲醇定容,用HPLC来测定其含量,计算浓度C1。另取洗脱液(即去除了游离药物的胶束)2 mL上柱,用水洗脱,流速控制为1 mL/min;接取10 mL洗脱液,从中精密吸取2 mL于10 mL容量瓶中,2 mL冰醋酸溶解,甲醇定容,用HPLC来测定其含量,计算浓度C2。计算回收率/%=(C2/C1)×100%,实验结果见表2。
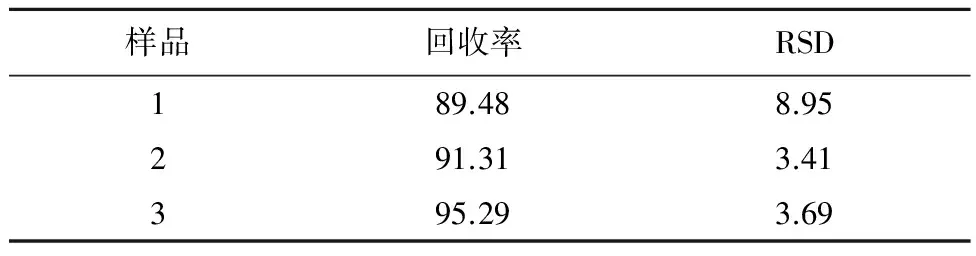
表2 方法回收率(%, n=3)
3讨论
目前关于包封率测定方法很多,主要有凝胶过滤法[3]、透析法[4]、超速离心法[5]、超滤法[6]及离子交换树脂法[7]等。考虑到阿苯达唑前体胶束水化液中游离药物以微粒形式存在,超速离心法和超滤法在超速离心过程中会使游离药物和胶束同时沉淀出来,分离不开。同时采用离心法测定阿苯达唑前体胶束的包封率,离心法测定的包封率的结果较葡聚糖凝胶过滤法偏高,也验证了这种推测。若用透析法进行测定,由于在大量透析液中胶束的结构可能发生改变,导致药物的泄漏,从而影响包封率。高晓黎等[3]研究显示,粒径为100~300 μm的Sephadex G-50最适于脂质体包封率的测定。本研究前期预实验采用100~300 μm 的Sephadex G-50及粒径较小的Sephadex G-20葡聚糖凝胶将游离阿苯达唑和阿苯达唑胶束分离,Sephadex G-50的分离效果较佳,再采用HPLC法测定阿苯达唑前体胶束的包封率可以有效去除辅料的干扰,方法可行,重复性较好,结果准确,可以作为阿苯达唑前体胶束质量标准控制的办法。
在实验过程中,洗脱曲线上仅明显有1个峰,此峰为阿苯达唑胶束峰。游离药物被葡聚糖凝胶吸附,较难被洗脱下来。所以葡聚糖凝胶在使用3~5次后就该更换,否则对实验结果会产生影响。
参考文献:
[1] Davis A,Pawlowskizs DH. Multicentre clinical trials of benzimidazolecarbamates in human echinococcosis[J].Bull World Health Organiza,1986,64(3):383-388.
[2] 王建华,温浩.阿苯达唑的体内过程和剂型研究进展[J].中国寄生虫病防治杂志,2002,15(3):187-189.
[3] 高晓黎,季兴梅. 葡聚糖凝胶柱色谱法测定脂质体包封率的条件筛选[J]. 中国药学杂志,2003,38(7):515-517.
[4] 马晶, 邓树海.顺铂前体脂质体的制备及包封率测定[J].中国医院药学杂志,2006,26(4):416-418.
[5] 杨继红, 蒋学华, 杨俊毅. HPLC测定葛根素长循环脂质体中葛根素的含量和包封率[J]. 华西药学杂志, 2006, 21(1):66-68.
[6] 雷国峰, 陈琳, 邓英杰. 超滤法-HPLC法测定灯盏花素脂质体包封率[J]. 沈阳药科大学学报,2006,23(4):237-239.
[7] 赵研, 于彬, 邓意辉. 主动载药法制备硫酸长春新碱脂质体及其包封率的测定[J]. 中国药学杂志,2005,40(20):1559-1562.

