以三嗪衍生物及对苯二甲酸为配体的四个配合物的合成、表征及性质研究
陈 鹏 杜 琳 周 杰 乔永峰 李 彬 赵琦华*,
(1云南大学化学科学与工程学院,昆明 650000)
(2铜仁学院生物与化学工程系,铜仁 554300)
近10年来,超分子配位聚合物因具有独特的结构和在非均相催化[1]、气体分离与吸附[2-3]、离子交换[4]、分子磁性[5]、荧光[6-7]和药物传递[8]等方面潜在的应用前景,受到了人们的广泛关注。在构筑超分子配合物的过程中,金属离子的选择和配体的设计是关键性的因素[9]。通过选择合适的金属离子和有机功能配体,可以构筑形成一维链状[10]、二维网格状[11]和三维网状[12-14]配合物。芳香羧酸类配体由于具有其刚性、含多配位点[15]等特点持续受到晶体工程工作者的青睐,仅使用对苯二甲酸等简单芳香羧酸作为刚性有机多齿配体,就合成了大量配位聚合物[16-21]。另外,芳香类三嗪氨基化合物由于具有多个N原子和氨基,极易形成N-H…N氢键,将低维化合物连接成具有多维结构的超分子化合物[22-27]。在本文的研究工作中,选择了具有丰富配位模式的H2BDC作为桥连配体,以PTZDA作为螯合配体,与过渡金属盐混合,在水热条件下合成得到4个一维链状配合物,通过氢键相互作用,这4个配合物最终形成三维超分子结构的配合物。
1 实验部分
1.1 仪器与试剂
晶体结构的测定用的是Bruker AXS APEⅡCCD面探单晶衍射仪。红外光谱采用的是Thermo-Nicolet AVATAR FTIR 360型Fourier变换红外光谱仪(KBr压片),扫描范围 400~4 000 cm-1。C、H、N 元素分析用Vario ELⅢ型元素分析仪测定。荧光性质测试使用日立F-4500型荧光光谱仪。X-射线粉末衍射所用仪器为TTRⅢ型转靶X-射线衍射仪(日本理学)。TG曲线的测试用的是NETZSCH STA 449F3型热重分析仪(氩气保护)。磁性测试使用的仪器为Quatum Design PPMS60000型磁强计。配体PTZDA根据文献[28]合成,其他试剂全为分析纯试剂,使用前未经进一步纯化。
1.2 配合物的合成
配合物 1的合成:称量 H2BDC、Mn(ClO4)2·6H2O、PTZDA 各 0.1 mmol放入锥形瓶,再加入混合溶液 (VDMF∶VH2O∶VC2H5OH=1∶2∶4)16 mL, 在室温下搅拌30 min。将上述混合溶液转移至聚四氟乙烯水热反应釜中,用不锈钢外套封装,迅速升温到100℃,在该温度下保持晶化72 h后关闭烘箱。自然冷却至室温,得到黄色长方体状晶体,产率约为65%(基于金属)。将该晶体用乙醇清洗,自然干燥,得到的晶体经过PXRD表征,显示为可用于性质测定的纯相,如Fig S1所示。按照C16H16MnN6O5计算的元素分析为:实验值(%):C(44.93),H(3.75),N(19.67);计算值(%):C(44.91),H(3.76),N(19.65)。IR(cm-1):3 428.03(s),3 328.02(w),3 219.52(w),1 618.63(m),1 568.07(s),1 548.30(s),1 388.13(s),824.82(m),745.85(m)。配合物2~4的合成与配合物1相似,详细步骤见SI。
1.3 晶体结构测定
在298 K的条件下,用Bruker Smart APEX II CCD单晶衍射仪,经石墨单色化的Mo Kα射线(λ=0.071 073 nm)对配合物1~4的X-射线单晶衍射数据进行收集。使用SADABS程序进行吸收校正[29]。用SHELXS-97程序对晶体结构进行了解析,并使用SHELXL-97程序程对所有非氢原子坐标和各向异性温度因子进行了全矩阵最小二乘法精修[30]。晶体数据参数、数据收集情况及精修结果汇总在表1中,部分键长键角见表S1。所有氢原子采用理论加氢及由差值Fourier合成法得到。
CCDC:9425971;942598,2;942599,3;942600,4.
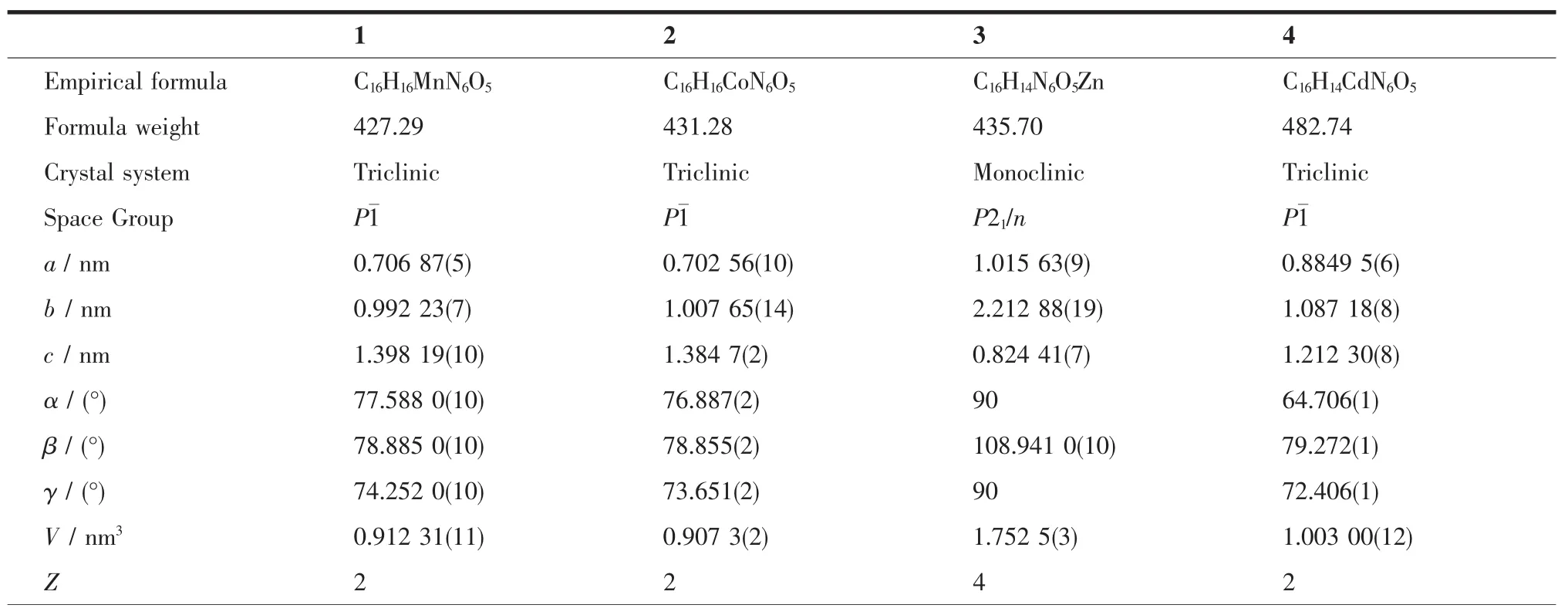
表1 配合物1~4的晶体学数据表Table 1 Crystallographic data and structure refinement for complexes 1~4 at 298 K
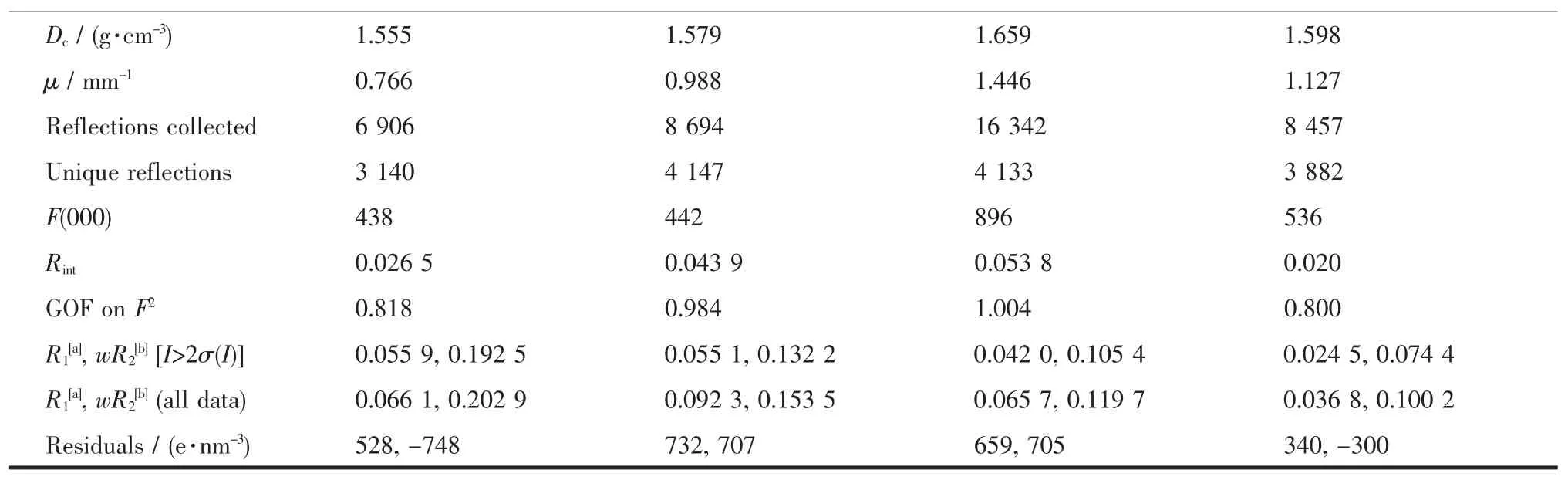
Continued Table 1
2 结果与讨论
2.1 晶体结构解析
2.1.1 配合物 1~4的晶体结构解析
配合物1~4中,金属离子采取不同的配位模式,分别通过对苯二甲酸桥连形成一维链状配合物,配合物1~4的不对称单元图和一维链状图见表2所示。
配合物1和2属于异质同晶,以配合物1为例,说明它们的结构特征。如表2所示,配合物1的不对称单元包括1个Mn(Ⅱ)原子,1个PTZDA配体,1个BDC2-配体,1个配位水分子。Mn(Ⅱ)离子位于变形八面体中心,6个配位点被2个氮原子和4个氧原子占据。2个氮原子来自PTZDA配体,与金属离子螯合配位;其中2个氧原子来自1个BDC2-配体,与Mn(Ⅱ)离子形成螯合配位模式,另1个BDC2-配体提供1个氧原子与金属离子桥连,最后1个配位点被配位水的氧原子占据,这6个配位原子与中心金属离子连接,形成扭曲的八面体结构:N2和O5占据轴向顶点,O1、N1、O3i(Symmetry code:i1+x,-1+y,z)和O4i位于八面体的赤道平面。在配合物1中,4个Mn-O 键的键长在 0.202 3(5)~0.230 0(4)nm 范围内,2个 Mn-N 的键长分别为 0.225 0(5)和 0.226 2(5)nm。其中,配体的 BDC2-在配合物中采取 μ2-κ2O,O′:O′′桥连配位模式,连接金属离子Mn(Ⅱ),将配合物连成一维链。
与配合物1和2相似,配合物3的不对称单元中包括1个Zn(Ⅱ)离子,1个PTZDA配体,1个BDC2-配体,1个配位水分子(表2)。中心离子Zn(Ⅱ)处于5个配位原子的中心,分别与来自PTZDA上的2个氮原子、2个不同的BDC2-配体上的2个氧原子和1个来自于配位水的氧原子配位,形成不规则的四方锥结构(将在下一段详细讨论)。在配合物3中,3个Zn-O 键的键长在 0.198 1(2)~0.212 0(2)nm 范围内 ,2个 Zn-N 的键长分别为 0.211 2(3)和 0.214 4(2)nm。BDC2-在配合物中采取 μ2-κ2O:O′的配位模式,连接金属离子Zn(Ⅱ),将配合物连成“之”字形一维链状结构,Zn…Zn…Zn 之间的角度为 123.129°,Zn…Zn 之间的距离为1.096 5(9)nm。另外,在配合物3中,配体BDC2-的1个羧基(O3-C-O4)与该BDC2-的苯环间发生了很大程度的扭曲(羧基的3个原子O-C-O所在平面与苯环所在平面间的角度是34.745°)。
由于Zn(Ⅱ)离子处于五配位环境中,其几何构型可能为四方锥(如 Fig.S2-a)或三角双锥(如 Fig.S2-b),我们可以通过几何参数τ来确定[31]。根据文献的计算方法,定义几何参数 τ=(β-α)/60°来描述中心离子具有五配位结构的配合物的几何构型。随着该参数的连续变化,几何构型在三角双锥和四方锥之间也发生相应的变化。通过计算,配合物3的τ=0.420 9(α=135.16°,β=160.39°),可知配合物 3 中 Zn(Ⅱ)的配位构型更趋向于四方锥。
如表2所示,在配合物4的不对称结构单元里,包含1个Cd(Ⅱ)离子,2个不完整的BDC2-分子片段,1个PTZDA配体,1个配位水分子(表2)。Cd(Ⅱ)离子与6个配位原子配位,这6个原子分别是来自PTZDA上的2个氮原子、2个BDC2-配体上的3个氧原子和1个配位水的氧原子,形成不规则的八面体结构。4 个 Cd-O 键的键长在 0.224 1(3)~0.247 2(3)nm范围内,2个 Cd-N的键长分别为 0.229 9(3)和0.232 5(3)nm。与配合物1~3不同的是,在配合物4中,配体BDC2采取了2种不同的配位模式,即:双-单齿桥连模式(μ2-κ2O:O′)和双-双齿螯合模式(μ2-κ2O,O′:O″,O″′)与金属离子 Cd(Ⅱ)连接,将配合物连成一维曲轴形的链 (Cd…Cd…Cd之间的角度为90.80°,Cd…Cd的距离为1.165 6(6)nm),而不是配合物3中的“之”字形结构。
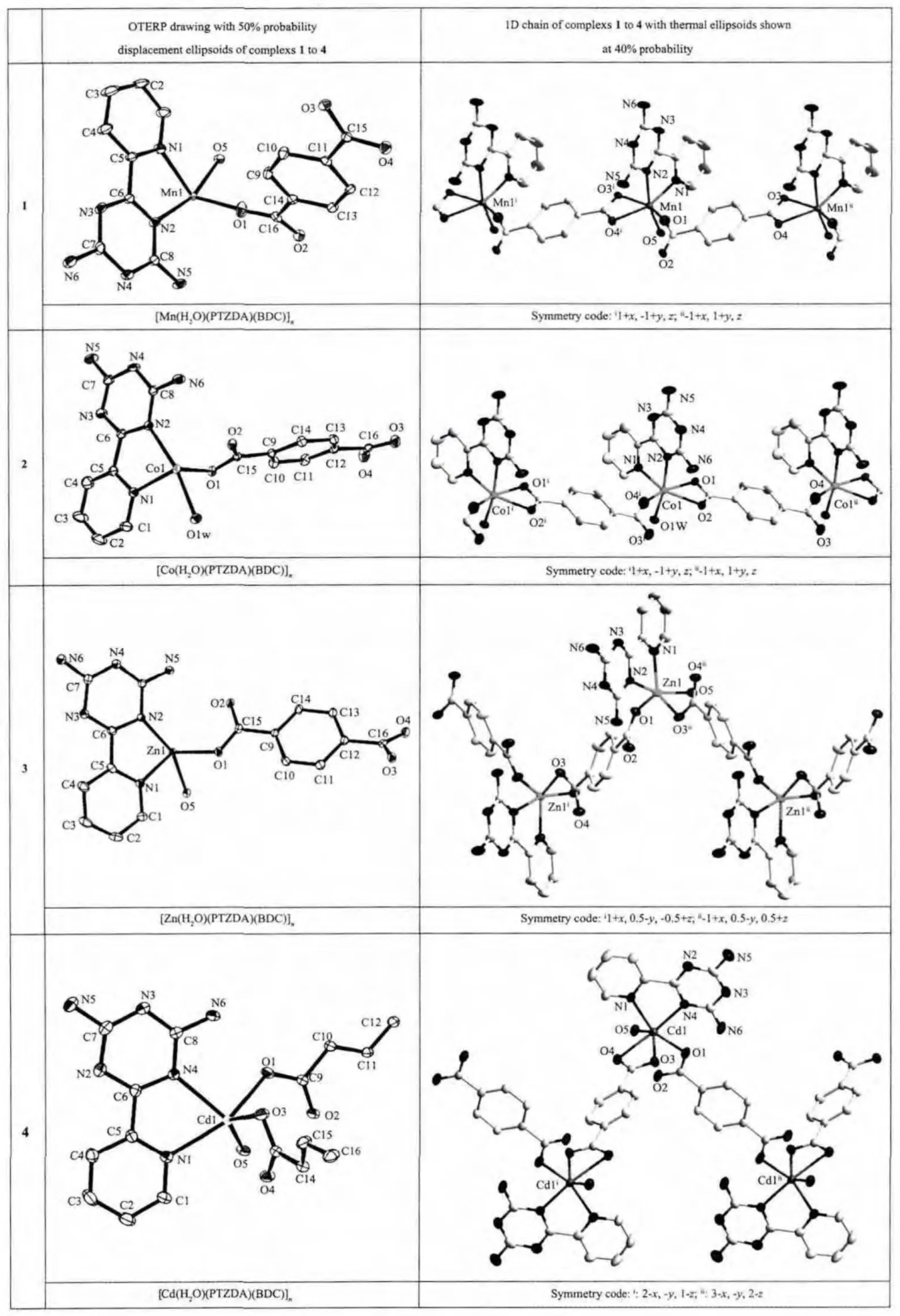
表2 配合物1~4的不对称结构单元图和一维链状图Table 2 Asymmetric unit and 1D chain of complexs 1~4
2.1.2 配合物的氢键作用
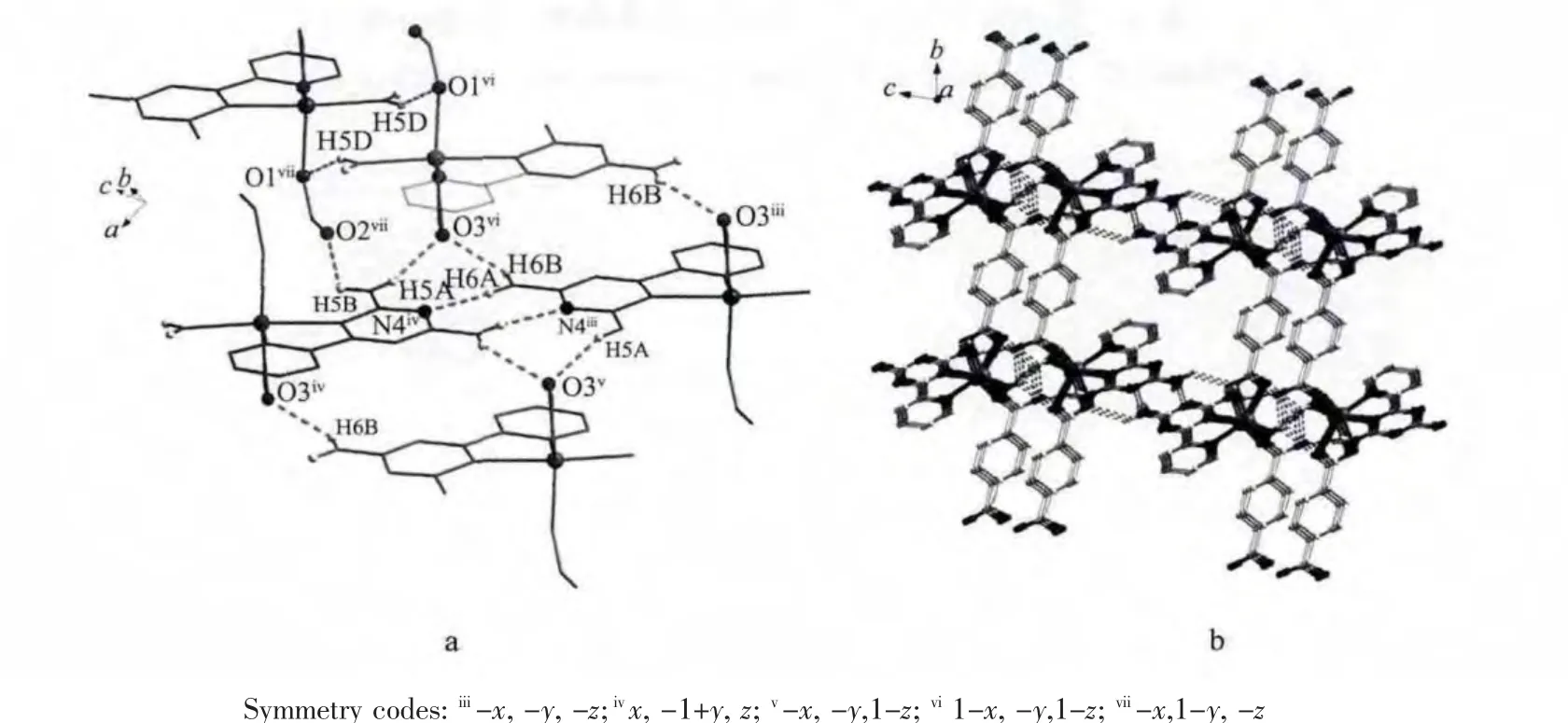
图1 配合物1的相邻的一维链状之间的氢键连接图和三维超分子堆积图Fig.1 Details of Hydrogen bonds(dotted lines)linking of the neighboring chains and 3D Hydrogen bonds network for complex 1
如Fig.1a所示,在c方向上,PTZDA配体中的N4原子,与另一条链PTZDA上的H6A形成氢键(N4…N6 距离为 0.299 4(84)nm),来自于羧基上的O3原子与相邻链上的PTZDA配体的氨基上的H6B(Symmetry code:B-1+x,1+y,z)原子形成氢键(O3…N6 距离为 0.282 7(50)nm),在同方向上,相邻链之间的O2和H5B亦形成氢键;而在a方向上,一条链上的BDC2-的O3原子与来自相邻链上的配体PTZDA的H5A原子间形成氢键 (O3…N5距离为0.296 2(29)nm)。通过这两个方向的氢键,将配合物1构筑成了三维超分子结构(见Fig.1b)。配合物2~4的相邻的一维链之间也形成了丰富的氢键,将配合物连接成三维超分子结构(Table S3),配合物1~4的氢键数据见Table S2。
2.2 配合物的性质
2.2.1 荧光性质
众所周知,Zn2+和Cd2+这样具有d10电子构型的金属-有机化合物能表现出荧光性质[32-33]所以,本文也对文章中的配合物3和4进行了荧光性质的研究。在室温条件下,测试了配合物3和4的固态荧光性质,结果如Fig.2所示。配体H2BDC和PTZDA分别在395和471 nm处有明显的荧光发射峰。配合物4在395和471 nm有2个明显的发射峰,通过与配体的荧光性质相比较可推测,这2个峰应该是由于分子内部的π*-π跃迁产生的[34]。而配合物3在395 nm处的发射峰明显低于配合物4。根据结构分析,配合物4中一个BDC2-配体与金属离子采取螯合配位,增加了体系的刚性,使配合物4在该位置的荧光吸收强度明显大于配合物3[35-37]。
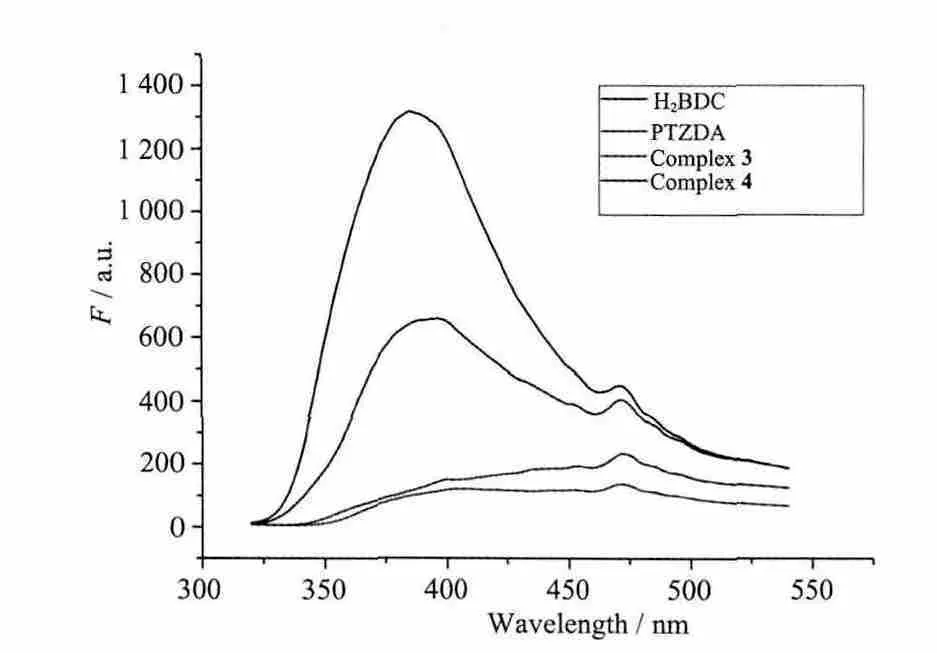
图2 配合物3~4和配体PTZDA、H2BDC的荧光发射谱图Fig.2 Luminescence emission spectrum of complex 3,4,PTZDA and H2BDC
2.2.2 磁性
在2~300 K的温度范围内,外加磁场强度为1 000 Oe,测定了配合物1的变温磁化率,并且对数据就行了 Pascal常数(5×10-5cm3·mol-1)修正。对配合物1的χM-1对T图(Fig.3的内插图所示)分析可知,在整个温度区间内,配合物1磁化率倒数随温度变化的曲线呈线性关系,说明在整个温度区间内,符合Curie-Weiss定律。进过Curie-Weiss拟合(χM=C/(T-θ)),计算得到居里常数 C=4.475 4 cm3·K·mol-1,θ=-0.286 0 K,负的Weiss值表明配合物中存在反铁磁相互作用。
在 300 K 时,配合物 1 的 χMT 等于 4.485 9 cm3·mol-1·K,随着温度的降低而降低。在300 K到50 K的范围内,下降缓慢。在50 K后,χMT值急剧减小,并且在 2 K 时达到最小值 4.122 5 cm3·mol-1·K。假设MnII离子间为各向异性相互作用,对配合物1的磁强度进行了非线性拟合,公式如下:
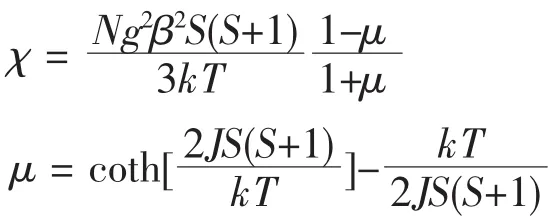
式中 S=2.5,得到最佳拟合结果为 g=2.020 9,J=-0.030 0 ×0.695 cm-1,R=2.3 ×10-5(R=Σ [(χM)obs-(χM)calcd]2/Σ (χM)obs2)。很小的负 J 值,表明配合物 1中MnII离子间为很弱的反铁磁相互作用,这和文献报道的一维链状MnII化合物的磁相互作用一致[38],表明经BDC2-桥连的配合物的金属离子间的耦合作用非常弱。对配合物2的χM-1对T图(图Fig.3-b的内插图所示)分析可知,在整个温度区间内,配合物2磁化率倒数随温度变化的曲线呈线性关系,在300到2 K的范围内,配合物2的χMT,随着温度的降低而降低,表明配合物2也是显示反铁磁性。配合物1中,经H2BDC桥连的Mn(Ⅱ)离子之间距离为1.050 46 nm,而配合物1中Co(Ⅱ)离子间距离为1.053 76 nm,可推知配合物2的磁性质也非常弱。
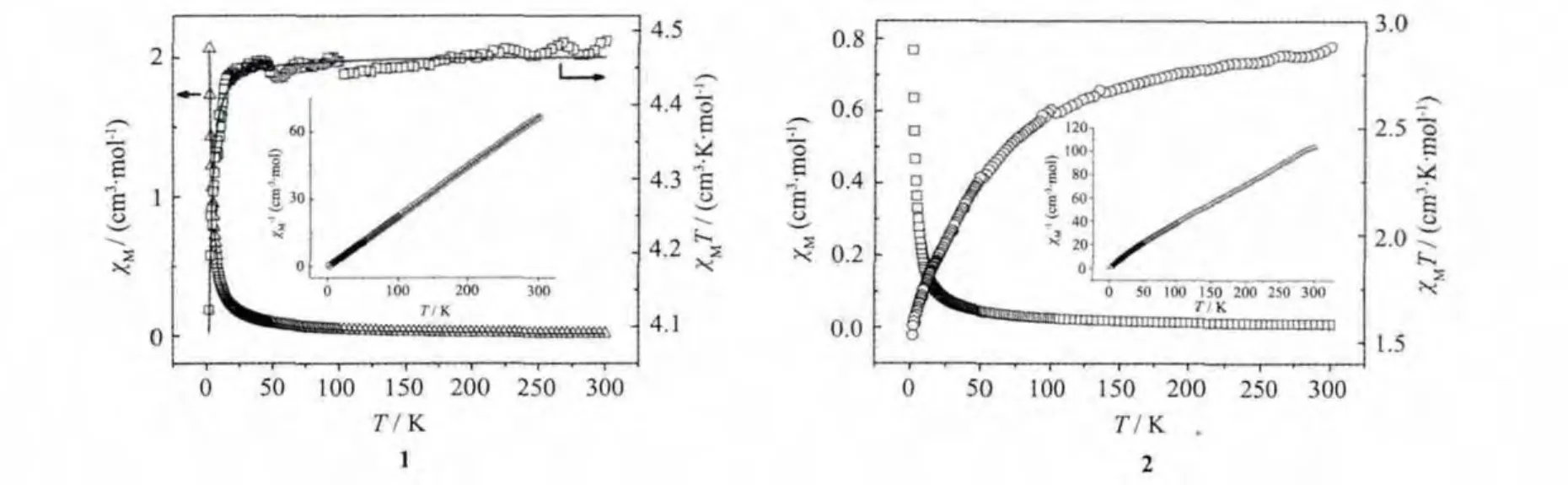
图3 配合物 1~2的 χM和 χMT对 T图(内插 χM-1对 T图)Fig.3 Temperature dependence of χMand χMT for complex 1 and 2
2.2.3 配合物的热稳定性
在氩气氛中,升温10℃·min的条件下,在20~800℃的温度区间内,对配合物1~4的热稳定性进行了测试和表征(见Fig.4)。由于配合物1~2具有相似的热稳定性质,现在只讨论配合物1的热稳定性。配合物1的分解共分为3个阶段,从20~140℃,配合物失去一分子配位水,理论失重率4.21%,实际失重率为4.10%;第二阶段从374~554℃,可能由于PTZDA配体的三嗪环部分分解和对苯二甲酸骨架的分解,此区间的实际失重率为58.04%,理论失重速率为58.79%;第三阶段在800℃后继续分解,这类在高温下仍继续分解的配合物在文献中已有报道[39]。配合物3在393~448℃区间配体PTZDA分解,理论失重率为42.95%,实际失重率为 42.56%。配合物4在20~152℃温度范围内失去一分子游离甲醇,理论失重率为8.63%,实际失重率为 8.99%;在333~453℃温度区间配体PTZDA分解,理论失重率为 35.28%,实际失重率为 35.43%。
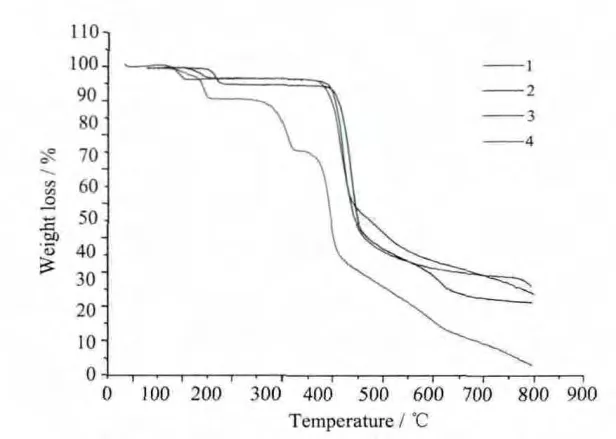
Fig.4 配合物1~4的热重曲线图Fig.4 TG curve for compound 1 to 4
3 结 论
本文共合成与表征了4个配合物,晶体结构分析表明,配合物1~4中,配体PTZDA与中心金属离子螯合配位,金属离子通过桥连配体BDC2-连结成一维链,一维链间通过氢键作用扩展形成了三维超分子结构。
研究表明配合物1和2均显示弱的反铁磁性。配合物3和4的荧光性质分析表明这2个配合物均为配体发光。另外,这4个配合物的热稳定性进行了研究,4个配合物的金属-有机骨架在低于400℃温度范围内具有较好的稳定性。
[1]Yoon M,Srirambalaji R.Chem.Rev.,2011,112:1196-1231
[2]Li J R,Sculley J.Chem.Rev.,2011,112:869-932
[3]Sumida K,Rogow D L.Chem.Rev.,2011,112:724-781
[4]Kitagawa S,Kitaura R.Angew.Chem.Int.Ed.,2004,43:2334-2375
[5]Kurmoo M.Chem.Soc.Rev.,2009,38:1353-1379
[6]Cui Y,Yue Y.Chem.Rev.,2011,112:1126-1162
[7]Allendorf M D,Bauer C A.Chem.Soc.Rev.,2009,38:1330-1352
[8]Miller S R,Heurtaux D.Chem.Commun.,2010,46:4526-4528
[9]Ye B H,Tong M L,Chen X M,et al.Coord.Chem.Rev.,2005,249:545-565
[10]Shin D M,Lee I S,Lee Y A,et al.Inorg.Chem.,2003,42:2977-2982
[11]Kondo M,Shimamura M,Noro S I,et al.Chem.Mater.,2000,12:1288-1299
[12]Ma B Q,Sun H L,Gao S.Inorg.Chem.,2005,44:837-839
[13]Dybtsev D N,Chun H,Kim K.Angew.Chem.Int.Ed.,2004,43:5033
[14]Chen K,Dong D P,Sun Z G,et al.Dalton Trans.,2012,41:10948-10956
[15]Rather B,Zaworotko M J.Chem.Commun.,2003,7:830-831
[16]Chui S S F,Lo S M F,Williams L D.Science,1999,283:1148
[17]Li H,Eddaoudi M,OKeeffe M,et al.Nature,1999,402:276
[18]Eddaoudi M,Kim J,Yaghi O M,et al.Science,2002,295:469
[19]Liu Y L,Eubank J F,Cairns A J,et al.Angew.Chem.Int.Ed.,2007,46:3278-3283
[20]Liu X M,Lin R B,Zhang J P,et al.Inorg.Chem.,2012,51:5686-5692
[21]Zhong D C,Deng J H,Luo X Z,et al.Cryst.Growth Des.,2012,12:1992-1998
[22]Chan C W,Michael D,Mingos P,et al.Chem.Commun.,1996,1:81-83
[23]MalyKE,GagnonE.J.Am.Chem.Soc.,2007,129:4306-4322
[24]Duong A,Maris T.Cryst.Growth Des.,2010,11:287-294
[25]Duong A,Maris T.Inorg.Chem.,2011,50:5605-5618
[26]DuongA,Métivaud V.Cryst.Growth Des.,2011,11:2026-2034
[27]ZHANG Xue-Mei(张雪梅),QU Zhi-Bin(区志镔),CHEN Shi(陈实),et al.Chinese J.Inorg.Chem.(无机化学学报),2012,28(12):2667-2673
[28]Case F H,Koft E.J.Am.Chem.Soc.,1959,81(4):905-906
[29]Blessing R H.Acta Crystallog.,1995,A51:33-38
[30]Sheldrick G M.SHELXL-97,Program for X-ray Crystal StructureDetermination,GöttingenUniversity,Germany,1997.
[31]Addison A W,Rao T N,Reedijk J,et al.J.Chem.Soc.,Dalton Trans.,1984:1349-1356
[32]Zeng M H,Feng X M,Chen X M.Dalton Trans.,2004:2217-2223
[33]Mahata P,Natarajan S.Eur.J.Inorg.Chem.,2005:2156-2163
[34]HU Zong-Zhi(胡宗志),ZHAO Jun(赵君).Chinese J.Inorg.Chem.(无机化学学报),2011,27(1):184-188
[35]Zhu L N,Zhang L Z.Inorg.Chem.Commun.,2002,5:1017-1021
[36]CHEN Shu-Yang(陈书阳),ZHAO Wei(赵伟),GUO Ying-Chen(郭应臣).Chinese J.Inorg.Chem.(无机化学学报),2013,29(6):1165-1170
[37]Xu H B,Su Z M.Inorg.Chem.Commun.,2004,7:260-263
[38]Munno G D,Poerio T,Julve M,et al.J.Chem.Soc.,Dalton Trans.,1997,601-606
[39]Xie M H,Yang X L,Zou C,et al.Inorg.Chem.,2011,50:5318-532

