混合培养对城市污水厂二级出水培养能源微藻的生长促进作用
朱树峰,于茵,胡洪营,2*
1. 清华大学环境学院环境模拟与污染控制国家重点联合实验室,北京 100084;2. 清华大学深圳研究生院国家环境保护环境微生物利用与安全控制重点实验室,广东 深圳 518055;3. 中国环境科学研究院水环境系统工程研究室,北京 100012
随着能源危机的日益严重,微藻生物柴油作为新型可再生能源(Vasudevan和Briggs, 2008)引起了国内外研究者的关注。同时,微藻在污水深度脱氮除磷方面也具有明显的优势。Oswald等(Oswald等, 1957; Gonzalez等, 1997; Mallick, 2002)于1958年提出利用微藻处理污水的概念后,作为污水三级处理的微藻深度脱氮除磷也得到了较快的发展。基于微藻能够同时应用于污水脱氮除磷和生物能源生产的事实,胡洪营等(胡洪营等, 2009; Hu等, 2010;Hu等, 2011)提出了“污水深度脱氮除磷与微藻生物能源生产耦合工艺”。该工艺可净化水质并同时回收氮磷、获得高价值藻细胞生物质。然而,要实现上述工艺从实验室研究到大规模应用,能源微藻在城市污水二级出水中的生长速率较慢及生物质产率较低是限制性因素之一。
关于提高微藻生产效率的方法,国内外开展了大量的研究,根据对应工序的不同可分为藻种选择、藻类培养两类。藻种选择方法是通过技术手段获得高产率的微藻藻株,主要技术包括开发快速筛选方法筛选大量藻种、研究生物质及油脂代谢机理和利用遗传学工具改性微藻(Ferrell和Valerie, 2008)但是有研究表明大量已选出的单一藻种培养不适于污水体系,污水体系里的杂藻、原生动物等能够降低单一藻种的生产效率甚至使培养系统崩溃(Cheng等, 2004; Hoffman等, 2008)。藻类培养方法是通过改变培养条件提高微藻的生产效率,温度、光照、营养盐等培养条件的改变虽然提高生产效率效果明显,但控制培养条件成本高且易于产生二次污染,不适合大规模应用于污水体系。
混合培养是在培养系统中,对2种及2种以上的高产率微藻进行培养以获得生物质的技术。许多研究报道,混合培养对微藻的生物质产量具有促进作用。对三角褐指藻Phaeodactylum tricornutum、杜氏盐藻Dunaliella salina和亚心形扁藻Platymanas subcordiformis3种海洋经济微藻在灭菌人工培养基条件下两两混合培养,在适合的接种比例下能够促进微藻生长、增加生物量(黄伟伟, 2009)。海洋原甲藻Phaeodactylum tricornutumBohl与三角褐指藻Phaeodactylum tricornutumBohlin进行混合培养时三角褐指藻的生长速率与生物质产量均高于单一藻种培养(周成旭等,2006)。Johnsond等(Johnson和Admassu, 2013)的研究表明,在人工培养基条件下,4种微藻组成的混合藻种生物质产量高于部分单一藻种培养的微藻。混合微藻通过细胞接触(Twirler, 2001)、化感作用(Floeder等, 2006)和生长资源竞争(Kuwata和Miyazaki, 2000)等机制相互影响,主要有促进、中性和抑制4种关系。影响机制受藻种的影响,选择合适的微藻进行混合培养能够有效提高生物质产率。此外,混合培养将适宜条件各异的高产率藻种混合,可以扩大培养系统的培养条件控制范围,从而降低培养系统的维护成本。大规模微藻混合培养系统抵御环境条件(温度、捕食者等)突变的能力也更强。因此,微藻混合培养的研究对生物质生产具有重要的意义。目前关于微藻混合培养的研究多集中于水华微藻生长抑制及人工培养基条件下常见经济微藻生物质生产,而关于污水条件下混合培养对能源微藻生长特性影响的研究未见报道。
本研究选取3株典型的高含油脂藻:栅藻LX1(Scenedesmussp. LX1)、椭圆小球藻YJ1(Chlorella ellipsoideaYJ1)和雨生红球藻(Haematococcus pluvislis),对比研究3株微藻单一藻种、两两混合藻种条件下的生长特性,以筛选出能够有效促进城市污水二级出水条件下微藻生物质生产的混合藻种。
1 材料与方法
1.1 材料
1.1.1 水样
生活污水二级出水(以下简称“二级出水”),取自北京G污水处理厂的二沉池出水。水样先经过0.45 μm的滤膜过滤(滤后二级出水的水质为:pH=7.87,ρ(TN)=26.8 mg·L-1,ρ(TP)=0.03 mg·L-1),再经高温高压灭菌(121 ℃,20 min)后用于藻类培养。
1.1.2 藻种
栅藻LX1(Li等, 2010a)由李鑫等从低营养环境中分离获得,在中国微生物菌种保藏管理委员会普通微生物中心的保藏号为No.3036。椭圆小球藻YJ1由杨佳(Yang等, 2011)分离自城市生活污水二级出水,在中国微生物菌种保藏管理委员会普通微生物中心的保藏号为No.3037。雨生红球藻由中国科学院淡水藻种库(武汉)提供,其编号为FACHB-712。所选3株藻种均能够在污水条件下快速生长并积累油脂。3种微藻均采用mBG11培养基(Li等, 2010b),试验前,将各个藻种置于人工气候箱中培养至对数生长期,培养条件:25 ℃,光照强度40~60 Lux,相对湿度75%,光暗比14 h:10 h。
1.2 试验方法
1.2.1 藻类生长特性研究
利用灭菌二级出水对3种试验藻种分别进行单一藻种和两两混合藻种的培养。向500 mL锥形瓶中加入200 mL试验水样待用。控制每瓶初始接种藻细胞总干物质量浓度均为7 μg/L,按照不同藻种组合计算所需藻液量进行接种,不同藻种组合中藻细胞数目比及藻细胞干物质量浓度比见表1。接种完成后,将所有培养瓶中已灭菌的试验水样均补充到220 mL。锥形瓶置于光照强度1 400 Lux,光暗比14 h:10 h、25 ℃的人工气候箱中培养。每组试验做3个平行样。
采用显微镜血球计数板进行藻细胞计数,换算得到培养液中的藻细胞密度。配制不同质量浓度梯度的藻液,利用血球计数板法在显微镜下测定不同质量浓度梯度的藻液的藻密度,并利用SS测定方法测定藻细胞干物质量浓度质量浓度,做藻密度与干物质量浓度的标准曲线,结果见表2。

表1 不同藻种组合初始接种藻细胞数目比及藻细胞干物质量浓度比Table 1 The initial cell density ration and biomass ratio of different microalgae species

表2 藻细胞干物质量浓度与藻密度的标准曲线Table 2 The standard line between the biomass and cell density of three microalgae
1.2.2 水质指标测定
水质指标测定均采用国家环境保护总局颁布的标准方法,TN、TP 和NH4+-N的测定方法分别为过硫酸钾氧化紫外分光光度法、钼酸铵分光光度法和纳氏试剂分光光度法(国家环境保护总局, 2002)。
1.3 数据分析
Logistic 模型是描述有限环境下种群生物量增长的经典模型(种云霄, 2005),藻细胞干物质量浓度是表征种群生长量的重要参数,因此利用Logistic模型描述藻细胞的干物质量浓度增长规律:
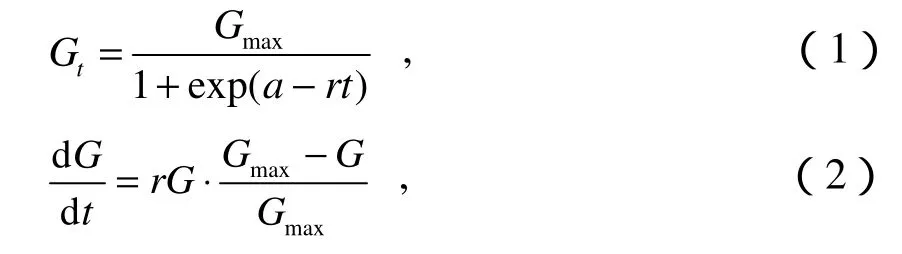
式中,Gt为t时刻的干物质量浓度质量浓度,单位为mg·L-1;t为培养时间,单位为d;Gmax为最大干物质量浓度质量浓度,单位为mg·L-1;a为常数,表示曲线对原点的相对位置;r为种群的内禀增长速率,单位为d-1,指单个个体潜在的最大增长速率;dG/dt为种群生物量增长速率,单位为mg·(L·d)-1。
式(1)表示种群生物量随时间变化的生长曲线,具“S”型特征。式(2)表示生物量增长速率随密度变化的规律。
藻细胞在对数增长期的比生长速率可通过式(3)进行计算。

式中,μ为对数增长期的比生长速率,单位为d-1,t1和t2为对数增长期的开始和结束时间,单位为d,G1和G2为t1和t2时刻对应的藻细胞密度,单位为mg·L-1。
2 结果与讨论
2.1 栅藻LX1和椭圆小球藻YJ1混合培养的生长特性
栅藻LX1和椭圆小球藻YJ1在灭菌污水条件下,混合藻种及单一藻种(对照组)培养的生长曲线如图1。栅藻LX1和椭圆小球藻YJ1单一藻种培养条件下的生长曲线均符合“S”型曲线,接种后前2 d均为迟滞期,从第2天开始进入生长较快的对数生长期,栅藻LX1第8天进入稳定期,椭圆小球藻YJ1第7天进入稳定期。对照组椭圆小球藻YJ1生长初期藻细胞干物质量浓度质量浓度下降,但自第3天起藻细胞干物质量浓度质量浓度上升并逐渐接近栅藻LX1,最终栅藻LX1与椭圆小球藻藻细胞。这表明,椭圆小球藻 YJ1适应生长环境能力较差,但能逐渐恢复并且恢复后的生长能力与栅藻 LX1无明显区别。
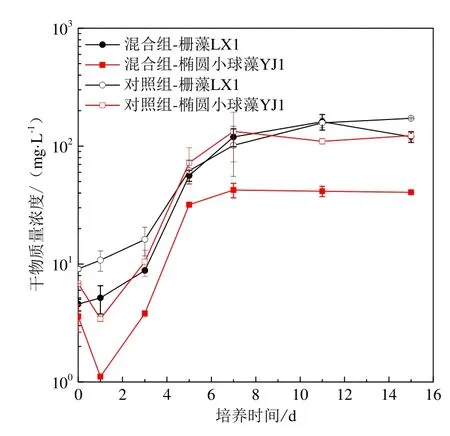
图1 栅藻LX1与椭圆小球藻YJ1混合藻种与单一藻种培养生长曲线Fig. 1 Growth curves of Scenedesmus sp. LX1 and Chlorella ellipsoidea YJ1 under mono-culture and mixed culture conditions
混合藻种培养条件下,2种微藻进入对数生长期的时间与对照组相同,栅藻LX1仍在第8天进入稳定期,椭圆小球藻YJ1比对照组提前1 d进入稳定期。椭圆小球藻YJ1的藻细胞干物质量浓度质量浓度经历初期的急速降低后开始增长,但一直低于栅藻LX1;同时栅藻LX1生长曲线尾部表现出更高的增长趋势,表明在混合培养条件下栅藻LX1生长能力强于椭圆小球藻YJ1。显微镜下观察结果表明,混合藻种培养中栅藻LX1与椭圆小球藻YJ1藻细胞的大小形态与对照组相比无明显区别。
2.2 椭圆小球藻 YJ1和雨生红球藻混合培养的生长特性
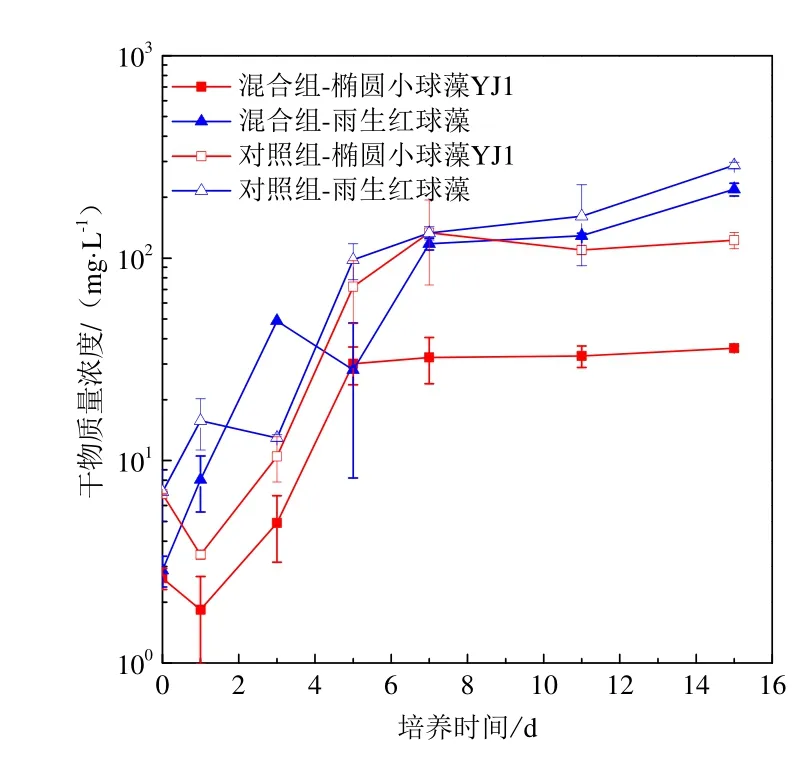
图2 椭圆小球藻YJ1与雨生红球藻混合藻种与单一藻种培养生长曲线Fig. 2 Growth curves of Chlorella ellipsoidea YJ1 and Haematococcus pluvialis under mono-culture and mixed culture conditions
椭圆小球藻YJ1和雨生红球藻在灭菌污水条件下混合藻种及单一藻种(对照组)培养的生长曲线见图2。单一藻种培养条件下的生长曲线均符合“S”型曲线,椭圆小球藻YJ1接种后前2 d为迟滞期,从第2天开始进入生长较快的对数生长期;雨生红球藻无明显迟滞期、直接进入对数生长期,两者均在第8天左右进入稳定期。对照组椭圆小球藻YJ1生长初期藻细胞干物质量浓度下降,且自第1天起藻细胞干物质量浓度一直低于雨生红球藻,表明单一藻种培养条件下雨生红球藻生长能力强于椭圆小球藻YJ1。
混合藻种培养条件下,2种微藻进入对数生长期的时间与对照组相同,雨生红球藻仍第8天进入稳定器,椭圆小球藻YJ1比对照组提前3天进入稳定期。雨生红球藻自第1天起藻细胞干物质量浓度一直高于椭圆小球藻YJ1,表明混合培养条件下雨生红球藻生长能力强于椭圆小球藻YJ1。显微镜下观察结果表明,混合藻种培养中椭圆小球藻YJ1与雨生红球藻藻细胞的大小形态与对照组相比无明显区别。
2.3 栅藻LX1和雨生红球藻混合培养的生长特性
栅藻 LX1和雨生红球藻在灭菌污水条件下混合藻种及单一藻种(对照组)培养的生长曲线见图3。栅藻LX1和雨生红球藻单一藻种培养条件下的生长曲线均符合“S”型曲线,栅藻LX1前2 d天均为迟滞期,从第2天开始进入生长较快的对数生长期,雨生红球藻无明显迟滞期、直接进入对数生长期,两者均在第8天左右进入稳定期。对照组雨生红球藻自第 1天起藻细胞干物质量浓度高于栅藻LX1,表明单一藻种培养条件下雨生红球藻生长能力强于栅藻LX1。
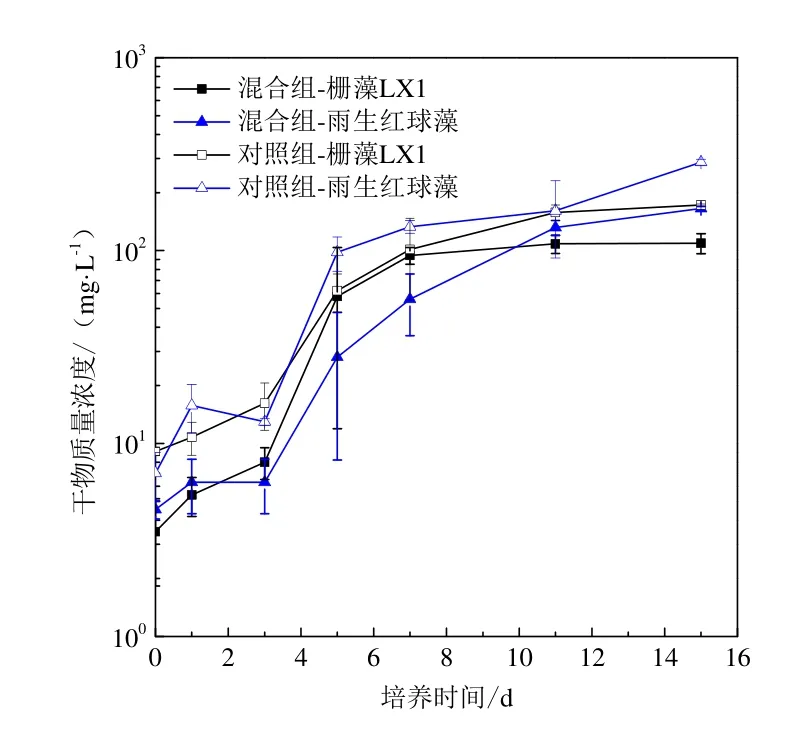
图3 栅藻LX1与雨生红球藻混合藻种与单一藻种培养生长曲线Fig. 3 Growth curves of Scenedesmus sp. LX1 and Haematococcus pluvialis under mono-culture and mixed culture conditions
混合藻种培养条件下,栅藻LX1与雨生红球藻从第3天进入对数生长期,栅藻LX1第8天左右进入稳定期,雨生红球藻第12天才进入稳定期,混合藻种培养条件下雨生红球藻的生长受到促进。栅藻LX1与雨生红球藻的藻细胞干物质量浓度随时间变化,第2~10天栅藻LX1高于雨生红球藻,第10天之后雨生红球藻高于栅藻 LX1。雨生红球藻生长曲线尾部增长趋势高于栅藻 LX1,表明混合培养条件下雨生红球藻生长能力强于栅藻 LX1。显微镜下观察结果表明,混合藻种培养中栅藻LX1与雨生红球藻藻细胞的大小形态与对照组相比无明显区别。
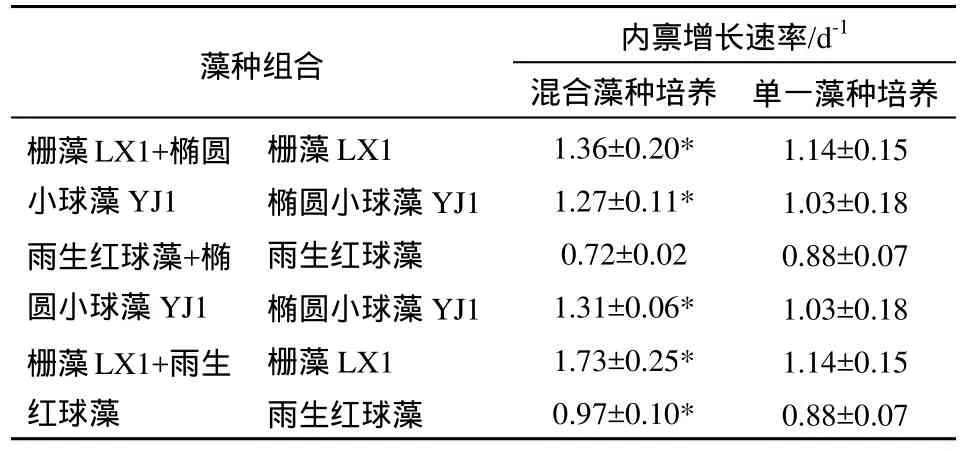
表3 混合藻种培养与单一藻种培养微藻内禀增长速率比较1Table 3 The comparison between the intrinsic growth rate of microalgae under mixed cultures and mono-cultures
2.4 混合藻种培养与单一藻种培养生长特性参数比较
利用Logistic模型得出的3株藻在不同藻种组合条件下的生长特征参数见表 3,可以看出:栅藻LX1与椭圆小球藻YJ1混合培养的内禀增长速率分别高于其单一藻种培养。栅藻LX1与雨生红球藻混合培养的内禀增长速率也分别高于其单一藻种培养。雨生红球藻与椭圆小球藻YJ1混合培养时,雨生红球藻的内禀增长速率低于其单一藻种培养,椭圆小球藻YJ1的内禀增长速率高于其单一藻种培养。栅藻LX1、椭圆小球藻YJ1和雨生红球藻的最高内禀增长速率分别为1.73、1.31、0.97 d-1,分别在栅藻LX1+雨生红球藻、雨生红球藻+椭圆小球藻YJ1、栅藻LX1+雨生红球藻混合培养组合中达到。
3株微藻在不同的藻种组合(单一培养及混合培养)条件下的比生长速率见图4。栅藻LX1与椭圆小球藻YJ1混合培养时,栅藻LX1和椭圆小球藻YJ1的比生长速率分别为0.60、0.84 d-1,分别比栅藻LX1和椭圆小球藻YJ1的单一藻种培养提高了38%和11%。椭圆小球藻YJ1与雨生红球藻混合培养时,椭圆小球藻YJ1的比生长速率(0.71 d-1)低于其单一藻种培养,而雨生红球藻的比生长速率(0.45 d-1)比其单一藻种培养增加了16%。栅藻LX1与雨生红球藻混合培养时,栅藻LX1和雨生红球藻的比生长速率分别为0.59、0.42 d-1,分别比栅藻LX1和雨生红球藻的单一藻种培养提高了36%和9.0%。
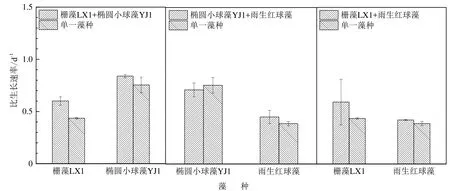
图4 3种微藻在不同藻种组合中的比生长速率Fig. 4 The specific growth rate of three microalgae under mono-culture and mixed culture conditions
藻细胞的内禀增长速率是指种群在不受环境条件限制下的最大增长率。不受环境条件限制指排除一切不利因素,提供理想的食物条件,给予最大的空间,排除捕食者和疾病的威胁等。因此内禀增长速率也叫生物潜能,表示种群的理想增殖潜力(李博, 2000)。范婧等(2012)的研究结果表明小球 藻Chlorella vulgaris-FACHB-31、斜生 栅 藻Scenedesmus obliquus-FACHB-416、鱼腥藻Anabaena flos-aquae-FACHB-245、针杆藻Synefra acus-FACHB-1131混合培养中,4种藻的内禀增长速率均低于单一藻种培养,与本研究结果并不相同。顾启华等(2007)等研究发现鱼腥藻能够分泌有毒物质抑制其他藻类的生长,这与范婧等的研究结果相吻合。Uchida等(1999)发现米氏裸甲藻Gymnodinium mikimotoi在与环状异甲藻Heterocapsa circularisquama混合培养时生长会逐渐被抑制直至死亡,作用机制可能为细胞直接接触。张东鹏等(2000)发现混合培养中亚历山大藻Alexandrium catenella和锥状施克里普藻Scrippsiella trochoidea能够促进拟菱形藻Pseudonitzschiasp.的生长。由此表明,混合培养对微藻生长的影响随藻种不同具有明显的藻种特异性。栅藻LX1、椭圆小球藻YJ1和雨生红球藻在二级出水条件下能够通过混合培养获得更高生产潜力。栅藻LX1与雨生红球藻均在栅藻LX1+雨生红球藻的混合培养组合中获得最高的生长潜力,椭圆小球藻YJ1与雨生红球藻混合培养时生长潜力最高。
藻细胞的比生长速率是表征微藻的实际生长速率,由藻细胞实际的生理活动决定。本研究条件下,栅藻LX1、椭圆小球藻YJ1和雨生红球藻在两两混合培养中获得高于单一藻种培养的比生长速率。Qian等(2008)研究报道,蛋白核小球藻Chlorella pyrenoidosa在与铜绿微囊藻Microcystis aeruginosa混合培养条件下,能够更多地摄取营养物质磷以获取竞争优势。栅藻 LX1、椭圆小球藻YJ1和雨生红球藻可能为获得两两种间竞争优势,过量摄取营养盐能够有效促进藻细胞生长速率。混合培养组合中3种微藻的比生长速率分别低于对应的内禀生长速率,可能原因是生长环境如温度、营养盐质量浓度等并未达到微藻发挥最大生殖潜力的适宜条件。陈家长等(2010)的研究结果表明温度是影响铜绿微囊藻和巨颤藻(Oscillatoria princeps)混合培养条件下生长的关键因素。陈德辉等(2000)报道营养盐磷和光照是影响铜绿微囊藻与斜生栅藻Scenedesmus obliquus混合培养过程中生长的重要因子。除了环境条件,微藻初始接种密度也会影响混合培养中微藻的竞争与生长(陈洁等, 2003)。通过调整光照、营养盐质量浓度和温度等环境条件及初始接种密度,可以更充分地发挥栅藻LX1、椭圆小球藻YJ1和雨生红球藻两两混合培养的生长潜力。
2.5 混合藻种培养与单一藻种培养生物质产量比较

图5 不同藻种组合(单一藻种及混合藻种)的生物质产量Fig. 5 The biomass productivity of the mono-culture and mixed culture of three microalgae
3种微藻在两两混合培养及单一藻种培养条件下的最大生物质产量见图5。栅藻LX1与椭圆小球藻YJ1混合培养的生物质产量为183 mg·L-1,分别比栅藻LX1和椭圆小球藻单一藻种培养提高了8%、48%。雨生红球藻与椭圆小球藻YJ1混合培养的生物质产量为204 mg·L-1,分别比雨生红球藻、椭圆小球藻YJ1单一藻种培养提高了65%、4%。栅藻LX1与雨生红球藻混合培养的生物质产量为 277 mg·L-1,分别比栅藻LX1、雨生红球藻单一藻种培养提高了64%、42%。灭菌二级出水培养条件下,与栅藻LX1、椭圆小球藻YJ1和雨生红球藻的单一藻种相比,两两藻种混合的混合培养能够促进生物质生产。栅藻LX1与雨生红球藻的混合藻种,在二级出水培养条件下的生物质生产潜力最高。
Cardinale(2011)等报道,天然水体中多种微藻混合培养能够充分利用环境中的生长资源,从而获得更高的生物质产量。罗飞(2009)研究发现,雨生血球藻CG-16株和CG-11株的株间混合培养生物质产量显著高于各自的单一藻种培养。蔡卓平等(2008)的研究结果表明,与单一藻种培养相比,混合培养可以促进杜氏盐藻和亚心形扁藻的生物质产量。二级出水培养条件下栅藻LX1、椭圆小球藻YJ1和雨生红球藻两两混合培养对生物质积累的促进作用与以上研究结果一致。但是,在Phatarpekar(2000)等的研究中发现,等鞭金藻Chaetoceros calcitran和角毛藻Isochrysis galbana混合培养的生物质产量,低于 2种微藻的单一藻种培养。因此,混合培养对微藻生物质产量的促进作用同对生长参数的促进作用一样具有藻种特异性。混合培养能够促进微藻群体生物质产量的原因可能有3个:一是单一藻种培养中单一藻种的高度一致性可能导致激烈的种内竞争,从而影响群体生物质的积累;二是混合培养中的微藻释放出能够促进另一种微藻生物质积累的化感物质,改变其生长液的环境,进而影响群体的生物质积累;三是不同微藻对营养盐的需求形成互补关系,混合藻种能够提高微藻对环境中营养盐资源的利用程度。
3 结论
(1)栅藻LX1、椭圆小球藻YJ1和雨生红球藻3种能源微藻的两两藻种混合培养均能在二级出水条件下正常生长,混合培养条件下雨生红球藻的生长竞争性强于栅藻LX1和椭圆小球藻YJ1。
(2)两两藻种混合培养能够提高栅藻LX1、椭圆小球藻YJ1和雨生红球藻的理想增殖潜力(内禀增长速率)与实际生长速率(比生长速率)。
(3)栅藻LX1、椭圆小球藻YJ1和雨生红球藻3种能源微藻的两两藻种混合培养促进了生物质生产。
(4)栅藻 LX1+雨生红球藻混合藻种的生物质产量(277 mg·L-1)最高,分别比栅藻LX1、雨生红球藻单一藻种培养提高了64%和42%。
CARDINALE B J. 2011.Biodiversity improves water quality through niche partitioning [J]. Nature, 472(7341): 86-113.
CHENG S H, AOKI S, MAEDA M, et al.2004. Competition between the rotiferBrachionus rotundiformisand the ciliateEuplotes vannusfed on two different algae[J]. Aquaculture, 241(1-4): 331-343.
FERRELL J, VALERIE S R. 2008.National algal biofuels technology roadmap[R].Maryland: The National Algal Biofuels Workshop:8-22.
FLOERDER S, COMBUECHEN A, PASTERNAK A, et al.2006.Competition between pelagic and benthic microalgae for phosphorus and light[J]. Aquatic Sciences, 68(4): 425-433.
GONZALEZ L E, CANIZARES R O, BAENA S.1997. Efficiency of ammonia and phosphorus removal from a colombian agroindustrial wastewater by the microalgae chlorella vulgaris and scenedesmus dimorphus[J]. Bioresource Technology, 60(3): 259-262.
HOFFMAN Y, AFLALO C, ZARKA A, et al. 2008.Isolation and characterization of a novel chytrid species (phylum Blastocladiomycota), parasitic on the green algaHaermatococcus[J].Mycological Research, 112: 70-81.
HU H Y, LI Xin, YU Yin, et al. 2010.Demonstrating a novel process of algae-based wastewater reclamation coupled with biofuels production[C]// The 4th Algal Biomass Summit, USA:9.
HU H Y, LI Xin, YU Yin, et al. 2011.Domestic wastewater reclamation coupled with biofuel/biomass production based on microalgae: a novel wastewater treatment process in the future[J].Journal of Water and Environment Technology, 9(2): 199-207.
JOHNSON K R, ADMASSU W. 2013. Mixed algae cultures for low cost environmental compensation in cultures grown for lipid production and wastewater remediation. Journal of Chemical Technology and Biotechnology, 88(6): 992-998.
KUWATA A, MIYAZAKI T. 2000.Effects of ammonium supply rates on competition betweenMicrocystis novacekii(Cyanobacteria) andScenadesmus quadricauda(Chlorophyta): simulation study[J].Ecological Modelling, 135(1): 81-87.
LI Xin, HU H Y, GAN Ke, et al. 2010b.Effects of different nitrogen and phosphorus concentrations on the growth, nutrient uptake, and lipid accumulation of a freshwater microalgaScenedesmussp[J].Bioresource Technology, 101 (14): 5494-5500.
LI Xin, HU H Y, YANG Jia, et al. 2010a.Enhancement effect of ethyl-2-methyl acetoacetate on triacylglycerols production by a freshwater microalga,Scenedesmussp. LX1[J]. Bioresource Technology, 101 (24): 9819-9821.
MALLICK N. 2002.Biotechnological potential of immobilized algae for wastewater N, P and metal removal: a review[J]. Biometals, 15(4):377-390.
OSWALD W J, GOTAAS H B, GOLUEKE C G, et al.1957. Algae in waste treatment[J]. Sewage and Industrial Wastes, 29(4): 437-455.
PHATARPEKAR P V, SREEPADA R A. 2000.A comparative study on growth performance and biochemical composition of mixed culture of Isochrysis galbana and Chaetoceros calcitrans with monocultures [J].Aquaculture, 181 (1-2): 141-155.
QIAN S Q, KONG F X, SHI X L, et al. 2008.Interspecific interaction betweenMicrocystis aeruginosaandChlorella pyrenoidosain different phosphate media[J]. Journal of Freshwater Ecology, 23 (4):635-642.
TWIRLER M, DIXON S I, TRICK C G. 2001.Toxic effects of Heterosigma akashiwo do not appear to be mediated by hydrogen peroxide[J].Limnol Oceanogr, 46: 1400-1405.
UCHIDA T, TODA S, MATSUYAMA Y, et al.1999. Interactions between the red tide dinoflagellatesHeterocapsacircularisquamaandGymnodinium mikimotoiin laboratory culture[J]. Journal of Experimental Marine Biology and Ecology, 241(2): 285-299.
VASUDEVAN P T, BRIGGS M.2008. Biodiesel production-current state of the art and challenges[J]. Journal of Industrial Microbiology and Biotechnology, 35(5): 421-430.
YANG Jia, LI Xin, HU H Y, et al. 2011.Growth and lipid accumulation properties of a freshwater microalga,Chlorella ellipsoideaYJ1, in domestic secondary effluents[J]. Applied Energy, 88 (10): 3295-3299.
蔡卓平, 段舜山. 2008.杜氏盐藻和亚心形扁藻混合培养生长的初步研究[J]. 水产科学, 27 (7): 330-333.
陈德辉, 章宗涉, 刘永定, 等. 2000.微囊藻栅藻资源竞争的动力学[J].环境科学学报, 20 (3): 349-352.
陈家长, 孟顺龙, 胡庚东, 等.2010. 温度对两种蓝藻种间竞争[J]. 生态学杂志, 29 (3):454-459.
陈洁, 段舜山, 李爱芬. 2003.眼点拟微绿球藻与扁藻在不同接种比例下的竞争[J]. 海洋科学, 27 (5):73-76.
范婧, 周北海, 张鸿涛, 等. 2012.再生水补充经管水体中藻类的生长比较[J]. 环境科学研究, 25 (5): 573-577.
顾启华, 赵林, 谭欣. 2007.铜绿微囊藻、螺旋鱼腥藻和水华束丝藻竞争优势的研究[J]. 安徽农业科学, 35 (7):1990-1991.
国家环境保护总局. 2002.水和废水监测分析方法[M].4版. 北京:中国环境科学出版社.
胡洪营, 李鑫, 杨佳. 2009.基于微藻细胞培养的水质深度净化与高价值生物质生产耦合技术[J]. 生态环境学报, 18 (3): 1122-1127.
黄伟伟.2009. 海洋经济微藻种间混合培养的生长效应[D]. 广州: 暨南大学:17-50.
李博. 2000. 生态学[M]. 北京:高等教育出版社: 53-54.
罗飞. 2009. N、P营养水平和株间接种比例对雨生血球藻生长的影响[D].广州: 暨南大学.
张冬鹏, 武宝玕. 2000.几种赤潮藻对温度、氮、磷的响应及藻间相互作用的研究[J]. 暨南大学学报, 21 (5): 82-87.
种云霄. 2005.浮萍氮磷转化能力的研究[D]. 北京:清华大学:51-52.
周成旭, 马斌, 汪飞雄, 等. 2006.海洋原甲藻与三角褐指藻混合培养条件下的种群生长与氮磷营养盐变化[J]. 海洋科学, 30(12):58-61.

