等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗生长和生理特性的影响
周 珩,郭世荣,邵慧娟,陈新斌,魏 斌,胡 荣,姜冬晨,郑智航,孙 锦
(南京农业大学园艺学院,农业部南方蔬菜遗传改良重点开放实验室, 南京 210095)
等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗生长和生理特性的影响
周 珩,郭世荣,邵慧娟,陈新斌,魏 斌,胡 荣,姜冬晨,郑智航,孙 锦*
(南京农业大学园艺学院,农业部南方蔬菜遗传改良重点开放实验室, 南京 210095)

黄瓜;Ca(NO3)2;NaCl;生长;生理特性

鉴于Ca(NO3)2对植物生长发育的特殊作用,植物对其胁迫的应答机制与NaCl胁迫必然有所不同,而国内外关于植物盐胁迫生理的研究大多都集中于NaCl胁迫,不能准确反映设施土壤次生盐渍化对作物的伤害机理。因此,开展作物对不同盐类胁迫响应差异的研究,对阐明设施土壤盐渍化对作物的伤害机理及寻求有效的克服途径和方法具有重要意义。前人也开展了等渗NaCl和Ca(NO3)2胁迫对黄瓜[8]、南瓜[9]、番茄[10]等作物生长和生理特性的影响,认为等渗的NaCl胁迫对作物的伤害大于等渗Ca(NO3)2胁迫,然而这些研究均未能解释造成这种差异的生理机制。
黄瓜(CucumissativusL.)是一种世界性的重要蔬菜作物,也是我国设施栽培中面积较大、种植范围较广的主要蔬菜作物之一,但其根系具有脆弱、好气、分布较浅的特点,对盐渍环境适应性较差,设施土壤盐分积累容易引发黄瓜植株的生理性病害,严重影响产量和品质。为此,本试验以盐敏感型的黄瓜品种‘津春2号’为材料,从生长、光合特性、活性氧代谢、阳离子吸收等方面,研究等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗生长和生理特性的影响,探讨黄瓜幼苗对不同盐类胁迫的生理响应差异,为寻求有效克服设施土壤盐渍化的途径和方法提供理论依据。
1 材料与方法
1.1 试验材料
试验选用盐敏感型的黄瓜品种‘津春2号’[8]为试材,种子由天津黄瓜研究所提供;选用的营养液配方为日本山崎黄瓜专用配方(表1)。
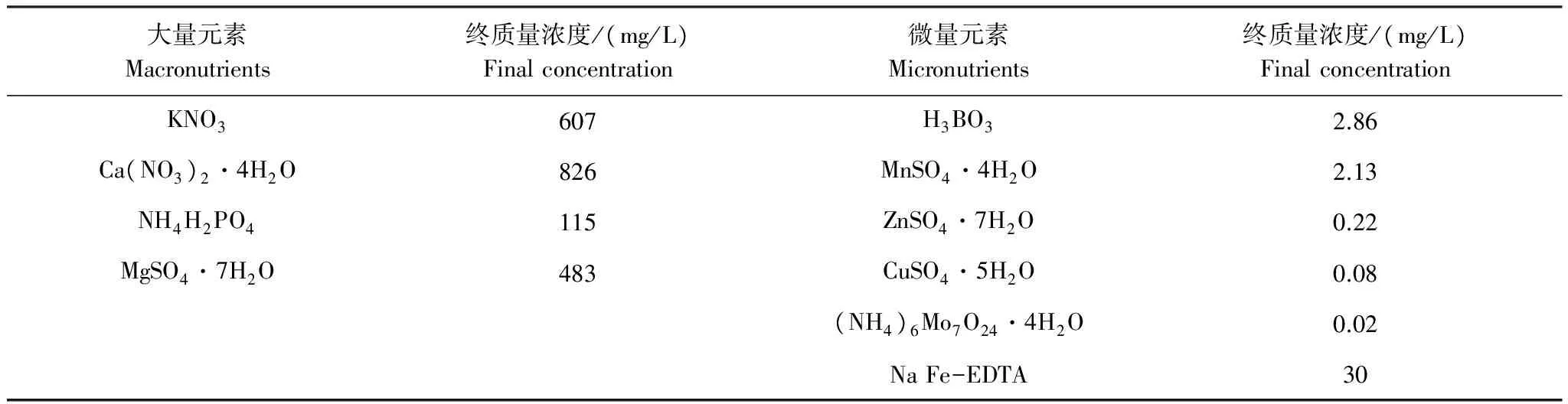
表1 日本山崎黄瓜专用配方
1.2 材料培养与处理
试验于2011年9月—2012年12月在南京农业大学牌楼试验基地的现代化玻璃温室中进行。黄瓜种子经浸种催芽后,播种于石英砂中育苗。待幼苗2叶1心时定植于盛有1个剂量日本山崎黄瓜专用配方的营养液栽培箱(18 cm× 48 cm× 24 cm;20 L)内,幼苗预培养3 d后一次性加盐处理,使营养液中NaCl和Ca(NO3)2的终浓度分别达到75 mmol/L和50 mmol/L(根据预备试验,该浓度下两种盐处理的黄瓜幼苗生物量差异最大,数据略),用FM- 8P全自动冰点渗透压计测得加盐后营养液的初始渗透势均为-46.3 MPa。试验设3个处理,分别为:对照(CK,正常营养液栽培),75 mmol/L NaCl处理(NaCl),50 mmol/L Ca(NO3)2处理(Ca(NO3)2),每处理重复3次,随机区组排列,每个区组内各处理均3箱,每箱定植黄瓜幼苗12株。试验期间,温室内温度保持在13—28 ℃,相对湿度(RH)60%—75%,光合有效辐射(PAR)为400—800 μmol·m-2·s-1。盐胁迫处理5 d后,每重复取样9株幼苗(每箱取样3株)进行生长指标和生理指标测定;光合气体交换参数和叶绿素荧光参数测定时,每重复取样3株(每箱取样1株)进行测定,取其平均值。叶片生理指标和光合、荧光参数测定时的取样部位为幼苗生长点之下第2和(或)第3片真叶。
1.3 测定方法
1.3.1 生长指标
用去离子水将黄瓜幼苗冲洗干净并吸干水分,从根茎结合处剪断,分为地上部和地下部,称得鲜重(g/株);在烘箱中105 ℃下杀青15 min后,然后在75 ℃的恒温下烘干至恒重,称得干重(g/株)。
1.3.2 叶绿素(Chl)含量
按沈伟其[11]的方法分别测定A645、A663处的吸光值,并计算叶绿素a(Chl a)、叶绿素b(Chl b)和总叶绿素(Chl(a+b))含量。
1.3.3 活性氧(ROS)和丙二醛(MDA)含量测定
1.3.4 抗氧化酶活性
超氧化物歧化酶(SOD)活性测定参照氮蓝四唑(NBT)光还原法[15],过氧化物酶(POD)活性测定参照 Kochba等[16]的方法,过氧化氢酶(CAT)活性测定参照 Dhindsa 等[15]的方法。
1.3.5 阳离子含量
将新鲜样品洗净后用吸水纸吸干水分,分别剪取根系、茎和不带叶柄的叶片,在105 ℃下杀青15 min后在70—80 ℃下烘干至恒重,磨碎后过30目筛,取50 mg样加20 mL蒸馏水摇匀,在100 ℃沸水浴中煮1.5—3 h,冷却后定容至100 mL。黄瓜幼苗各器官中K+、Na+、Mg2+和Ca2+的含量分别在OD 766.49、589.59、285.21、317.93 nm下利用原子吸收分光光度计(日立Z- 2000)测定。
1.3.6 光合气体交换参数
采用便携式光合测定系统(Li- 6400,美国LI-COR公司)于晴天9:00—11:00 进行光合参数测定。测定时叶室温度控制在(25 ± 1) ℃,光强控制在800 μmol · m-2· s-1,参比室CO2浓度为(380 ± 10) μmol/L,相对湿度(RH)为60%—70%。选取叶位一致、完全展开的功能叶测量其净光合速率(Pn,μmol CO2· m-2· s-1)、气孔导度(Gs,mol · m-2· s-1)、胞间CO2浓度(Ci,μmol CO2/mol),并计算气孔限制值[17](Ls,%):Ls=1-Ci/Ca,式中Ca为空气中CO2浓度(μmol/mol)。
1.3.7 叶绿素荧光参数

1.4 数据处理
数据分析采用MS Excel 2003软件制作图表,SAS9.0软件进行数据单因素方差分析,数据显著性差异运用Duncan′ s新复极差法进行多重比较(P﹤0.05)。
2 结果与分析
2.1 等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗生长的影响
如表2所示,NaCl和Ca(NO3)2处理显著抑制了黄瓜幼苗生长,总鲜重和总干重均显著低于对照,其中NaCl处理对黄瓜幼苗生长的抑制作用大于Ca(NO3)2处理。NaCl胁迫下,黄瓜幼苗根系和地上部的鲜重、干重均显著低于对照;Ca(NO3)2胁迫下,黄瓜幼苗地上部生长显著受到抑制,而对根系生长的影响不明显。可见,Ca(NO3)2胁迫主要抑制黄瓜幼苗地上部生长,而NaCl胁迫可使黄瓜幼苗根系和地上部的生长均受到抑制。

表2 等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗生长的影响
CK表示正常营养液栽培;NaCl表示NaCl胁迫处理;Ca(NO3)2表示Ca(NO3)2胁迫处理;同列中不同字母表示差异达5%水平(P<0.05)
2.2 等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗叶片叶绿素含量的影响
如表3所示,等渗NaCl和Ca(NO3)2胁迫下,黄瓜幼苗叶片Chl a、Chl b、Chl(a+b)含量和Chl a/ Chl b均显著下降,但Ca(NO3)2胁迫下黄瓜幼苗叶片Chl a/ Chl b显著高于NaCl胁迫。

表3 等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗叶片叶绿素含量的影响
Chl a:Chlorophyll a;Chl b:Chlorophyll b;Chl (a+b):Total chlorophyll;Chl a/Chl b:Ratio of chlorophyll a and chlorophyll b
2.3 等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗光合气体交换参数的影响
如图1所示,等渗NaCl和Ca(NO3)2胁迫下,黄瓜幼苗叶片Pn、Gs、Ci均显著低于对照,而Ls显著高于对照,但NaCl胁迫引起的升高或降低幅度均大于Ca(NO3)2胁迫。按照Farquhar等[19]的判断标准,NaCl与Ca(NO3)2胁迫引起黄瓜幼苗叶片光合速率降低主要是由气孔因素引起。

图1 等渗Ca(NO3)2和NaCl胁迫对黄瓜幼苗叶片光合气体交换参数的影响Fig.1 Effects of iso-osmotic Ca(NO3)2 and NaCl on photosynthetic gas exchange parameters of cucumber seedling leavesCK:正常营养液栽培Control;NaCl:NaCl胁迫处理NaCl stress;Ca(NO3)2:Ca(NO3)2胁迫处理Ca(NO3)2 stress;不同小写字母表示差异显著(P﹤0.05)
2.4 等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗叶片叶绿素荧光参数的影响

图2 等渗Ca(NO3)2和NaCl胁迫对黄瓜幼苗叶片叶绿素荧光参数的影响Fig.2 Effects of iso-osmotic Ca(NO3)2 and NaCl on fluorescence parameters of cucumber seedling leaves
2.5 等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗叶片吸收光能分配的影响
利用叶绿素荧光参数将植物叶片吸收的光能分为3部分,D、Ex和P。通过测算植物叶片的P、D、Ex的份额,可以了解植物的光能分配情况[18]。图3表明,NaCl胁迫下,黄瓜幼苗叶片的P显著降低,而Ex显著升高16.89%,对D无明显影响;Ca(NO3)2胁迫对P和D无明显影响,但使Ex显著升高6.95%。


图3 等渗Ca(NO3)2和NaCl胁迫对黄瓜幼苗叶片PSⅡ光化学反应能量部分(P)、天线耗散能量部分(D)和PSⅡ反应中心过剩光能(Ex)分配的影响Fig.3 Effects of iso-osmotic Ca(NO3)2 and NaCl on allocation of photochemistry energy (P)、dissipation energy (D) by antenna and excessive energy in PSⅡ (Ex) of cucumber seedling leaves
2.7 等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗叶片SOD、POD、CAT活性的影响
图5所示,NaCl胁迫下,黄瓜幼苗叶片SOD 活性显著低于对照,而POD 和CAT 活性则高于对照;Ca(NO3)2胁迫下,黄瓜幼苗叶片SOD、POD 和CAT 活性均显著高于对照和NaCl胁迫处理。

图5 等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗叶片SOD、POD、CAT活性的影响Fig.5 Effects of iso-osmotic Ca(NO3)2 and NaCl stress on SOD, POD and CAT activities in leaves of cucumber seedlings
2.8 等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗体内阳离子含量和离子吸收比率的影响
由表4可以看出,NaCl胁迫下,黄瓜幼苗各器官中的Na+含量显著升高,K+含量显著下降,而Ca2+和Mg2+含量在各器官中的变化不一致;Ca(NO3)2胁迫下,黄瓜幼苗各器官中的Na+含量变化不明显,而使Ca2+含量均显著升高,K+和Mg2+含量均有所降低。为了更准确反应胁迫条件下离子吸收状况,分析了胁迫条件对离子吸收比率的影响,结果表明,NaCl胁迫下,黄瓜幼苗根、茎、叶的K/Na、Mg/Na、Ca/Na比值均显著降低;Ca(NO3)2胁迫下,黄瓜幼苗根、茎、叶的Ca/Na比值显著升高(表5),而根、茎、叶的K/Ca、Mg/Ca均显著降低(表6)。
3 讨论
3.1 等渗NaCl 和Ca(NO3)2胁迫对黄瓜幼苗生长的影响存在差异
盐胁迫下,由于植株碳同化量减少、渗透调节能耗和维持生长能耗增加等原因,一般会使植株生长量和积累量减少[20]。本试验结果表明,75 mmol/LNaCl 和50 mmol/L Ca(NO3)2处理均显著抑制了黄瓜幼苗生长(表2),这与童辉等[8]的研究结果一致。本实验中,Ca(NO3)2胁迫抑制黄瓜幼苗生长主要是抑制其地上部分的生长,而对根系生物量积累的影响不大(表2)。之前的研究发现,Ca(NO3)2胁迫显著影响了黄瓜幼苗根系的形态,使其根系伸长受到抑制,但侧根急剧缩短,分枝增多,导致侧根密度显著增大,根尖数增多,且根系平均直径变大[21],这可能是Ca(NO3)2胁迫对黄瓜幼苗根系生物量积累无显著影响的主要原因。


表6 Ca(NO3)2胁迫对黄瓜幼苗不同器官K/Ca、Mg/Ca比值的影响
3.2 黄瓜幼苗对等渗NaCl 和Ca(NO3)2胁迫响应的光合特性差异

3.3 黄瓜幼苗对等渗NaCl 和Ca(NO3)2胁迫响应的活性氧代谢差异

正常情况下,植物体内存在ROS清除系统,使植物在生命活动中产生的ROS处于产生和消除的动态平衡,从而使植物免受ROS伤害。其中,SOD与CAT、POD以及B2胡萝卜素等抗氧化剂协同作用,可防御ROS等自由基对细胞膜系统的伤害。当植物处于盐胁迫等逆境时,ROS动态平衡被打破,产生大量ROS,造成植物体产生严重的膜质过氧化伤害,并导致光合色素含量降低,影响植株的光合性能[31]。本实验结果表明,Ca(NO3)2胁迫下,黄瓜幼苗叶片SOD、POD和CAT活性均显著升高(图5),ROS清除能力增强,并未对黄瓜幼苗植株造成严重的膜质过氧化伤害;而NaCl胁迫下,尽管POD和CAT活性显著升高,但升高幅度不大,再加上SOD活性显著降低(图5),对ROS清除能力有限,导致ROS积累(图4),引起了膜质过氧化产物MDA积累(图4)和Chl含量降低(表3)。
3.4 黄瓜幼苗对等渗NaCl 和Ca(NO3)2胁迫响应的离子吸收特性差异
盐胁迫对作物造成的危害主要有离子毒害、渗透胁迫和营养失衡[32],这些危害均与作物对盐分离子的吸收累积有着直接和间接的关系[33],而维持细胞内离子动态平衡是植物在盐胁迫下生存的基础[34]。本实验结果表明,NaCl胁迫下,黄瓜幼苗各器官中的Na+含量显著升高(表4),根、茎、叶中的K/Na、Mg/Na、Ca/Na比值均显著降低(表5),离子平衡被打破,Na+与K+、Ca2+等各种营养元素相互竞争而造成植株矿质营养胁迫,严重影响黄瓜幼苗植物正常生长。Ca(NO3)2胁迫下,黄瓜幼苗各器官中的Ca2+含量显著升高,而K+和Mg2+含量均有所降低(表4),致使K/Ca、Mg/Ca比值显著降低(表5),离子平衡同样被打破。尽管Ca2+在植物生长发育中起着重要的作用,作为第二信使参与植物体内的许多生理过程[35],如激活NAD激酶、膜结合蛋白激酶及Ca2+-ATP酶(Ca2+-ATPase)等许多酶的活性,还可通过调节保卫细胞内膨压的变化影响气孔的开放[36],但是,高钙胁迫则会造成细胞骨架和生物膜结构的破坏,并最终导致细胞内物质代谢的紊乱等[37]。尽管如此,植物细胞积累过多的Na+要比积累过多的Ca2+对植物体的伤害作用要大,这是因为Na+在细胞中大量积累,不仅会改变细胞膜系统的结构和功能,而且会导致光合作用中具有重要作用的酶活性降低。如在NaCl胁迫下,玉米幼苗的苹果酸脱氢酶(MDH)、磷酸烯醇式丙酮酸羧化酶(PEPC)以及RuBP羧化酶的活性都显著降低[38]。这就不难解释在本实验中,NaCl胁迫下黄瓜幼苗植株碳同化能力降低的原因,而Ca(NO3)2胁迫对碳同化的影响不大。
综上所述,黄瓜幼苗对等渗NaCl 和Ca(NO3)2胁迫的生理响应存在差异。NaCl胁迫下黄瓜幼苗体内Na+大量积累,不仅限制了环境中CO2进入叶肉细胞,而且使碳同化能力降低,加之ROS清除能力有限,不能有效清除PSⅡ反应中心过剩能量所导致的ROS,因而产生了严重的膜质过氧化,影响了植株生长和光合速率;而Ca(NO3)2胁迫下,黄瓜幼苗碳同化能力没有受到影响,ROS也能够被抗氧化系统有效清除,植株没有产生严重的膜质过氧化,因而对生长和光合速率的影响没有NaCl胁迫大。
[1] Liang Y C, Si J, Nikolic M, Peng Y, Chen W, Jiang Y. Organic manure stimulates biological activity and barley growth in soil subject to secondary salinization. Soil Biology and Biochemistry, 2005, 37(6): 1185- 1195.
[2] Yu H Y, Li T X, Zhou J M. Secondary salinization of greenhouse soil and its effects on soil properties. Soils, 2005, 37(6): 581- 586.
[3] Li D P, Wu Z J, Liang C H, Chen L J. Characteristics and regulation of greenhouse soil environment. Chinese Journal of Ecology, 2004, 23(5): 192- 197.
[4] Sun Y D, Luo W R, Li X Z, Qi A G. Effects of Ca (NO3)2stress on the growth and physiological indexes of cucumber seedlings. Environmental Science and Information Application Technology, 2009, 1: 268- 271.
[5] Jin C Y, Sun J, Guo S R. Effects of exogenous spermidine on growth and active oxygen metabolism in cucumber seedlings under Ca(NO3)2stress. Acta Botanica Boreali-Occidentalia Sinica, 2010, 30(8): 1627- 1633.
[6] Zhang G W, Liu Z L, Zhou J G, Zhu Y L. Effects of Ca(NO3)2stress on oxidative damage, antioxidant enzymes activities and polyamine contents in roots of grafted and non-grafted tomato plants. Plant Growth Regulation, 2008, 56(1): 7- 19.
[7] Tong Y W, Chen D F. Study on the cause and control of secondary saline soils in greenhouse. Acta Horticulturae Sinica, 1991, 18(2): 159- 162.
[8] Tong H, Sun J, Guo S R, Zhang Z X. Effects of iso-osmotic Ca(NO3)2and NaCl stress on the growth and osmotic substances of cucumber seedlings. Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(2): 306- 311.
[9] Wang L P, Sun J, Guo S R, Tian J, Lu X M, Yang Y J. Growth and reactive oxygen metabolism in different cucumber grafted rootstock seedlings under Ca(NO3)2or NaCl stress. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(10): 2045- 2051.
[10] Liu Z Y, Zhu Z J, Qian Y R, Yu J Q. Effect of iso-osmotic Ca(NO3)2and NaCl on growth of tomato seedlings. Acta Horticulturae Sinica, 2001, 28(1): 31- 35.
[11] Shen W Q. Extraction of mixed solution for determination of chlorophyll content in rice leaf blade. Plant Physiology Communications, 1988, 24(3): 62- 64.
[12] Wang A G, Luo G H. Quantitative relation between the reaction of hydroxylamine and superoxide anion radicals in plants. Plant Physiology Communications, 1990, 26(6): 55- 57.
[13] Uchida A, Jagendorf A T, Hibino T, Takabe T, Takabe T. Effects of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice. Plant Science, 2002, 163(3): 515- 523.
[14] Heath R L, Packer L. Photoperoxidation in isolated chloroplasts: I. Kinetics and stoichiometry of fatty acid peroxidation. Archives of Biochemistry and Biophysics, 1968, 125(1): 189- 198.
[15] Dhindsa R S, Plumb-Dhindsa P, Thorpe T A. Leaf senescence: correlated with increased levels of membrane permeability and lipid peroxidation, and decreased levels of superoxide dismutase and catalase. Journal of Experimental Botany, 1981, 32(1): 93- 101.
[16] Kochba J, Lavee S, Spiegel-Roy P. Differences in peroxidase activity and isoenzymes in embryogenic and non-embryogenic ‘Shamouti’orange ovular callus lines. Plant and Cell Physiology, 1977, 18(2): 463- 467.
[17] Berry J A, Downton W J S. Environmental regulation of photosynthesis // Govindjee N Y, ed. Photosynthesis, Development, Carbon Metabolism, and Plant Productivity, vol. 2. New York: Academic Press, 1982: 263- 343.
[18] Deming-Adams B, Adams Ⅲ W W, Barker D H, Logan B A, Bowling D R, Verhoeven A S. Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation. Physiologia Plantarum, 1996, 98(2): 253- 264.
[19] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33(1): 317- 345.
[20] Luo Q Y, Yu B J, Liu Y L. Effect of NaCl on the growth, K+, Na+and Cl-distribution in seedlings of 6 soybean cultivars (GlycinemaxL. Merrill). Soybean Science, 2001, 20(3): 177- 182.
[21] Tong H, Sun J, Guo S R, Zhang Z X. Effects of iso-osmotic Ca(NO3)2and NaCl stress on root morphology and activity of cucumber seedlings. Journal of Nanjing Agricultural University, 2012, 35(3): 37- 41.
[22] Kao W Y, Tsai T T, Shih C N. Photosynthetic gas exchange and chlorophyll a fluorescence of three wild soybean species in response to NaCl treatments. Photosynthetica, 2003, 41(3): 415- 419.
[23] Mehta P, Jajoo A, Mathur S, Bharti S. Chlorophyllafluorescence study revealing effects of high salt stress on photosystemⅡ in wheat leaves. Plant Physiology and Biochemistry, 2010, 48(1): 16- 20.
[24] Munns R, Tester M. Mechanisms of salinity tolerance. Annual Review of Plant Biology, 2008, 59(1): 651- 681.
[25] Shu S, Yuan L Y, Guo S R, Sun J, Liu C J. Effects of exogenous spermidine on photosynthesis, xanthophyll cycle and endogenous polyamines in cucumber seedlings exposed to salinity. African Journal of Biotechnology, 2012, 11(22): 6064- 6074.
[26] Shu S, Guo S R, Sun J, Yuan Y H, Yuan L Y. Research progress on photosynthesis under salt Stress. China Vegetables, 2012, (18): 53- 61.
[27] Lu C M, Zhang Q D, Kuang T Y. The effects of water stress on the chlorophyll a fluorescence induction kinetics in wheat seedlings. Acta Biophysica Sinica, 1993, 9(3): 453- 457.
[28] Genty B, Briantais J M, Baker N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence. Biochimica et Biophysica Acta, 1989, 990(1): 87- 92.
[29] Foryer C H, Noetor G. Leaves in the dark see the light. Science, 1999, 284(5414): 599- 601.
[30] Reinbothe S, Reinbothe C. The regulating of enzymes involved in chlorophyll biosynthesis. European Journal of Biochemistry, 1996, 237(2): 323- 343.
[31] Takahashi S, Murata N. How do environmental stresses accelerate photoinhibition? Trends in Plant Science, 2008, 13(4): 178- 182.
[32] Zhu H J, Wang R G, Chen S L, Zhang Y X, Li N Y, Shao J. Genotypic differences betweenPopuluseuphraticaandP.Popularisin antioxidative ability and salt tolerance under NaCl stress. Acta Ecologica Sinica, 2007, 27(10): 4113- 4121.
[33] Ma C L, Liu X H, Wang X P. Study on the growth and characteristics of mineral nutrition and ion absorption of pomelo seedlings under salt stress. Plant Nutrition and Fertilizer Science, 2004, 10(3): 319- 323.
[34] Niu X, Bressan R A, Hasegawa P M, Pardo J M. Ion homeostasis in NaCI stress environments. Plant Physiology, 1995, 109(3): 735- 742.
[35] Dieter P. Calmodulin and calmodulin-mediated progress in plants. Plant, Cell and Environment, 1986, 7: 371- 380.
[36] Willmer C M, Mansfield T A. A critical examination of the use of detached epidermis in studies of stomatal physiology. The New Phytologist, 1969, 68(2): 363- 375.
[37] Bangerth F. Calcium-related physiological disorders of plants. Annual Review of Phytopathology, 1979, 17(1): 97- 122.
[38] Guo S K, Zhao K F. The possible mechanisms of NaCl inhibit photosythesis of maize seedlings. Acta Phytophysiologica Sinica, 2001, 27(6): 461- 466.
参考文献:
[2] 余海英, 李廷轩, 周健民. 设施土壤次生盐渍化及其对土壤性质的影响. 土壤, 2005, 37(6): 581- 586.
[3] 李东坡, 武志杰, 梁成华, 陈利军. 设施土壤生态环境特点与调控. 生态学杂志, 2004, 23(5): 192- 197.
[5] 金春燕, 孙锦, 郭世荣. 外源亚精胺对Ca(NO3)2胁迫下黄瓜幼苗生长和活性氧代谢的影响. 西北植物学报, 2010, 30(8): 1627- 1633.
[7] 童有为, 陈淡飞. 温室土壤次生盐渍化的形成和治理途径研究. 园艺学报, 1991, 18(2): 159- 162.
[8] 童辉, 孙锦, 郭世荣, 张振兴. 等渗Ca(NO3)2和NaCl 胁迫对黄瓜幼苗生长及渗透调节物质含量的影响. 西北植物学报, 2012, 32(2): 306- 311.
[9] 王丽萍, 孙锦, 郭世荣, 田婧, 陆晓民, 阳燕娟. 等渗Ca(NO3)2和NaCl 胁迫对黄瓜砧用南瓜幼苗生长和活性氧代谢的影响. 西北植物学报, 2011, 31(10): 2045- 2051.
[10] 刘志媛, 朱祝军, 钱亚榕, 喻景权. 等渗Ca(NO3)2和NaCl对番茄幼苗生长的影响. 园艺学报, 2001, 28(1): 31- 35.
[11] 沈伟其. 测定水稻叶片叶绿素含量的混合液提取法. 植物生理学通讯, 1988, 24(3): 62- 64.
[12] 王爱国, 罗广华. 植物的超氧物自由基与羟胺反应的定量关系. 植物生理学通讯, 1990, 26(6): 55- 57.
[20] 罗庆云, 於丙军, 刘友良. 大豆苗期耐盐性鉴定指标的检验. 大豆科学, 2001, 20(3): 177- 182.
[21] 童辉, 孙锦, 郭世荣, 张振兴. 等渗Ca(NO3)2和NaCl 胁迫对黄瓜幼苗根系形态及活力的影响. 南京农业大学学报, 2012, 35(3): 37- 41.
[26] 束胜, 郭世荣, 孙锦, 袁颖辉, 袁凌云. 盐胁迫下植物光合作用的研究进展. 中国蔬菜, 2012, (18): 53- 61.
[27] 卢从明, 张其德, 匡廷云. 水分胁迫对小麦叶绿素a荧光诱导动力学的影响. 生物物理学报, 1993, 9(3): 453- 457.
[32] 朱会娟, 王瑞刚, 陈少良, 张云霞, 李妮亚, 邵杰. NaCl胁迫下胡杨(Populuseuphratica)和群众杨(P.Popularis)抗氧化能力及耐盐性. 生态学报, 2007, 27(10): 4113- 4121.
[33] 马翠兰, 刘星辉, 王湘平. 盐胁迫下柚实生苗生长、矿质营养及离子吸收特性研究. 植物营养与肥料学报, 2004, 10(3): 319- 323.
[38] 郭书奎, 赵可夫. NaCl胁迫抑制玉米幼苗光合作用的可能机理. 植物生理学报, 2001, 27(6): 461- 466.
Effects of iso-osmotic Ca(NO3)2and NaCl stress on growth and physiological characteristics of cucumber seedlings
ZHOU Heng, GUO Shirong, SHAO Huijuan, CHEN Xinbin, WEI Bin, HU Rong, JIANG Dongchen, ZHENG Zhihang, SUN Jin*
CollegeofHorticulture,NanjingAgriculturalUniversity/KeyLaboratoryofSouthernVegetableCropGeneticImprovement,MinistryofAgriculture,Nanjing,Jiangsu210095,China

cucumber(CucumissativusL.); salt stress; Ca(NO3)2; NaCl; growth; physiological characteristics
高等学校博士学科点专项科研基金(20100097120002);国家重点基础研究发展计划项目(2009CB119000);现代农业产业技术体系建设专项资金资助(CARS- 25-C- 03)
2013- 03- 20;
2013- 09- 18
10.5846/stxb201303200467
*通讯作者Corresponding author.E-mail: jinsun@njau.edu.cn
周珩,郭世荣,邵慧娟,陈新斌,魏斌,胡荣,姜冬晨,郑智航,孙锦.等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗生长和生理特性的影响.生态学报,2014,34(7):1880- 1890.
Zhou H, Guo S R, Shao H J, Chen X B, Wei B, Hu R, Jiang D C, Zheng Z H, Sun J.Effects of iso-osmotic Ca(NO3)2and NaCl stress on growth and physiological characteristics of cucumber seedlings.Acta Ecologica Sinica,2014,34(7):1880- 1890.

