油茶炭疽病拮抗细菌Y13主要抑菌物质分离纯化及作用方式
孟庆敏,周国英,刘君昂,左 杰,董文统,王瑞芹
(中南林业科技大学 经济林培育与保护教育部重点实验室,长沙 410004)
油茶炭疽病拮抗细菌Y13主要抑菌物质分离纯化及作用方式
孟庆敏,周国英,刘君昂*,左 杰,董文统,王瑞芹
(中南林业科技大学 经济林培育与保护教育部重点实验室,长沙 410004)
油茶内生拮抗细菌Y13是一株对油茶炭疽病菌有较强抑制作用的枯草芽胞杆菌。为了确定其抑菌物质的成分组成及其对油茶炭疽病菌的作用方式,本文通过乙醇沉淀、固相萃取、反相高效液相色谱法及LC-MS对抑菌物质进行分离鉴定。一共分离纯化出16个活性组分,保留时间在10.5~26.0min的8个组分对于油茶炭疽病菌产生明显的抑菌圈,其中保留时间为11.0min处的色谱峰抑菌效果最强,经质谱初步鉴定确定该化合物的分子量为1042.56u;保留时间在27.5~39.5 min的8个组分导致油茶炭疽病病原菌菌丝颜色加深,其中以保留时间37.5 min处的色谱峰效果最为明显,质谱鉴定该化合物的分子量为1480.85 u。显微观察发现它们通过导致菌丝断裂、畸形、原生质凝集的方式抑制菌丝生长;通过使孢子畸形、膨大、消融而抑制孢子萌发。
油茶炭疽病; 拮抗细菌; 抑菌物质; 分离纯化; 作用方式
油茶是中国特有木本油料植物,油茶茶籽及其副产品经济价值极高[1],但近几年来随着油茶产业的发展,油茶病虫害日趋严重,特别是油茶炭疽病严重影响了油茶的产量和品质。油茶炭疽病引起的油茶落果率通常在20%~40%,严重时达60%以上[2-3]。由于化学农药的大量使用,不仅严重污染了环境,同时也使油茶植株产生了抗药性,因此油茶病虫害的生物防治已成为当前亟待解决的重大问题。
本研究前期已从健康油茶叶片中筛选出对油茶炭疽病有强烈抑制作用的油茶内生细菌Y13,经生理生化分析及16S rDNA鉴定油茶内生菌Y13为枯草芽胞杆菌[4]。对于枯草芽胞杆菌所产生的抑菌物质目前已经有了大量研究。枯草芽胞杆菌可以产生多种抑菌物质,其中主要包括两大类:一类是由核糖体途径合成的肽类抗生素如枯草菌素(subtilosin)[5]、酶类[6]和少量的抗菌蛋白等[7],另一类是由非核糖体途径合成的脂肽类抗生素如表面活性素(surfactin)[8]、伊枯草菌素(iturin)[9]和丰产素(fengycin)[10]等。枯草芽胞杆菌抑菌物质主要是通过溶解病原真菌的细胞壁,从而使原生质泄露,菌丝断裂等[11]。为了明确油茶内生细菌Y13所产生的抑菌物质的成分及结构,本研究首先对油茶内生菌Y13产生的抑菌物质进行了分离纯化,为之后的质谱结构鉴定奠定良好的基础。同时本研究也对抑菌物质对病原菌菌丝和孢子的影响做了显微观察,为以后抑菌机理的深入研究提供支持。
1 材料与方法
1.1 供试菌株
1.1.1 拮抗细菌
枯草芽胞杆菌(Bacillussubtilis)Y13为中南林业科技大学经济林培育与保护教育部重点实验室森林微生物菌种保藏室分离保存。
1.1.2 指示病原菌
油茶炭疽病病原菌(Colletotrichumgloeosporioides)为中南林业科技大学经济林培育与保护教育部重点实验室森林微生物菌种保藏室分离保存。
1.1.3 Y13发酵培养基
葡萄糖1.5%,酵母膏1.0%,牛肉膏0.3%,氯化钠1.5%,蒸馏水1000mL,pH7.0。NB培养基:蛋白胨1%,牛肉膏1%,氯化钠0.5%,蒸馏水1000mL,pH7.2~7.4。
1.2 Y13发酵液抑菌物质分离
1.2.1 油茶内生菌Y13发酵液制备
从斜面培养基中挑取一环Y13菌体接入NB液体培养基中,30℃,140r/min摇床振荡培养72 h,配制成Y13发酵液。4 ℃,15 000r/min,离心30min,去掉沉淀,用0.22 μm的滤膜过滤发酵上清液,得到无菌滤液,即为抑菌物质粗提物。
1.2.2 乙醇沉淀法分离抑菌物质
向无菌滤液中加入无水乙醇至浓度依次为40%、60%、70%、80%、90%,4 ℃静置4 h,然后4 ℃,20000r/min,离心30min,保留上清液。对上清液进行旋转蒸发浓缩除去乙醇,4 ℃保存备用。
1.2.3 滤纸片法对各浓度提取物作抑菌活性检测
取油茶炭疽病病原菌饼接入PDA液体培养基中,30℃,160r/min,恒温振荡96h,制成油茶炭疽病病原菌发酵液,从中吸取300μL于PDA固体培养基中,涂布均匀。用100μL无菌水溶解提取物,吸取各个浓度的乙醇提取物20μL分别滴在滤纸片上,以无菌发酵上清液为对照,28 ℃下恒温培养48 h,测量抑菌圈直径。每个试验重复4次。
1.3 Y13抑菌物质纯化
1.3.1 固相萃取法纯化Y13抑菌物质
利用C18固相萃取柱对80%乙醇提取物进行固相萃取分离,先收集不被吸附的组分,再分别以45%甲醇、65%甲醇、95%甲醇作为萃取剂,分别收集每个浓度萃取剂所洗脱下来的组分,旋转蒸发去除组分中的甲醇,以无菌发酵上清液为对照,通过滤纸片扩散法进行抑菌活性检测,每个处理3个重复。将活性最强的组分干燥浓缩,4 ℃保存备用。
1.3.2 HPLC纯化Y13抑菌物质
将活性最强的组分先用20%甲醇溶解,再用0.45 μm的有机系滤膜过滤,通过制备型C18(4.6mm×250mm,5 μm)色谱柱进行纯化。流动相为含0.1%三氟乙酸的甲醇(A)和超纯水(B)。用43%~95%甲醇进行梯度变速洗脱,进样量为30μL,检测波长为210nm。收集每个色谱峰组分,将各收集液干燥浓缩,4 ℃备用。
1.3.3 HPLC纯化后各组分抑菌活性检测
将初步纯化后的所有活性组分所对应的色谱峰做积分处理,分别用20%甲醇溶解所有样品,最终使各组分的浓度一致。以20%甲醇为对照,每个组分吸取20μL进行抑菌活性检测并测量抑菌圈直径。每个处理重复3次。
1.3.4 HPLC参数优化
用0.45 μm的有机系滤膜过滤活性组分,改用流动相A为乙腈,流动相B为超纯水,流动相A和B中均加有0.1%的三氟乙酸,流速为0.7 mL/min,检测波长为214 nm,梯度洗脱。
1.4 Y13抑菌物质对油茶炭疽病菌的作用方式
1.4.1 抑菌物质对油茶炭疽病菌菌丝形态的影响
分别选取抑菌圈最大的一个组分和变色圈最大的一个组分,用接种环挑取它们与炭疽病菌菌块交界处的菌丝于显微镜下观察。以正常生长的菌丝作为对照。
1.4.2 抑菌物质对油茶炭疽病菌孢子萌发的影响
采用载玻片悬滴培养法,取正常的油茶炭疽病菌孢子于载玻片上,向其中分别滴加已用无菌水溶解后的抑菌圈最大的组分和变色圈最大的组分,以滴加无菌水的孢子作为对照,室温放置24 h后于显微镜下观察。
1.5 Y13主要抑菌物质结构鉴定
采用美国热电LTQ velos pro型液相色谱-质谱联用仪对Y13产生的主要抑菌物质进行质谱鉴定。
1.6 数据统计分析
试验数据用平均值±标准差来表示。采用 SAS 8.0软件对试验数据进行方差分析和多重比较。当P<0.05 时,表示差异显著;当P>0.05 时,表示差异不显著。
2 结果与分析
2.1 Y13发酵液抑菌物质分离
抑菌结果表明,各浓度乙醇提取物均有抑菌效果。方差分析表明,乙醇浓度对抑菌物质抑菌活性的影响达到显著性差异(P<0.05),说明乙醇浓度的高低直接影响了抑菌物质活性的强弱。
对乙醇提取物抑菌活性进行差异性分析,见表1。从中可以看出80%乙醇提取物的抑菌效果最强,明显高于其他浓度提取物的抑菌活性。通过LSD法进行多重比较分析,结果发现80%乙醇提取物的抑菌圈直径最大,活性最强,与其他所有处理组的抑菌活性均有显著性差异,说明此抑菌物质最易被80%乙醇提取出来,因此将80%作为乙醇的最佳提取浓度。
表1乙醇提取物抑菌活性的差异性分析1)
Table1Differenceanalysisofinhibitoryeffectofantimicrobialsubstancespurifiedbyethanolprecipitation

乙醇浓度/%Theconcentrationofethanol抑菌圈直径/mmThediameterofinhibitionzone40(14.50±1.05)cd60(16.50±1.05)bc70(15.50±1.98)c80(19.50±1.05)a90(12.67±0.52)dCK(17.33±2.25)b
1)采用LSD法进行多重比较分析,同列数值后具有不同字母表示差异显著(P<0.05)。表中数据用平均值±标准差表示。 Values in each column followed by different letters are significantly different at 5% level by Duncan’s mean value test.The data are shown as Mean±SD.
2.2 Y13抑菌物质纯化
2.2.1 固相萃取法纯化抑菌物质
抑菌结果表明,只有不被吸附在固相萃取柱上的组分没有抑菌活性,其他组分均有明显抑菌效果,其中65%甲醇洗脱组分的抑菌效果最强(见表2)。65%甲醇洗脱组分与其他组分的活性均有显著性差异。
表2固相萃取抑菌物质的抑菌活性1)
Table2Theinhibitoryactivityofantimicrobialsubstancepurifiedbysolid-phaseextraction

甲醇浓度/%Theconcentrationofmethanol抑菌圈直径/mmThediameterofinhibitionzone0―45(20.17±0.75)b65(29.50±3.21)a95(18.33±1.75)bCK(20.17±0.75)b
1)采用LSD法进行多重比较分析,同列数值后字母不相同表示差异显著(P<0.05)。表中数据用平均值±标准差表示。 Values in each column followed by different letters are significantly different at 5% level by Duncan’s mean value test.The data are shown as Mean±SD.
2.2.2 高效液相色谱法纯化抑菌物质
经过43%~95%乙腈进行梯度洗脱后得到20个主要的色谱峰,见图1。
2.2.3 HPLC纯化后各组分抑菌检测结果
20个主要色谱峰抑菌结果如图2所示。主要可以分为两大类,其中前8个洗脱峰组分是一类抑菌物质,它们主要产生明显的抑菌圈。9号到16号组分可以产生明显的变色圈,使指示菌菌丝的颜色明显加深,变黑。而17~20号无任何抑菌效果。
对各个组分产生的抑菌圈直径和变色圈直径进行测量,结果如图3所示,在产生明显抑菌圈的前8个组分中,1号的抑菌活性最强,其次为3号组分,5号组分最弱,72 h后5号组分几乎完全失活,分析原因可能是由于浓度较低导致。在9~16号组分中,14号组分所产生的变色圈最大,其导致菌丝颜色加深的效果最为明显。
2.2.4 HPLC参数优化结果
通过一系列的色谱条件优化后,使保留时间在29.5~35.0min期间的色谱峰达到一定的分离效果,符合质谱鉴定的要求,结果见图4。
2.3 Y13主要抑菌物质结构初步鉴定
利用ITMS对保留时间为11.0min和37.5 min的两个化合物分别做质谱解析,结果见图5和图6。图5中检测到[M+H ]+的m/z为1043.56,因此确定该物质的分子量为1042.56u。图6中检测到[M+H ]+的m/z为1481.85,因此确定此物质的分子量是1480.85 u,查阅文献分析对比,确定前者为iturin同系物,后者为fengycin同系物。

图1 反相HPLC纯化抑菌物质Fig.1 Purification of antimicrobial substance by RP-HPLC

图2 各组分对油茶炭疽病菌的作用效果Fig.2 The inhibitory effect of the peak fractions on Colletotrichum gloeosporioides

图3 抑菌物质对油茶炭疽病菌的抑制作用Fig.3 The inhibitory effect of antimicrobial substance on C.gloeosporioides
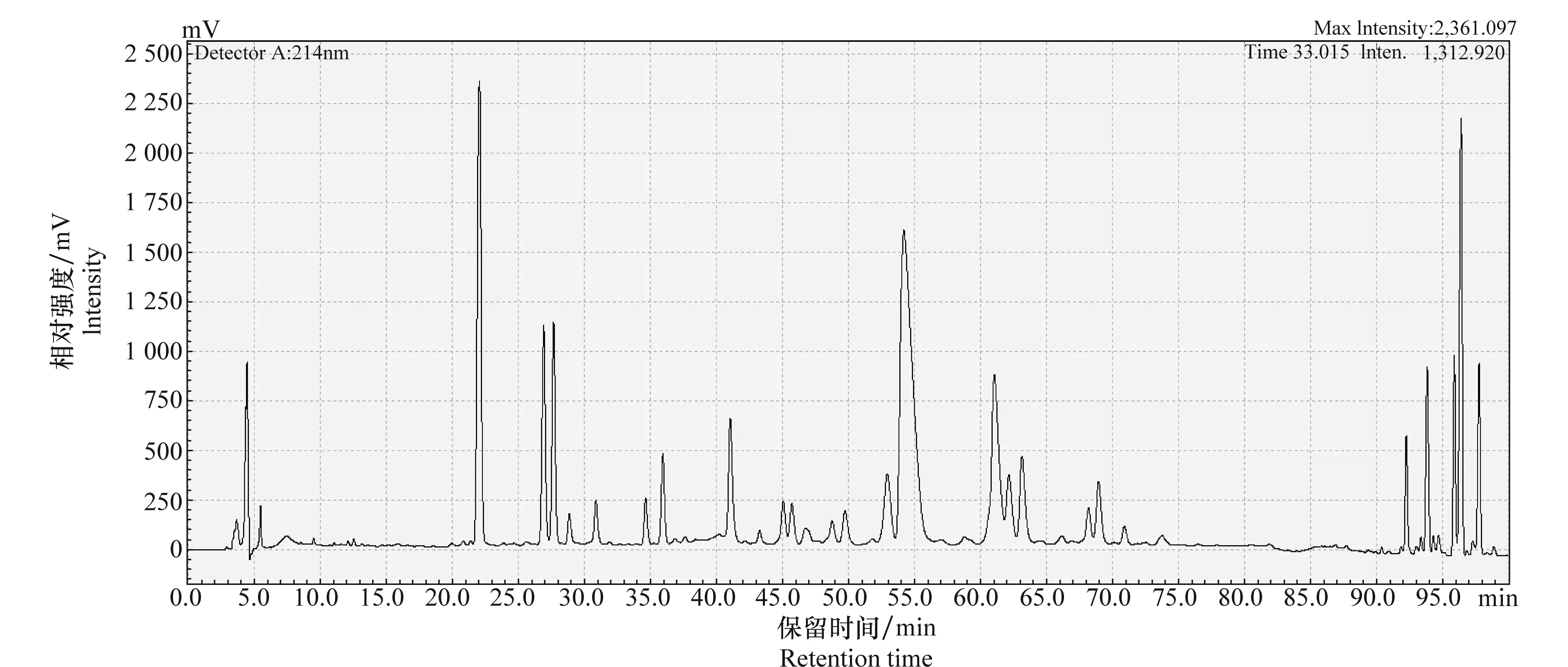
图4 优化后高效液相色谱图Fig.4 HPLC chromatogram after optimization

图5 保留时间为11.0min处化合物的一级质谱图Fig.5 The mass spectrum at retention time 11.0min

图6 保留时间为37.5 min处化合物的一级质谱图Fig.6 The mass spectrum at retention time 37.5 min
2.4 Y13抑菌物质对油茶炭疽病菌的作用方式
2.4.1 抑菌物质对油茶炭疽病菌菌丝形态的影响
显微镜下观察油茶炭疽病菌经两类主要抑菌物质处理前后,菌丝形态的变化见图7。结果发现,油茶炭疽病菌的正常菌丝形状较规则,细长,原生质分布均匀。而经1号抑菌物质处理后菌丝形状发生扭曲,菌丝多处发生了断裂及缠绕。而14号抑菌物质导致菌丝扭曲变形且菌丝节间变粗。因此这两类抑菌物质均抑制菌丝的生长。

图7 抑菌物质处理油茶炭疽病菌菌丝形态的显微观察Fig.7 Microscope observation of the mycelial morphology of C.gloeosporioides treated with antimicrobial substance
2.4.2 抑菌物质对油茶炭疽病菌孢子的影响
显微镜下观察油茶炭疽病菌孢子见图8。正常孢子的形状很规则,呈扁平状,长而细。经1号抑菌组分处理后的大多数孢子破裂,形状不规则且混成一片。14号抑菌组分处理后的孢子明显变得短小而粗大,其破坏程度相对于1号处理组较轻,但仍抑制了孢子的萌发。因此两类抑菌物质均可以导致孢子破碎,抑制其萌发。

图8 抑菌物质处理油茶炭疽病菌孢子形态的显微观察Fig.8 Microscope observation of C.gloeosporioides spores treated with antimicrobial substance
3 结论与讨论
目前对于枯草芽胞杆菌抑菌物质的研究已有相关报道。枯草芽胞杆菌产生的抑菌物质主要为脂肽类抗生素、细菌素及少量的抗菌蛋白[5,12-15]。裴韬等[16]利用盐析、透析以及离子交换层析相结合的方法对枯草芽孢杆菌P72进行分离纯化,最终得到对小麦赤霉病菌有很强抑制能力的抗菌蛋白。沈锦玉等[17]通过浓盐酸沉淀、乙醇抽提、离子交换层析和高效液相色谱法对枯草芽胞杆菌B115进行分离纯化,最终得到分子量为803.6Da的抑菌物质。
本试验主要采用乙醇沉淀、SPE固相萃取以及反相高效液相法得到Y13代谢物中的抑菌物质。经离子阱质谱初步检测,确定保留时间在11.0min和37.5 min处的化合物的主要离子峰的质荷比分别为1043.56和1481.85。Chen等[18]从枯草芽胞杆菌JA中分离纯化出主要的活性物质,并通过ESI-MS分析鉴定出质荷比为1043.4的物质为iturin同系物。因此确定本试验中质荷比为1043.56的物质为iturin同系物。杨琦瑶等[19]从对辣椒疫霉病菌有强烈抑制作用的枯草芽胞杆菌菌株B006的发酵液中提取出主要成分,经质谱鉴定质荷比为1436、1450、1478和1492的物质为fengycin同系物,而本研究中质荷比为1481.85的物质与报道中物质相差不多,推断应为相差若干个亚甲基的fengycin同系物。具体同系物结构目前正在解析当中,有望发现新的同系物结构。
通过显微观察确定抑菌物质作用方式。对抑菌物质处理后的菌丝和孢子进行镜检,结果表明这些抑菌物质可以溶解油茶炭疽病菌的细胞壁从而使原生质外漏,导致菌丝断裂,同时还可以抑制孢子的萌发。这些抑菌物质对油茶炭疽病菌的抑制效果较好,是一类有开发价值的抗真菌药物。对于油茶内生菌Y13所产抑菌物质目前未见报道,本试验共纯化出16个抑菌组分,为了进一步确定这些物质的结构成分,目前正在进行质谱解析,希望通过了解抑菌物质的具体结构,为今后从代谢调控方面深入研究其抑菌机理提供有力支持。
[1] 靳爱仙,周国英,李河.油茶炭疽病的研究现状、问题与方向[J].中国森林病虫,2009,28(2): 27-31.
[2] 罗万周,罗万业.油茶炭疽病及其防治方法[J].农技服务,2007,24(6): 70.
[3] 季冬明.油茶无公害栽培的有害生物防治技术[J].安徽农学通报,2006,12(5): 204.
[4] 布婷婷,周国英,刘君昂,等.油茶内生拮抗细菌Y13菌株16S rDNA序列分析及抑菌机理研究[J].经济林研究,2012,30(3):10-15.
[5] 刘永锋.枯草芽孢杆菌(Bacillussubtilis)Bs-916胞外抗菌蛋白质的纯化及其鉴定[D].南京:南京农业大学,2006.
[6] Chang W T,Chen M L,Wang S L.An antifungal chitinase produced byBacillussubtilisusing chitin waste as a carbon source[J].World Journal of Microbiology and Biotechnology 2010,26(5): 945-950.
[7] Stover A G,Driks A.Secretion,localization,and antibacterial activity of Tas A,aBacillussubtilispore associated protein[J].Journal of Bacteriology,1999,181(5): 1664-1672.
[8] Peypoux F,Bonmati J M,Wallach J.Recent trends in the biochemistry of surfactin[J].Applied Microbiology Biotechnology,1999,51(5): 553-563.
[9] Maget D R,Peypoux F.Iturins,a special class of pore forming lipopeptides: biological and physicochemical properties[J].Toxicology,1994,87(1): 151-174.
[10]Ongena M,Jacques P,Toure Y.Involvement of fengycin type lipopeptides in the multifaceted biocontrol potential ofBacillussubtilis[J].Applied Microbiology Biotechnology,2005,69(1): 29-38.
[11]Babasaki K,Takao T,Shimonishi Y.Subtilosin A,a new antibiotic peptide produced byBacillussubtilisis 168: isolation,structural analysis,and biogenesis[J].Journal of Biological Chemistry,1985,98(3): 585-603.
[12]赵秀香,赵柏霞,马镝等,枯草芽孢杆菌SN-02抑菌物质的分离、纯化及结构测定[J].植物保护学报,2008,35(4):323-326.
[13]叶云峰,黎起秦.枯草芽孢杆菌B47菌株抗菌物质的分离纯化及其对玉米小斑病的防治作用[J].中国生物防治学报,2011,27(3): 357-361.
[14]刘静,王军,姚建铭,等.枯草芽孢杆菌JA抗菌物特性的研究及抗菌肽的分离纯化[J].微生物学报,2004,44(4): 511-514.
[15]南楠,戚向阳,袁勇军.枯草芽孢杆菌WL17产抗菌物质的分离、分析及其抗菌特性研究[J].中国食品学报,2012,12(8): 17-23.
[16]裴韬,任大明,石皎.小麦赤霉病拮抗菌P72抗菌物质的分离纯化和性质研究[J].安徽农业科学,2009,37(6): 2576-2577.
[17]沈锦玉,尹文林,曹铮,等.枯草芽孢杆菌B115抗菌蛋白的分离纯化及部分性质[J].水生生物学报,2005,29(6): 689-693.
[18]Chen H,Wang L, Su C X.Isolation and characterization of lipopeptide antibiotics produced byBacillussubtilis[J].Letters in Applied Microbiology,2008,47:180-186.
[19]杨琦瑶,索雅丽,郭荣君,等.枯草芽孢杆菌B006对黄瓜枯萎病菌和辣椒疫霉病菌的抑制作用及其抗菌组分分析[J].中国生物防治学报,2012,28(2):235-242.
IsolationandpurificationofantimicrobialsubstanceproducedbyendophyticbacteriaY13intheCamelliaanditsinhibitoryeffectonCamelliaanthracnose
Meng Qingmin,Zhou Guoying,Liu Jun’ang,Zuo Jie,Dong Wentong,Wang Ruiqin
(KeyLaboratoryoftheMinistryofEducationforNon-timberProductForestSilvicultureandProtection,CentralSouthUniversityofForestry﹠Technology,Changsha410004,China)
Bacillussubtilisstrain Y13isolated fromCamelliahas strong inhibitory activity againstColletotrichumgloeosporioides.In order to identify the antimicrobial compounds and the inhibition mechanism againstC.gloeosporioides,the antimicrobial substances were isolated and purified by ethanol precipitation,solid phase extraction and reversed phase high performance liquid chromatography.Antifungal activity assay indicated that 16main peak fractions had inhibition activity.The 16main peak fractions can be divided in two groups.One group at retention time from 10.5 min to 26.0min showed inhibition activity.The peak fraction at retention time 11.0min showed the strongest activity and the molecular weight was 1042.56u identified by LC-MS.The other group at retention time from 27.5 min to 39.5 min dark the mycelia ofC.gloeosporioides.The compound at retention time 37.5 min showed the strongest activity and the molecular weight was 1480.85 u.Microscope observation revealed that the 2 compounds could break up and enlarge the mycelia,deform and swell the spores,and inhibit the spore germination.
Camelliaanthracnose; antagonistic bacteria; antimicrobial substance; isolation and purification; inhibition mechanism
2013-09-22
:2013-12-02
国家自然科学基金项目(31170598);湖南省研究生科研创新项目(CX2013B356);中南林业科技大学研究生科技创新资助项目(CX2013B25)
S 435.65, S 476.8
:ADOI:10.3969/j.issn.0529-1542.2014.02.007
* 通信作者 Tel: 0731-85623131; E-mail: kjc9620@163.com

