鳞翅目昆虫精巢融合的研究
刘 琳, 冯启理
(华南师范大学生命科学学院,广东省植物发育生物工程重点实验室,昆虫发育与分子生物学实验室,广州 510631)
鳞翅目(Lepidoptera)昆虫包括蝶类和蛾类,是昆虫纲仅次于鞘翅目的第二大目.鳞翅目为全变态昆虫,幼虫取食植物,许多鳞翅目昆虫是危害农业作物最严重的害虫,如棉铃虫(Helicoverpaarmigera)、小菜蛾(Plutellaxylostella)、斜纹夜蛾(Spodopteralitura)、玉米螟(Pyraustanubilalis)等农业害虫爆发时可以对整个地区的相关农作物造成极大的失收减产.农业害虫种群的爆发与环境气候、食物供应有关,还与害虫的交配与生殖能力有关.利用害虫的交配和生殖行为进行害虫防治,包括利用雄性不育进行害虫防治,一直是害虫生物防治的努力方向之一和重要的研究领域[1].要实现通过改变害虫的交配和生殖行为进行害虫防治,首先要求对害虫的生殖系统进行深入和系统的研究.目前已知,凡是交配和生殖能力越强的种群,其在田间爆发危害的可能性就越高.因此,对昆虫生殖系统的研究,可以为发展新的害虫生物防治策略提供理论依据和技术支持.
已知许多鳞翅目农业害虫在田间繁殖能力特别强,而且长时间存在,其中一个可能的原因是其精巢和精子的特殊发育过程[2].一般来说,昆虫在其生活周期中,雄虫体内形成左右2个精巢,在成熟时产生精子,在成虫期通过与雌虫交配,精子与雌虫受精卵受精后,产生虫卵,孵化出下一代的幼虫.但是,目前研究发现,许多鳞翅目农业害虫的左右2个精巢在幼虫发育的后期互相靠近,粘连然后融合成单个精巢[3-4].那么,这种精巢融合现象如何进化形成过程?是否有利于昆虫产生精子以及与卵子的受精?是否有利于昆虫繁殖力的提高和庞大种群的形成?对这些问题的研究和认识,将有利于对害虫田间繁殖、种群扩大的认识,有利于发展以生殖系统为靶标的新的害虫防治策略和技术.
本文将简述目前对鳞翅目昆虫精巢的类型、精巢和精子的发育、精巢融合的现象、过程和可能激素调控机理的研究进展,为进一步研究昆虫精巢融合的生物学意义、发育和分子生物学机理及其在农业害虫防治中的应用研究提供参考.
1 鳞翅目昆虫精巢的类型
昆虫精巢(Testis)是产生精子并为精子发育提供营养和保护的重要器官.鳞翅目昆虫精巢外由精巢鞘膜或围巢膜(Testis sheath)包裹,精巢内通常有4个精小囊(Follicle), 精小囊内含有处于不同发育阶段的生殖细胞(或精细胞).根据鳞翅目昆虫成虫精巢的形态和排列方式, 其精巢大致分为2大类型(图1):一是成虫有2个精巢,左右对称,精巢内有4个精小囊,精巢在发育过程中不融合,到了成虫2个精巢仍然是分开的,如蚕蛾科(Bombydidae)的家蚕(Bombyx mori);二是成虫左右2个精巢在化蛹时靠拢、粘连、扭曲嵌合,最终融合成不可分离的单一精巢, 这个过程为精巢融合(Fusion of testis), 如夜蛾科(Noctuidae)的粘虫(Leucaniaseparata)和玉米夜蛾(Heliothiszea)[4-5]. 也存在处于两者之间的类型,左右2个精巢在化蛹时靠拢和粘连,外观看成为一个精巢,但不会完全融合,精巢仍然可以剥分为2个单独的精巢,如灰蝶科(Lycaenidae)的灰蝶(Lycaenasp.).

图1 鳞翅目昆虫精巢发育类型的示意图
Figure 1 Schematic figure to show testis types of Lepidoptera insects
2 鳞翅目昆虫精巢的结构
鳞翅目昆虫精巢由围巢膜包裹,包括外膜(External sheath 或Peritoneal sheath)与内膜(Follicular epithelium)[6-7].外膜最外层为非细胞结构的外基膜(Outer basal lamina),含分散的内质网(Spare endoplasmic reticulum),内含物(Inclusion)和糖原颗粒(Glycogen).内膜由数层细胞构成,细胞质致密,含丰富的脂滴、糖原颗粒和细胞色素,丰富的线粒体和内质网;最内侧为内基膜(Inner basal lamina).内膜向内延伸形成精小囊隔膜,把精巢分为3~4个(通常为4个)卵圆形小腔室,即为精小囊(图2).精小囊内富含精囊液(Follicular fluid)[7].精小囊内有顶细胞(Apical cell)、囊细胞(Cyst cell) 及精原细胞(Spermatogonia).其中的顶细胞为生殖干细胞;精原细胞由囊细胞包围形成生精囊(Spermatocyst),囊内的精原细胞进行同步发育最后分化形成成熟的精子.生精囊的精原细胞通常先进行有丝分裂增加囊内的生殖细胞数目,形成精母细胞 (Spermatocyte),也称为初级精母细胞 (Primary spermatocyte),经第一次减数分裂形成次级精母细胞(Secondary spermatocyte), 再进行第二次减数分裂形成单倍体精子细胞(Spermatid),精子细胞最后延长并分化为成熟的精子(Spermatozoa),同一精囊的成熟精子形成精子束 (Sperm bundle)(图2).故从精小囊顶端到末端依次分布不同发育阶段的生精囊,分别为精原细胞囊、初级精母细胞囊、次级精母细胞囊、精细胞囊和成熟精子束(图2),成熟精子束通过各精小囊末端的输精小管汇合到输精管,供受精时用.
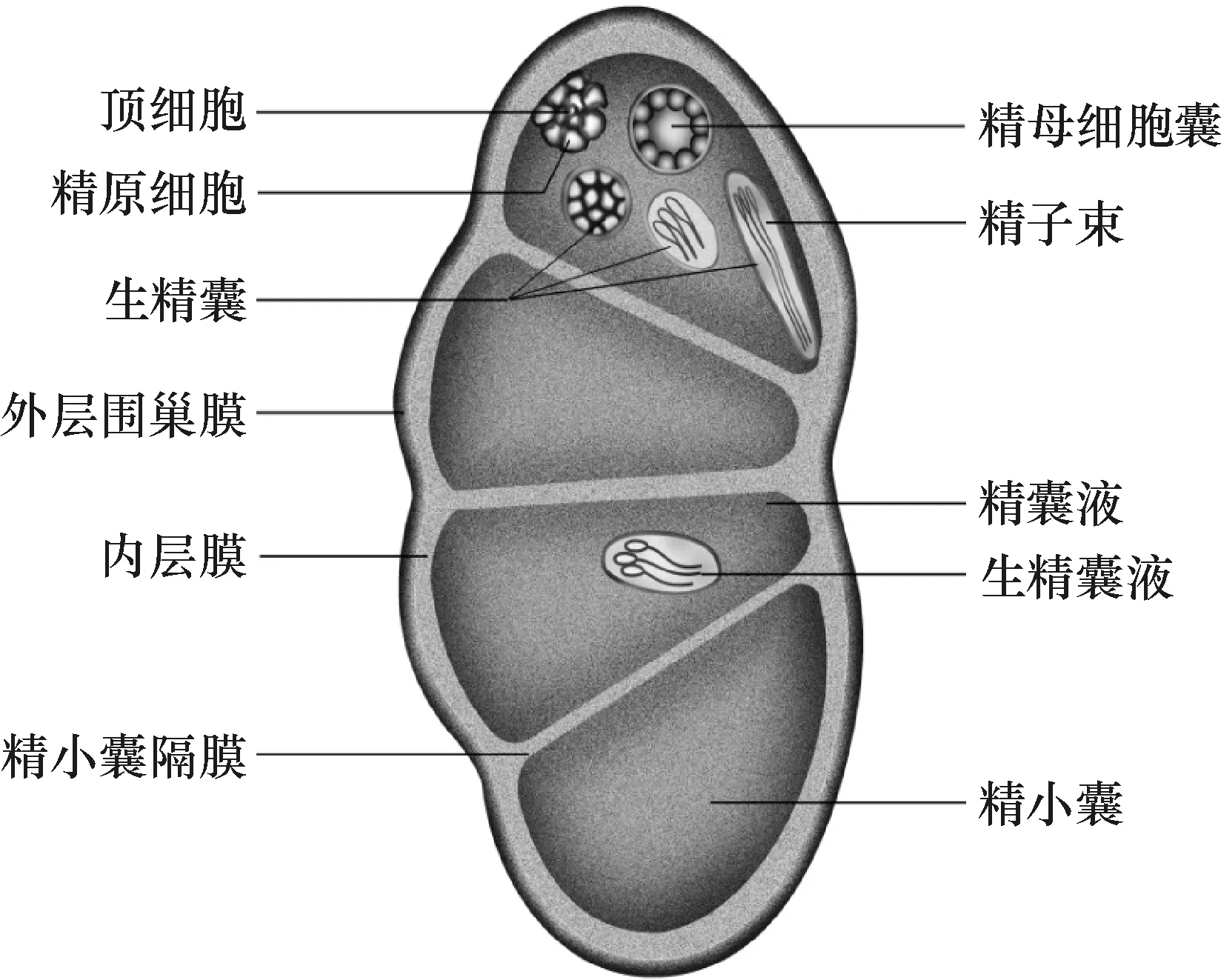
图2 鳞翅目昆虫精巢的结构示意图
Figure 2 Schematic figure to show testicular structure of Lepidoptera insects
3 昆虫精子的发育
不同动物的成熟精子形态差异大[8],但精子的发育基本过程相似,均经历精原细胞、精母细胞、精子细胞的阶段,最后分化为成熟的精子. 精细胞的发育受到严格而复杂的调控. 在脊椎动物中,已知促性腺发育激素(FSH,LH)、精巢间质细胞(Leydig cell)合成的睾丸酮, 支持细胞(Sertoli cell)产生的旁分泌生长因子,减数分裂、DNA复制、细胞骨架、细胞周期的相关基因均参与了精子的发育[9-10].但对昆虫精子发育调控的研究尚不充分.在果蝇中,20E可促进精原细胞有丝分裂形成初级精母细胞,而高水平的JH可抑制这一过程的发生[7, 11].另外,在果蝇中,还鉴定出与精子干细胞分化及精子发育相关的系列基因,例如,Bag of marbles (bam)基因突变后精原细胞不能形成初级精母细胞,而基因如aly(always early),can(cannonball),mia(meiosis I arrest)和Sa(Spermatocyte arrest)是完成减数分裂形成精子必须的[12].
鳞翅目昆虫精子发育的过程中分化形成2种类型的精子:有核精子 (Eupyrene sperm) 和无核精子 (Apyrene sperm).前者成熟精子具细胞核,为单倍体;后者分化过程中失去细胞核成为无核精子.这2类精子的分化时间、途径、结构及DNA量均不同.它们发育的分歧点是从精原细胞开始,分别形成有核精母细胞囊或无核精母细胞囊,然后按不同的方向分化.在幼虫早期精原细胞可形成初级精母细胞,进入减数分裂前期,如家蚕二龄幼虫就有处于粗线期的初级精母细胞[13],但一直维持此状态,直到末龄幼虫或蛹期才进一步完成减数分裂.而无核精子的分化在有核精子分化后启动,常在蛹期前后开始发育和分化.有核精子分化过程经历正常的减数分裂,而无核精子的减数分裂不正常,包括染色体不配对,形成不规则的细胞核,无联合复合体[2].控制这2类精子分化的机理尚不清楚[2,14].
4 鳞翅目昆虫精巢融合的过程
在精巢精子分化发育的同时,许多鳞翅目昆虫的精巢发生融合.在幼虫期精巢为左右对称的1对,但随虫体发育,到化蛹前,2个精巢逐渐靠拢,外膜首先粘连和融合,内膜再进一步融合,并发生扭转,2个精巢合二为一,融合为单个精巢.精巢融合现象在许多鳞翅目昆虫中已有描述,包括夜蛾科(Noctuidae)的粘虫[4]、小地老虎(Agrotisyprilon)[3]、棉铃虫(Helicoverpaarmigera)[15]、螟蛾科(Pyralidae)的三化螟(Tryporyzaincertula)[16]、欧洲麦粉蛾(Ephestiakuehniella)[17]、小卷蛾科(Olethreutidae)的枣镰翅小卷蛾(Ancylissativa)[18]及毒蛾科(Lymantriidae)的舞毒蛾(Lymantriadispar)[19]等.以斜纹夜蛾为例,在6龄幼虫的第3天,左右2个精巢是分离的(图3A),到了6龄第6天,2个精巢紧密相靠并粘连在一起(图3B),这是幼虫将要进入化蛹的时期(预蛹期).精巢融合随着化蛹的过程不断地进行,膜融合,精巢扭曲,最后形成单个的精巢(图3C).这时候精巢内部也发生着极大的变化,精母细胞进行减数分裂形成精子细胞,后者延长并分化为成熟的精子. 精巢融合后依然保留原来2个精巢的输精管(图3C).
5 鳞翅目昆虫精巢发育的激素调控及精巢激素
昆虫在胚胎发育期就形成了生殖原基,精巢的快速生长与发育通常发生在蛹变态前的幼虫期,而精巢融合则发生在化蛹变态前,即预蛹期.昆虫的变态发育受到昆虫激素调控的,蜕皮类激素(Ecdysteroids)和保幼激素(Juvenile hormone, JH)是最重要的2类调控昆虫发育的激素.蜕皮激素(ecdysone,E)由前胸腺体合成,释放到血淋巴后,在20-羟化酶(20-hydroxylase)的作用下转化为具有活性的20-羟基蜕皮激素(20-hydroxyecdysone,20E),并被运输到不同的靶器官和组织中发挥调控作用.JH由咽侧体合成,分泌到血淋巴后也被运输到不同的靶器官和组织中发挥调控作用.蛹变态前期高水平的20E和低水平的JH使到昆虫能从幼虫化蛹进入蛹期.在幼虫期,JH的作用是保持虫体的幼虫状态;而在蛹期和成虫期,JH可促进成虫器官的形成和成熟[20-21].

(A)6龄第3天,幼虫的精巢为左右对称的2个; (B)6龄第6天预蛹期2个精巢靠近、粘连并融合;(C) 进入蛹期第5天,已融合精巢进一步扭曲,形成一个不可分离的精巢
精巢融合发生在化蛹变态时,与蛹期变态发育密切相关. 那么,精巢的融合是否受到昆虫激素的调控?目前仅有2例报道.Nowock[22]用离体精巢培养实验证明,20E可促进体外培养的欧洲麦粉蛾末期幼虫精巢融合,但体外不能完成精巢的扭曲和完全的融合.Sato[23]研究黄粉蝶(Euremahecabe) 精巢融合时发现,20E可促进体外培养黄粉蝶精巢的融合;20E处理还可促进外层围巢膜消失,内层精小囊隔膜细胞主动迁移.
生殖腺不仅是生殖细胞生长发育的器官,也是合成性激素的器官.在脊椎动物中,精巢间质细胞合成的睾丸酮可促进精细胞的发育及雄性第二性征的形成[24].Loeb等[25]在烟芽夜蛾(Heliothisvirescens)幼虫末期精巢中检测到蜕皮激素,并发现精巢围巢膜20E水平比精囊液高.经体外培养2.5 h后,在精巢围巢膜的培养液中检测到高水平的蜕皮激素,而在生精囊(即精细胞)培养液中则没有检测到,说明精巢围巢膜可以合成并分泌蜕皮激素.
后来在舞毒蛾(Lymantriadispar)[26]、玉米螟(Ostrinianubilalis)[27]、甘蓝夜蛾(Mamestrabrassicae)[28]、粘虫(Luecaniaseparate)[29]和海灰翅夜蛾(Spodopteralittoralis)[30-31]的精巢中也检测到蜕皮激素,说明上述鳞翅目精巢在幼虫末期及蛹期可合成并释放蜕皮激素.但体外培养的舞毒蛾精巢围巢膜需要微量的外源20E作用下才能释放蜕皮激素[26].海灰翅夜蛾中精巢释放的蜕皮激素在幼虫期量的变化趋势与血淋巴中的蜕皮激素基本一致,在末龄幼虫呈现大小2个蜕皮激素峰,且大峰出现在蛹变态前期[31].精巢蜕皮激素的组成和种类以及水平与血淋巴液中的略有不同, 但20E仍是最主要的活性蜕皮激素[25,31];但从精巢测得的20E水平比血淋巴的低,仅为血淋巴中的0.1%~1%[31].体外用同位素标记的ecdysone(E),然后与精巢培养一定时间后用HPLC的方法检测蜕皮激素的组成,发现舞毒蛾精巢可把ecdysone(E)转化为20E[26];海灰翅夜蛾体外培养的精巢也可把前体2-deoxyedcysone 转化为 ecdysone(E)或20E[30].
在昆虫前胸腺中,蜕皮激素的合成受到促前胸腺激素(Prothoracicotropic hormone, PPTH)的调控,但PPTH并不影响精巢蜕皮激素的合成和释放.而从舞毒蛾脑中分离出的短肽(相对分子质量2.3×103),可刺激精巢释放蜕皮激素,但对前胸腺无作用,因此,该短肽可能是特异的精巢促蜕皮激素 (Testis ecdysiotropin)[26, 32].用免疫组化的方法在舞毒蛾精巢外层和内层围巢膜细胞中检测到了此短肽[33].
昆虫以胆固醇为最初底物经一系列反应合成蜕皮激素,激素合成涉及基因Neverland(Nvd),nonmolting glossy/shroud (Nm-g/Sro)及5种编码p450酶的基因,即spo,phm,dib,sad和shd[34]. 已在烟草天蛾(Manducasexta)[35]和海灰翅夜蛾[31]中鉴定出这些 p450同源基因,其中在海灰翅夜蛾中,除了sad外, 其他基因均在精巢围巢膜中有表达.shd就是编码20-羟化酶(20-hydroxylase)的基因,这说明精巢围巢膜可以合成ecdysone,也具有把ecdysone转化成具活性的20E的酶.
另一方面,血淋巴中的昆虫激素是否可以自由地通过精巢围巢膜进入精巢?精巢合成和分泌的蜕皮激素如何发挥其作用?在地中海粉螟(Anagastakuehniella)精巢体外培养液中,以辣根过氧化物酶(horseradish peroxidase, HP) 作为电子密度示踪物,通过电镜切片观察发现,HP可通过精巢外层、内层膜进入精小囊液中,但不能进入不同发育期的精细胞囊中,说明囊细胞膜(cyst envelope)具有屏障作用,可阻止血淋巴的成分进入精细胞囊中[6].而家蚕的囊细胞膜具紧密连接,有类似屏障的作用;而生精囊液(cyst fluid)成分与精囊液(follicular fluid)不同,这些结果说明,激素对精小囊内精细胞的发育可能是通过囊细胞膜转化激素信号后而实现的[36].目前仍不确定由围巢膜合成的蜕皮激素的生理功能是什么? 精巢鞘膜分泌的蜕皮激素的高峰期发生在精巢融合的预蛹期及蛹期,暗示可能与精巢融合有关[26].精巢分泌的蜕皮激素还可能参与刺激早期精母细胞的减数分裂、诱导生精囊分化、无核精子的发育、生殖管道的发育等[25].
6 斜纹夜蛾精巢融合的研究
近年来,我们课题组已以斜纹夜蛾精巢发育为研究对象,就其精巢融合的现象通过发育生物学、细胞生物学、分子生物学、功能基因组学和蛋白组学等方面开展了多方面的研究,以阐释斜纹夜蛾精巢融合的过程、机理和生理学作用及生物学意义.
从斜纹夜蛾6龄4天幼虫(6L4D,精巢未融合)、6龄6天幼虫(6L6D,预蛹期,精巢刚接触融合)和蛹期4天(P4D,精巢已完全融合)(图3)的虫或蛹中分离了精巢,并提取了高质量的RNA和蛋白,对其基因表达和蛋白表达进行了测定分析,共获得了63 292个单一基因转录本(Unigene),并注释了28 910个.鉴定获得了1 547个肽段,827个蛋白.对基因表达谱数据进行了初步的功能、细胞过程和细胞定位的GO分析,结果表明,在预蛹期精巢融合发生时,大量可与细胞和细胞膜融合相关的基因有高水平的表达,包括tubulin,integrin,cadherin,spectrin和laminin等,蛋白酶如serine protease,trypsin和collagenase等也有较高丰度的表达.而融合期高表达的基因主要参与的代谢通路包括ECM-receptor interaction; VEGF signaling pathway; tight junction等.精巢融合关键的调控分子正在筛选和鉴定中.
课题组还初步建立了斜纹夜蛾微创手术技术,在2个未融合的精巢间植入阻隔物,如硅胶片可阻断2个精巢的融合(图4).手术后的幼虫可正常地化蛹和羽化成蛾.但2个精巢不再融合(图4A和4C),而对照组的2个精巢在蛹期后完全融合(图4B和4D).阻断精巢融合后,可以观察其对精子发育和成熟的影响,以明确精巢融合是否有利于精子的发育.

A: 阻断精巢融合后,蛹期2个精巢是分离的;B: 没有阻断的2个精巢在蛹期已完全融合; C: 阻断精巢融合后,成虫期2个精巢仍然是分离的,示2条输精管;D: 没有阻断的2个精巢在成虫期已完全融合,但仍保留2输精管.
图4 通过微创手术阻隔斜纹夜蛾精巢的融合
Figure 4 Blockage of testicular fusion by surgery through small incisions under microscopy
分析结果还表明,当精巢融合被阻断后,雄虫精子束数目显著减少,表明在斜纹夜蛾中,精巢融合对精子的正常发育是有利的,但其作用机理及对生殖能力的影响仍在进一步深入研究中.
7 研究精巢融合的意义
对精巢融合的研究有2方面的重要意义:第一,目前发现,斜纹夜蛾、棉铃虫、粘虫和小地老虎等昆虫都是重要农业作物危害极大的害虫,其自然繁殖能力都很强,精巢发育都有融合现象,而驯化的鳞翅目昆虫如家蚕,其精巢的发育并没有精巢融合的现象.那么,精巢融合是受哪些基因调控的?精巢融合对精子形成和发育是否是有利的?在演化上,精巢融合对害虫在自然环境条件下的种群繁殖是否有利呢?其生物学意义又是什么?这些科学问题尚待回答.目前,缺乏对昆虫精巢融合深入的细胞生物学、分子生物学和发育生物学的研究报道.
第二,利用雄性不育的原理进行害虫防治是一个重要的策略和途径.很早以前就利用辐射方法诱导夜蛾属农业害虫的雄性不育.目前已有通过转基因技术,构建带有雄性不育基因的按蚊,阻止带有疟疾病原物的传播的报道[37].因此,对精巢发育特别是精巢融合的基础生物学研究,利用精巢融合特性,可以为寻找新的雄性不育靶标分子,为发展农业害虫防治的新技术和策略提供理论依据和途径.
参考文献:
[1] Knipling E F. Sterile-male method of population control[J]. Science, 1959,130(3380):902-904.
[2] Friedlander M, Seth R K, Reynolds S E. Eupyrene and apyrene sperm: Dichotomous spermatogenesis in Lepidoptera[J]. Advances in Insect Physiology, 2005,32:206-308.
[3] 卢筝. 小地老虎生殖系统的研究[J]. 昆虫学报, 1982,25(3):268-276.
Lu Z. Study on the reproductive system ofAgrotisypsilon[J]. Acta Entomologica Sinica, 1982, 25(3): 268-276.
[4] 吴秋雁,郭郛. 粘虫生殖的研究 Ⅲ:生殖系统的发育[J]. 昆虫学报, 1964,13(6):795-802.
Wu T N, Quo F. Study on the reproduction of the armywormLeucaniaseparataWalker (Lepidoptera:Noctuidae) Ⅲ: The development of reproductive system[J]. Acta Entomologica Sinica, 1964, 13(6): 795-802.
[5] Callahan P S. Serial morphology as a technique for determination of reproductive patterns in the corn earworm,Heliothiszea[J]. Annals of the Entomological Society of America, 1958,51:413-428.
[6] Szollosi A, Riemann J, Marcaillou C. Localization of the blood-testis barrier in the testis of the moth,Anagastakuehniella[J]. Journal of Ultrastructure Research, 1980,72(2):189-199.
[7] Klowden M J. Physiological Systems in Insects[M]. Beijing: Science Press, 2008:703.
[8] Pitnick S H, Birkhead T R. Sperm morphological diversity[C]∥Birkhead H D, Pitnick T R. Sperm biology, an evolutionary perspective[M]. USA: Elesvier, 2009: 69-149.
[9] Stukenborg J B, Colon E, Soder O. Ontogenesis of testis development and function in humans[J]. Sexual Development, 2010,4(4/5):199-212.
[10] Wainwright E N, Wilhelm D. The game plan: Cellular and molecular mechanisms of mammalian testis development[J]. Organogenesis in Development, 2010,90:231-262.
[11] Berger E M, Dubrovsky E B. Juvenile hormone molecular actions and interactions during development ofDrosophilamelanogaster[J]. Vitamins and Hormones, 2005,73:175-215.
[12] White-Cooper H. Studying how flies make sperm-Investigating gene function in Drosophila testes[J]. Molecular and Cellular Endocrinology, 2009,306(1/2):66-74.
[13] Takeuchi S. Endocrinological studies on spermatogenesis in the silkworm,BombyxmoriL[J]. Development, Growth and Differentiation, 1969,11(1):8-28.
[14] Friedlander M. Control of the eupyrene-apyrene sperm dimorphism in Lepidoptera[J]. Journal of Insect Physiology, 1997,43(12):1085-1092.
[15] 陈大福,牛宝龙,翁宏飚,等. 棉铃虫(Helicoverpaarmigera)幼虫性特征和精子的发生[J]. 浙江农业学报, 2004, 16(6):354-357.
Chen D F, Niu B L,Weng H B, et al. Study on larval sexual character and spermatogenesis of cotton bollworm(Helicoverpaarmigera)[J]. Acta Agriculturae Zhejiangensis, 2004, 16(6): 354-357.
[16] 宋慧英,周玲茜,游兰韶. 三化螟Tryporyzaincertulas(Walker)内部生殖系统的初步研究[J]. 昆虫学报, 1965,14(3):285-297.
Song H Y, Zhou L Q, You L S. The preliminary studies on the internal reproductive systems ofTryporyzaincertulas(Walker)[J]. Acta Entomologica Sinica, 1965, 14(3): 285-296.
[17] Garbini C P, Imberski R B. Spermatogenesis inEphestiakuehniella(Lepidoptera, Pyralididae)[J]. Transactions of the American Microscopical Society, 1977,96(2):189-203.
[18] 樊永亮,师光禄,李连昌. 枣螊翅小卷蛾生殖系统的研究[J]. 山西农业大学学报, 1965,13(4):30-33.
Fan Y L, Shi G L, Li L C.Study on the reproductive system ofAncylisSativaLiu[J]. Journal of Shanxi Agricultural University, 1993,13(4): 321-323.
[19] Salama H S. Spermatogenesis and testicular development in the gypsy moths,PorthetriadisparL[J]. Journal of Applied Entomology, 1976,81:102-110.
[20] Flatt T, Tu M P, Tatar M. Hormonal pleiotropy and the juvenile hormone regulation ofDrosophiladevelopment and life history[J]. Bioessays, 2005,27(10):999-1010.
[21] Riddiford L M, Hiruma K, Zhou X F, et.al. Insights into the molecular basis of the hormonal control of molting and metamorphosis fromManducasextaandDrosophilamelanogaster[J]. Insect Biochemistry and Molecular Biology, 2003,33(12):1327-38.
[22] Nowock J. Growth and metamorphosis in the testes ofEphestiakuhniellain vitro[J]. Journal of Insect Physiology, 1973,19: 941-949.
[23] Sato C. A study on the testicular fusion and its hormonal control in a butterfly,Euremahecabe[D]. Tokyo, Japan:Divison of Natural Science, Graduate School of International Christian University, 1998.
[24] Dufau M L. Endocrine regulation and communicating functions of the Leydig cell[J]. Annual Review of Physiology, 1988,50:483-508.
[25] Loeb M J, Woods C W, Brandt E P. Larval testes of the tabacco budworm,a new source of insect ecdysteroid[J]. Science, 1982, 218: 896-897.
[26] Loeb M J, Brandt E P, Woods C W, et al. Secretion of ecdysteroid by sheaths of testes of the gypsy moth,Lymantriadiapar, and its regulation by testis ecdysiotropin[J]. Journal of Experimental Zoology, 1988,248(1):94-100.
[27] Gelman D B, Woods C W, Loeb M J. Ecdysteroid synthesis by testes of 5th instars and pupae of the European corn borer,Ostrinianubilalis(Huber)[J]. Invertebrate Reproduction and Development, 1989,15:177-184.
[28] Shimizu T, Moribayashi A, Agui N. In vitro analysed of spermiogenesis and testicular ecdysteroids in the cabbage armyworm,MamestrabrassicaeL. Lepidoptera:Noctuidae[J]. Applied Entomology and Zoology, 1985,20:56-61.
[29] Shimizu T, Yagi S, Agui N. The relationship of testicular and hemolymoh ecdysteroid titer to spermiogenesis in the common armyworm,Leucaniaseparata[J]. Entomologia Experimentalis et Applicata, 1989,50:195-198.
[30] Jarvis T D, Earley F, Rees H H. Ecdysteroid biosynthesis in larval testes ofSpodopteralittoralis[J]. Insect Biochemistry and Molecular Biology, 1994,24:531-537.
[31] Iga M, Blais C, Smagghe G. Study on ecdysteroid levels and gene expression of enzymes related to ecdysteroid biosynthesis in the larval testis ofSpodopteralittoralis[J]. Archives of Insect Biochemistry and Physiology, 2013,82(1):14-28.
[32] Loeb M J, De Loof A, Gelman D B, et al. Testis ecdysiotropin, an insect gonadotropin that induces synthesis of ecdysteroid[J]. Archives of Insect Biochemistry and Physiology, 2001,47(4):181-188.
[33] Meola S M, Loeb M J, Kochansky J P, et al. Immunocytochemical localization of testis ecdysiotropin in the pupa of the gypsy moth,Lymantriadispar(Lepidoptera, Lymantriidae)[J]. Journal of Molecular Neuroscience, 1995,24(4):443-457.
[34] Brown M R, Sieglaff D H, Rees H H. Gonadal ecdysteroidogenesis in arthropoda: Occurrence and regulation[J]. The Annual Review of Entomology, 2009,54:105-125.
[35] Rewitz K F, Rybczynski R, Warren J T, et al. The Halloween genes code for cytochrome P450 enzymes mediating synthesis of the insect moulting hormone[J]. Biochemical Society Transactions, 2006,34(6):1256-1260.
[36] Toshimori K, Iwashita T, Oura C. Cell junctions in the cyst envelope in the silkworm testis,BombyxmoriLinne[J]. Cell and Tissue Research, 1979,202(1):63-73.
[37] Harris A F, Nimmo D, McKemey A R, et al. Field performance of engineered male mosquitoes[J]. Nature Biotechnology, 2011,29(11):1034-1037.

