鸭胸腺内 Ghrelin免疫组织化学的定位分布及发育性变化
元 艳, 方 静, 廖婷彬, 崔 雪, 陈 玥
(四川农业大学 动物医学院,四川 雅安 625014)
鸭胸腺内 Ghrelin免疫组织化学的定位分布及发育性变化
元 艳, 方 静, 廖婷彬, 崔 雪, 陈 玥
(四川农业大学 动物医学院,四川 雅安 625014)
【目的】研究Ghrelin在鸭胸腺发育过程中的定位分布及变化规律,以期为进一步探讨Ghrelin对胸腺生理功能的影响提供形态学资料.【方法】选用不同发育阶段的天府肉鸭,胚胎期分7个组,即:14、16、18、20、22、24和26 d胚龄组;胚后期分12个组,即:新生雏、1、3、5、8、11、14、17、20、26、29和32周龄组.运用免疫组织化学技术及形态计量方法研究Ghrelin在鸭胸腺发育过程中的定位分布及变化规律.【结果和结论】Ghrelin免疫阳性细胞弥散分布于20 d胚龄至胚后32周龄的胸腺小叶皮质和髓质;阳性细胞呈圆形、卵圆形、星形或不规则形,主要为胸腺上皮细胞和巨噬细胞.阳性细胞数量在胚胎期无明显差异,在胚后胸腺继续发育期(新生雏~8周龄)和成熟期(11~17周龄)呈波浪状变化,在退化期(20~32周龄)呈下降趋势.说明在天府肉鸭胸腺个体发育中存在Ghrelin免疫阳性细胞,其数量表现出明显增龄变化特性,与胸腺退化密切相关.
Ghrelin; 鸭; 胸腺; 发育; 免疫组织化学
Ghrelin是近年来发现的一种28肽,为生长激素促分泌素受体(Growth hormone secretagogue receptor, GHS-R)天然的内源性配体[1].当Ghrelin与其特异性受体结合之后,不仅能刺激垂体前叶释放生长激素(Growth hormone,GH)[2],还能刺激食欲及提高采食量,调节能量代谢、生殖和糖代谢,改善心血管功能等[3-6].Ghrelin及其GHS-R不仅广泛表达于中枢神经系统和外周器官组织中,还广泛表达于多种免疫细胞包括T、B 淋巴细胞、单核细胞、巨噬细胞、树突状细胞和嗜中性粒细胞,从而发挥重要的免疫调节作用[7-8]:如Ghrelin可影响细胞因子的产生及抗细胞凋亡的作用[8];注射Ghrelin 可改善老龄小鼠胸腺的结构及胸腺细胞的数量以及增强T淋巴细胞从胸腺中的输出[9-10];通过促进GH分泌的作用间接调节免疫功能等[8].目前,已有研究显示Ghrelin在小鼠、兔、人和鸡胸腺中均有表达[10-14].本文运用免疫组织化学技术及形态计量方法研究了Ghrelin在天府肉鸭胸腺胚胎及胚后发育过程中的定位分布及变化规律,以期为进一步探讨Ghrelin 对胸腺生理功能的影响提供形态学资料.
1 材料与方法
1.1 试验动物
选用不同发育阶段的天府肉鸭(四川农业大学种鸭场提供),胚胎期分7个组,即:14、16、18、20、22、24和26 d胚龄各一组;胚后期分12个组,即:0(新生雏)、1、3、5、8、11、14、17、20、26、29和32周龄各一组.胚胎期不分性别,胚后各期均为雌鸭,每组动物标本数为4只.
1.2 石蜡切片
采取动物的胸腺,固定于体积分数为4%多聚甲醛,经脱水、透明、石蜡包埋等过程,最后切片,片厚5 μm.
1.3 苏木素和伊红染色(H.E)
石蜡切片脱蜡后,常规H.E染色,镜检,观察胸腺发育的一般组织结构.
1.4 免疫组织化学染色
1.4.1 主要试剂 兔抗Ghrelin多克隆抗体(一抗),SABC免疫组织化学染色试剂盒,DAB显色试剂盒(均为武汉博士德生物工程有限公司产品).
1.4.2 免疫组织化学染色方法 按试剂盒说明书进行,具体操作如下:石蜡切片二甲苯脱蜡、梯度乙醇复水, 然后将切片置入体积分数为3%H2O21份与蒸馏水10份的混合液中,室温孵育5~10 min.将切片浸入0.01 mol/L 枸橼酸缓冲液(pH 6.0),微波炉加热抗原热修复,滴加体积分数为5% BSA封闭液,室温20 min,滴加1∶100稀释的一抗,4 ℃条件下过夜.滴加生物素化标记的二抗,37 ℃孵育30 min,滴加试剂SABC,37 ℃孵育30 min后DAB显色.以上各步骤均用PBS冲洗.苏木素轻度复染,脱水,透明,封片,显微镜观察,免疫阳性物质呈棕黄色.同时另用PBS代替一抗作为阴性对照.
1.5 显微定量分析和统计学处理
每个组织切片标本在Olympus CX21光学显微镜下观察;在400倍下随机选取10个视野用于NikonDS-Ri1数码显微摄影系统(每个视野相当于0.064 mm2)拍照,然后进行阳性细胞计数(江苏捷达801形态分析软件).试验数据用平均值±标准差表示,用SPSS 11.5软件进行数据统计分析和显著性检验,P<0.05有统计学意义.
2 结果
2.1 胸腺胚胎和胚后发育的组织结构
14 d胚龄,胸腺分叶不明显,其实质主要由胸腺上皮细胞、淋巴细胞和巨噬细胞等构成(图1a).16 d胚龄,胸腺组织已分化出胸腺小叶.18和20 d胚龄,胸腺实质中淋巴细胞增多,胸腺小叶增大.22 d胚龄,胸腺小叶的皮质及髓质开始分化,髓质内可见弥散胸腺小体(Diffuse Hassall corpuscle, DHC),由数量不等的胸腺上皮细胞集聚形成.24 d胚龄,胸腺小叶增大,髓质中可见典型胸腺小体即哈索尔小体(Hassall corpuscle,HC),由胸腺上皮细胞呈同心圆排列,中央的胸腺上皮细胞胞质强嗜酸性,出现角化(图1b).26 d胚龄,胸腺组织结构基本发育完善(图1c).新生雏胸腺小叶的皮质和髓质增宽.胚后1~5周龄,胸腺小叶显著增大,皮质和髓质明显增宽(图1d).8周龄胸腺小叶继续增大,但增大幅度较小.11~17周龄,胸腺组织结构无明显变化(图1e).20~32周龄,胸腺小叶萎缩变小;DHC增大,内含大量强嗜伊红的细胞碎片(图1f).因此,天府肉鸭胸腺胚后期0~8周龄为继续发育期,11~17周龄为成熟持续期,20~32周龄为退化期.
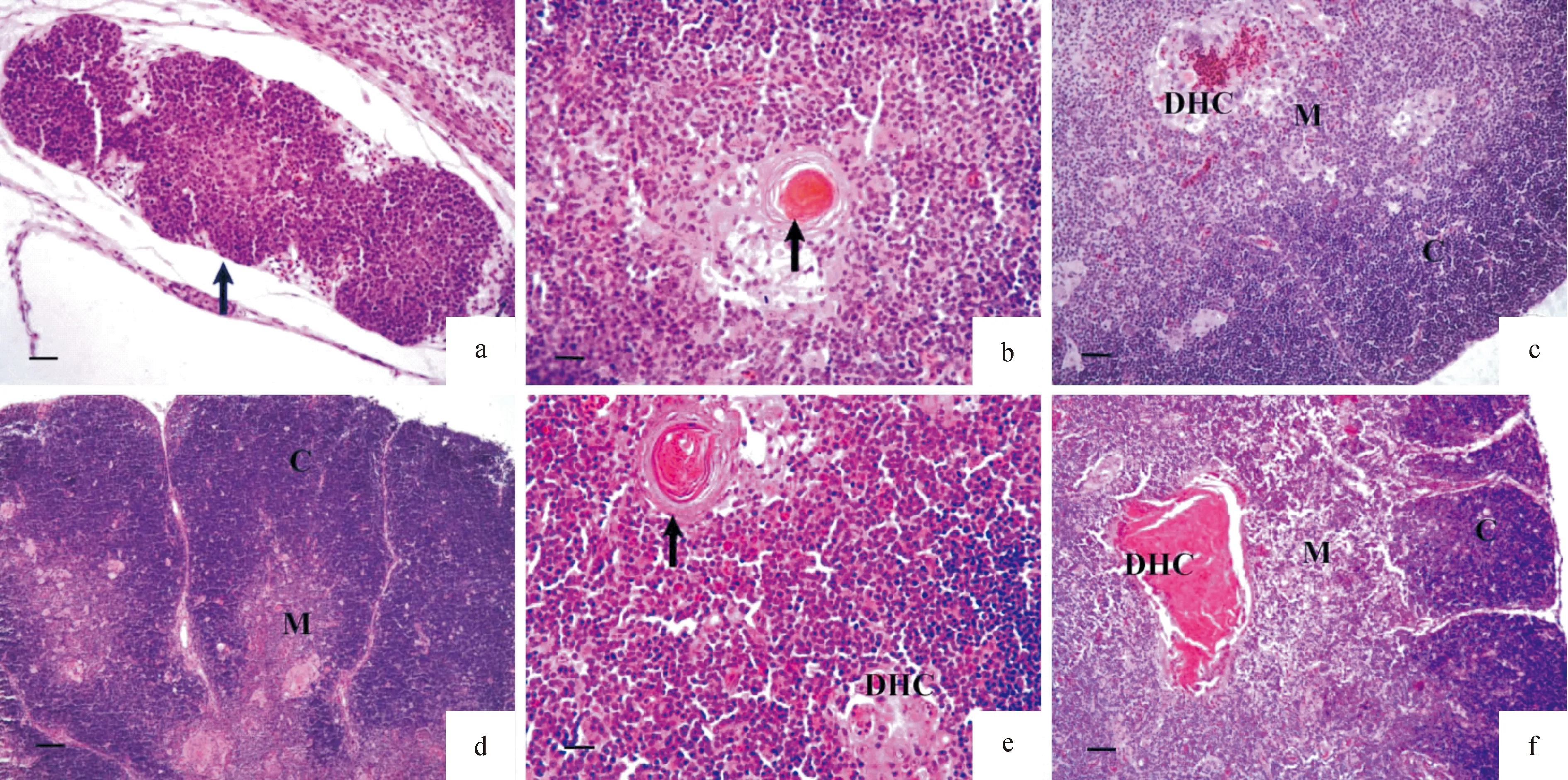
DHC: 弥散胸腺小体; C: 胸腺小叶皮质; M: 胸腺小叶髓质.
A:14 d胚龄胸腺(箭头),标尺=20 μm;b:24 d胚龄胸腺示典型胸腺小体(箭头),标尺=20 μm;c:26 d胚龄胸腺,标尺=20 μm;d:胚后3周龄胸腺,标尺=40 μm;e:胚后14周龄胸腺,典型胸腺小体(箭头),标尺=20 μm;f:胚后26周龄胸腺,标尺=40 μm.
图1 发育中的胸腺组织结构(H.E 染色)
Fig.1 The histological structure of thymic development(H.E staining)
2.2 免疫组织化学染色
显微定量结果显示Ghrelin免疫阳性细胞数量在胚胎期无明显变化,在胚后继续发育期和成熟期呈波浪状变化,在退化期呈下降趋势,其具体表现为:胸腺小叶皮质阳性细胞数量在20 d胚龄~0周龄恒定(P>0.05),0~3周龄上升(P<0.05),3~11周龄恒定(P>0.05),14周龄下降(P<0.05),17周龄上升并达其峰值(P<0.05),随后呈下降趋势,并于29和32周龄达最低.胸腺小叶髓质中Ghrelin阳性细胞数量与皮质变化规律相似,但在26 d胚龄~1周龄上升(P<0.05).此外,在同一年龄组中,皮质与髓质之间阳性细胞数量在20~26 d胚龄、3~14周龄以及29~32周龄差异不显著(P>0.05),但在0~1周龄以及17~26周龄皮质阳性细胞数量均明显低于髓质(P<0.05)(表1).Ghrelin免疫阳性细胞最早出现在20 d胚龄,随后在各组胸腺中均可见阳性细胞(图2a~2k),阳性信号定位于胞质和胞膜.Ghrelin阳性细胞散在分布于胸腺小叶皮质和髓质,呈圆形、卵圆形、星形、梭形和不规则形,主要为胸腺上皮细胞和巨噬细胞.其中,胸腺上皮细胞包括被膜下上皮细胞(图2a,2b)、皮质上皮细胞(图2c)、髓质上皮细胞(图2d)和HC中外围上皮细胞(图2e).但DHC中胸腺上皮细胞呈阴性反应(图2i,2k).在阴性对照片中,未见棕黄色免疫阳性反应(图2l).
表1各组胸腺中每个视野Ghrelin阳性细胞数1)
Tab.1Thenumberofghrelin-ircellsintheduckthymus

组别胸腺小叶皮质胸腺小叶髓质14~18d胚龄组……20d胚龄组9.34±2.53aA9.17±1.13aA22d胚龄组9.56±2.03aA9.49±1.97aA24d胚龄组10.29±1.51aA10.88±2.32aA26d胚龄组10.97±1.30aA11.04±1.82aA0周龄组10.59±1.71aA22.57±4.38bB1周龄组22.86±4.38bA31.69±5.21cB3周龄组30.32±6.45cA29.56±4.70cA5周龄组29.19±3.80cA30.79±6.94cA8周龄组31.39±6.82cA30.03±5.30cA11周龄组30.87±5.20cA30.11±4.87cA14周龄组21.93±3.28bA23.02±4.21bA17周龄组39.35±6.24dA43.67±5.73dB20周龄组30.96±5.19cA35.50±7.37eB26周龄组23.31±4.85bA29.79±5.30cB29周龄组6.32±2.29eA5.98±1.21fA32周龄组5.78±1.44eA5.19±1.82fA
1) 每个视野相当于0.064 mm2,表中数据为平均值±标准差, 同列数据后凡是有一个相同小写字母者,表示差异不显著(P>0.05, Duncan’s 法);同行数据后凡是有一个相同大写字母者,表示差异不显著(P>0.05,t检验).
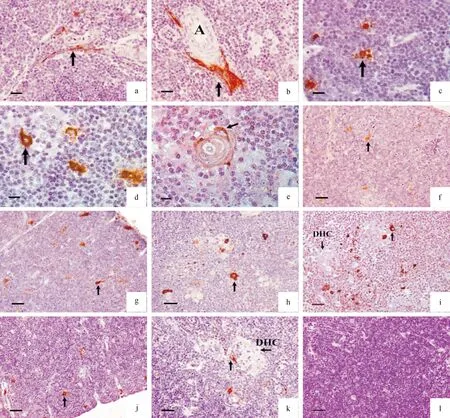
DHC: 弥散胸腺小体;A: 小动脉.
A:被膜下上皮细胞呈Ghrelin 免疫阳性反应 (箭头), 标尺=15 μm;b:小动脉周围被膜下上皮细胞呈Ghrelin 免疫阳性反应(箭头),标尺=15 μm; c:皮质上皮细胞呈Ghrelin 免疫阳性反应 (箭头), 标尺=10 μm;d:髓质上皮细胞呈Ghrelin 免疫阳性反应(箭头),标尺=10 μm;e:HC外围上皮细胞呈Ghrelin 免疫阳性反应(箭头),标尺=10 μm;f:26 d胚龄胸腺小叶皮质Ghrelin 免疫阳性细胞(箭头),标尺=20 μm;g:3周龄胸腺小叶皮质Ghrelin 免疫阳性细胞(箭头),标尺=20 μm;h:8周龄胸腺小叶髓质Ghrelin 免疫阳性细胞(箭头),标尺=20 μm;i:17周龄胸腺小叶髓质Ghrelin 免疫阳性细胞(箭头),DHC呈阴性反应(箭头),标尺=20 μm;j:29周龄胸腺小叶皮质Ghrelin 免疫阳性细胞(箭头),标尺=20 μm;k:29周龄胸腺小叶髓质Ghrelin 免疫阳性细胞(箭头),DHC呈阴性反应(箭头),标尺=20 μm; l:5周龄胸腺阴性对照,标尺=20 μm.
图2 胸腺Ghrelin免疫组织化学染色
Fig.2 Immunohistochemical reactions of ghrelin in the thymus
3 讨论
前人研究表明Ghrelin在正常动物胸腺内广泛表达.在人胸腺内,胸腺小叶皮质的巨噬细胞、皮髓交界区的上皮性网状细胞,髓质内的树突状细胞、上皮性网状细胞和巨噬细胞以及组成胸腺小体的上皮性网状细胞均呈Ghrelin免疫阳性反应[11].小鼠胸腺中存在大量Ghrelin 免疫反应阳性细胞,主要分布于髓质,而皮质中只有少量零星分布的阳性细胞,这些阳性细胞为胸腺上皮细胞、巨噬细胞和胸腺小体[12].在兔胸腺中,Ghrelin阳性细胞分布于胸腺小叶皮质和髓质中[13].在鸡胸腺中,胸腺上皮细胞、巨噬细胞及胸腺小体呈Ghrelin阳性反应[14].本试验结果显示天府肉鸭胸腺在20 d胚龄~32周龄存在Ghrelin阳性细胞,它们分布于胸腺小叶皮质和髓质,呈圆形、卵圆形、星形、梭形和不规则形,主要为胸腺上皮细胞和巨噬细胞.其中胸腺上皮细胞包括被膜下上皮细胞、皮质上皮细胞、髓质上皮细胞和HC中外围上皮细胞.说明Ghrelin在鸭胸腺内的表达细胞主要为非淋巴细胞,这与人[11]、小鼠[12]和鸡[14]基本相似.
目前有关Ghrelin在胸腺中的动态表达仅见少量报道.Vishwa等[10]通过免疫组化和RT-PCR方法研究了2、4、12、18月龄小鼠胸腺中Ghrelin的表达情况,发现该分子在2和4月龄小鼠胸腺中表达较高,而在12和18月龄中表达减少.李月等[13]采用RT-PCR方法研究了1、3、6、12月龄兔胸腺中Ghrelin mRNA的表达,结果显示该基因表达量在1、3月龄较高,在6、12月龄较低.魏凤梅等[14]通过免疫组化方法研究发现鸡胸腺中Ghrelin免疫阳性细胞的Ghrelin表达量在胚后2~30日龄逐渐增加,在44和58日龄有所下降.本研究结果显示天府肉鸭胸腺中Ghrelin阳性细胞数量在胚胎期恒定,在胚后继续发育期和成熟期呈波浪状变化,在退化期呈下降趋势,说明Ghrelin在天府肉鸭胸腺个体发育中表现出明显的增龄变化特性.这一变化规律是否与胸腺的生长、发育及退化相关值得进一步研究.但就目前有关Ghrelin的研究情况来看,其阳性细胞数量在鸭胸腺退化期呈下降趋势,至少说明该分子与胸腺的退化有关,其依据是增龄过程中神经肽分泌的变化与胸腺退化密切相关[15];小鼠胸腺内Ghrelin不足表现为增龄性退化加速,而Ghrelin灌注一定程度上可逆转与年龄相关的胸腺退化[10];Ghrelin及其受体表达于小鼠胸腺并随年龄的增长而减少,Ghrelin可能是抗衰老的因子,并具有延缓衰老时免疫系统衰退的效果[10,16];Ghrelin可影响细胞因子的产生及抗细胞凋亡的作用[8];Ghrelin具有促进GH分泌的作用,而GH具有十分显著的免疫调节功能,如促进胸腺T淋巴细胞增殖分化,抗免疫细胞凋亡等[8].
HC是胸腺中的一个重要结构, 有研究表明HC可分泌多种肽类物质[17-18].本试验结果显示在胚胎及胚后发育期,HC外围胸腺上皮细胞呈Ghrelin免疫阳性反应,这与人[11]、鼠[12]、鸡[14]中的研究结果相似,进一步证实HC具有分泌肽类物质的功能,是胸腺基质中的重要组成成分.由于HC位于胸腺髓质,推测其表达的Ghrelin主要通过旁分泌、内分泌等作用方式参与成熟T淋巴细胞的功能调节.
综上所述, 在天府肉鸭胸腺个体发育中存在Ghrelin免疫阳性细胞,其数量表现出明显的增龄变化特性,与胸腺的退化密切相关.
[1]KOJIMA M,HOSODA H,DATE Y,et al.Ghrelin is a growth-hormone-releasing acylated peptide from stomach[J].Nature,1999,4(2):656-660.
[2]DATE Y, MURAKAMI N, KOJIMA M, et al.Central effects of a novel acylated peptide, ghrelin, on growth hormone release in rats[J].Biochem Biophys Res Commun, 2000, 275(2):477-480.
[3]MASUDA Y, TANAKA T, INOMATA N, et al.Ghrelin stimulates gastric acid secretion and motility in rats[J].Biochem Biophys Res Commun, 2000, 276(3):905-908.
[4]WREN M, SMALL C J, WARD H L, et al.The novel hypothalamic peptide ghrelin stimulates food intake and growth hormone secretion[J].Endocrinology, 2000, 141(11):4325-4328.
[5]FERNANDEZ-FERNANDEZ R, TENA-SEMPERE M, NAVARRO V M, et al.Effects of ghrelin upon gonadotropin-releasing hormone and gonadotropin secretion in adult female rats:Invivoandinvitrostudies[J].Neuroendocrinology, 2005, 82(5):245-255.
[6]NAGAYA N, KANGAWA K.Ghrelin, a novel growth hormone-releasing peptide, in the treatment of chronic heart failure[J].Regul Pept, 2003, 114(2/3):71-77.
[7]HATTORI M,SAITO Z,YAGYU T,et al.GH,GH receptor,GH secretagogue receptor,and ghrelin expression in human T cells,B cells,and neutrophils[J].J Clin Endocrinol Metab,2001, 86(9): 4284-4291.
[8]NAOKI H.Expression,regulation and biological actions of growth hormone (GH) and ghrelin in the immune system[J].Growth Horm IGF Res,2009, 19(3):187-197.
[9]RICHARD A,WAYNE M.Reversal of age-associated thymic atrophy: Treatments,delivery,and side effects[J].Exp Gerontol,2008,43(7):700-705.
[10]VISHWA D D,HYUNWON Y,YUXIANG S,et al.Ghrelin promotes thymopoiesis during aging[J].Clin Invest,2007,117(10):2778-2790.
[11]赵洁,张金山,张远强,等.人胸腺内Ghrelin的免疫组织化学定位[J].解剖学杂志,2008,31(2):151-153.
[12]张嫒,李英,叶远兰,等.小鼠胸腺Ghrelin免疫反应阳性细胞的定位分布[J].河南农业科学,2009,3(5):122-124.
[13]李月,朱向蕾,杨桂红,等.Ghrelin及其受体在兔淋巴器官的分布及发育性变化[J].畜牧与兽医,2009,41(7):63-66.
[14]魏凤梅,李玉谷,叶远兰,等.Ghrelin免疫反应阳性细胞在鸡外周器官中的定位分布与发育性变化[J].畜牧兽医学报,2010,41(3):341-346.
[15]RITA R, FRANCESCA B, LUIGI F R.Histochemical and molecular overview of the thymus as site for T-cells development[J].Prog Histochem Cyto, 2008, 43(2):73-120.
[16]朱宝英,胡玉珍,赵玉峰.Ghrelin及其受体在免疫细胞的表达和生物学作用[J].细胞与分子免疫学杂志,2009,25(12):1210-1211.
[17]AZIZ A C, MICHAEL P, CONSTANTIN P.Proinsulin pxpression by Hassall’s porpuscles in the mouse thymus[J].Dabetes, 2004, 53(10):354-359.
[18]BODEY B, BODEY B J, SIEGEL S E.Novel insights into the function of the thymic Hassall’s bdies[J].In Vivo, 2000, 14(3):407-418.
【责任编辑柴 焰】
Immunohistochemicallocalizationanddevelopmentalchangesofghrelinintheduckthymus
YUAN Yan, FANG Jing, LIAO Tingbin, CUI Xue, CHEN Yue
(College of Veterinary Medicine, Sichuan Agricultural University, Ya’an 625014, China)
【Objective】 The immunohistochemical localization and developmental changes of ghrelin in the duck thymus were studied to provide the morphological effect of ghrelin on the physiological function of thymus.【Method】 Tianfu ducks were divided into 19 groups as follows: 7 groups in the embryonic period (14, 16, 18, 20, 22, 24 and 26 days at embryonic stage), 12 groups after hatching (at neonatal stage, 1, 3, 5, 8, 11, 14, 17, 20, 26, 29 and 32 weeks).The immunohistochemical method associated with morphometric analysis was used.【Result and conclusion】 The ghrelin immunoreactivity (-ir) cells with round, ovoid, stellate and irregular aspects were maily thymic epitheilial cells and macrophages, and diffusely distributed in the thymic cortex and medulla from embryonic 20 days to 32 weeks after hatching.The number of ghrelin-ir cells in the thymic cortex and medulla was unchanged during the embryonic development, presenting a wave-changed pattern during the continuous development (from neonatal stage to 8 weeks after hatching) and matured periods (from 11 to 17 weeks after hatching ), which decreased during the involution stage (from 20 to 32 weeks after hatching).These results suggested that ghrelin-ir cells existed in the duck thymus and their numbers exhibited obvious age-related changes, which can be closely related to the involution of the duck thymus.
ghrelin; duck; thymus; development; immunohistochemistry
2013- 11- 23优先出版时间2014- 07- 21
优先出版网址:http:∥www.cnki.net/kcms/detail/44.1110.S.20141003.1225.014.html
元 艳(1987—),女,硕士研究生,E-mail: yuanyan8507@sina.com;通信作者:方 静(1963—),女,博士,教授,E-mail:fangjing4109@163.com
教育部长江学者和创新团队发展计划(0848)
元 艳, 方 静, 廖婷彬,等.鸭胸腺内 Ghrelin免疫组织化学的定位分布及发育性变化[J].华南农业大学学报,2014,35(6):19- 23.
S852.1
A
1001- 411X(2014)06- 0019- 05

