2-甲酰苯胺-3-甲基苯并吡喃酮化合物的合成研究*
茹婷婷,丁晓岩
(吉林建筑大学 基础科学部,吉林 长春 130118)
2-甲酰苯胺-3-甲基苯并吡喃酮化合物的合成研究*
茹婷婷,丁晓岩
(吉林建筑大学 基础科学部,吉林 长春 130118)
介绍了一种以廉价易得的乙酰乙酰苯胺类化合物为反应原料,使其和二硫化碳发生化学反应,生成乙酰基二硫缩烯酮类化合物,该化合物在碱性条件下与芳香环类化合物发生反应得到2-甲酰苯胺-3-甲基苯并吡喃酮.
乙酰乙酰苯胺;二硫缩烯酮;苯并吡喃酮
苯并吡喃酮衍生物具有比较广泛的应用价值,根据不同的分子结构该类化合物可分为:苯并-a-吡喃酮和苯并-r-吡喃酮两大类.苯并-a-吡喃酮类化合物具有显著的生物活性和药理作用,其在抗血凝结、抗癌和抗病毒等方面有明显的作用.此外,苯并吡喃酮类化合物在可见光区范围内有很强的荧光性,可以利用这种特殊性质作为非线性光学生色团和激光染料、荧光探针、荧光增白剂等等.有文献报道可以使链状的α-羰基二硫缩烯酮类化合物发生Vilsmeier-Haack反应,一步就可以高效的制备吡啶类化合物.还有文献报道肉桂酰基二硫缩烯酮类化合物与二胺类化合物发生多米诺反应后,可以高产率地制备噻吩并噻喃酮类化合物.因此,本文介绍了一种以α-乙酰基二硫缩烯酮为反应原料,使其与芳香类化合物发生付-克烷基化反应,高产率地制备2-甲酰苯胺-3-甲基苯并吡喃酮的合成方法.
1 实验部分
1.1 试剂与仪器
VARIANUNITY-500MHz核磁共振仪(内标TMS,溶剂CDCl3);MAGNA-IR560型红外光谱仪(KBr压片法);Agilient1100LCMsD型质谱仪;GSA- 0.25 型 250毫升高压反应釜;PE-2400自动元素分析仪;电天平;旋片式真空泵;三用紫外线分析仪;旋转蒸发仪;79-l型磁力加热搅拌器;高效薄层板;柱层析分离柱.
1.2α-乙酰基二硫缩烯酮的合成

图1 α-乙酰基二硫缩烯酮的合成
取一只200mL的三颈瓶,向其中放入反应原料无水碳酸钾(10.0mmol,1.5g)和乙酰乙酰苯胺(5.0mmol,0.9g),加入DMF(10mL)作为反应溶剂常温反应20min.然后将反应体系温度控制在0~5℃之间,向体系中慢慢滴加二硫化碳(5.5mmol,0.4mL),观察到反应体系变红.用玻璃棒搅拌0.5h后,向反应液中慢慢滴加反应物溴乙烷(11.0mmol,0.9mL),控制在30min内滴完.常温下继续搅拌反应液8~10h.用TLC监测反应直到底物完全消失,把反应体系倒入冰水里,析出黄色沉淀,真空泵抽滤,用水洗涤黄色固体产物1(图1),得到产物约1.52g,计算反应产率约96 %.
1.3α-羟基二硫缩烯酮的合成

图2 α-羟基二硫缩烯酮的合成
取一只25mL圆底烧瓶,向其中加入化合物11mmol(0.182g)和无水乙醇(8mL),不断搅拌下慢慢加入NaBH41.3mmol(0.048g),常温下反应15min.采用TLC监测直到反应物完全消失,加入10mL水,用CH2Cl2萃取反应体系后,蒸干溶剂得到产物2(图2)约0.165g,计算产率约为88%.
1.4 2-甲酰苯胺-3-甲基苯并吡喃酮的制备

图3 2-甲酰苯胺-3-甲基苯并吡喃酮的制备
取一只25mL圆底烧瓶,向其中加入化合物2(1mmol,0.213g)、5mLCH2Cl2和对甲苯酚(2mmol,0.216g).慢慢加入AlCl3(1mmol,0.142g),常温下反应1h,用TLC监测反应直到反应物2完全消失,加入10mL水,用HCl调节体系pH值为酸性,用CH2Cl2萃取反应体系后,采用柱层析提纯得到产物(图3)30.187g,计算产率约为78%.
2 结果与讨论
2.1 取代基对化合物3合成的影响
在合成2-甲酰苯胺-3-甲基苯并吡喃酮的过程中,通过实验发现不同取代基R对反应有不同的影响,且得到不同结构的产物.当取代基R为酯基(-COOMe,-COOEt)时,得到的产物是两个烷硫基均被取代的苯并吡喃酮类化合物.当取代基R为腈基(-CN)时,得到的产物是一个烷硫基与酚羟基发生分子内取代,一个烷硫基不发生反应而被保留下来.当R为酰胺基(-CONHPh)时侯,发生付-克烷基化反应,两个烷硫基均不发生反应而全被保留下来.出现这种情况的是因为取代基吸电子能力不同,其大小顺序为:酯基>腈基>酰胺基,所以导致β位的烷硫基亲电能力逐渐减弱.
2.2 反应机理的研究
综合反应现象和实验结果,提出了下面可能的反应机理:化合物2 在酸的作用下得到碳正离子A,中间体A不稳定比较容易与芳烃发生付-克烷基化反应,被引进到芳环上的固定位置,当链型硫代缩烯酮结构被引入到羟基邻位的时候,羟基进一步和硫代缩烯酮结构部分发生反应.当取代基R为酯基时,烷硫基被羟基取代后会发生水解反应生成香豆素类化合物;当取代基R为腈基时,烷硫基被羟基取代之后不会发生水解反应,最终得到产物苯并吡喃类化合物;当取代基R为酰胺基时,烷硫基不被羟基取代,在强酸性条件下,苯胺基被羟基取代而得到化合物7(如图4).
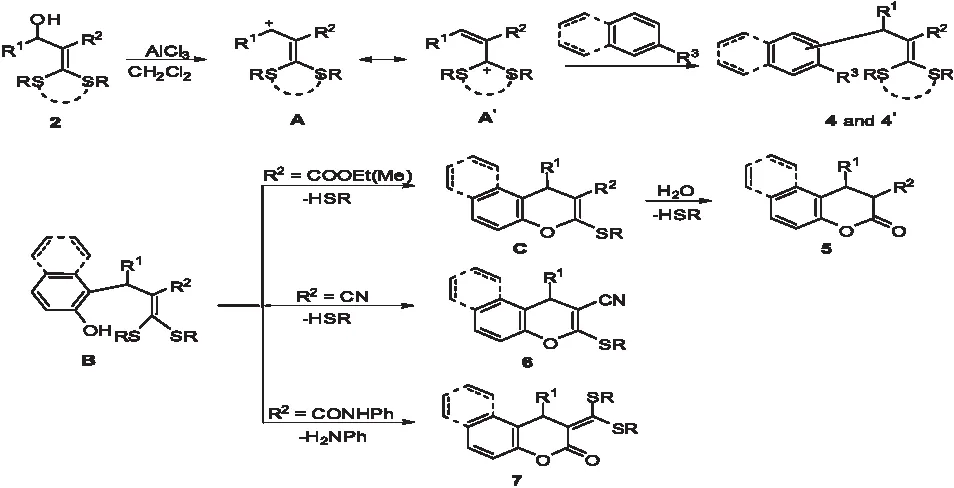
图4 硫代缩烯酮上不同取代基对产物的影响
2.3 所合成化合物的结构表征
化合物1:黄色固体;熔点74~76oC;1HNMR(CDCl3,500MHz)δ:3.38~3.39(m,2H),3.43~3.44(m,2H),3.88(s,3H),10.01(s,1H);13CNMR(CDCl3,125MHz)δ:36.6,38.0,51.8,115.6,165.9,184.1,185.8;IR(KBr,cm-1):2949,1692,1635,1251;MS(ESI)m/z205[(M+1)]+;Anal.Calcd(found)for:C7H8O3S2:C,41.16(41.28);H,3.95(3.88).
化合物2:无色液体;1HNMR(CDCl3,500MHz)δ:2.13(s,1H),3.37~3.45(m,4H),3.78(s,3H),4.50(s,2H);13CNMR(CDCl3,125MHz)δ:36.6,39.0,51.7,62.6,115.4,165.7,166.2;IR(KBr,cm-1):3446,2946,1655,1278;(ESI)m/z207[(M+1)]+;Anal.Calcd(found)for:C7H10O3S2:C,40.76(40.89);H,4.89(4.96).
化合物3:白色固体;1HNMR(CDCl3,500MHz)δ:1.35(d,J=7.0Hz,3H),2.33(s,3H),3.52(dd,J=6.5,7.0Hz,1H),3.56(d,J=6.0Hz,H),3.71(s,3H),6.96(d,J=8.5Hz,1H),7.03(s,1H),7.07(d,J=8.0Hz,1H);13CNMR(CDCl3,125MHz)δ:19.3,20.8,33.3,52.9,53.5,116.7,125.1,127.4,129.2,134.7,148.3,164.7,167.8;IR(KBr,cm-1):2970,1762,1733,1536,1465,1266;MS(ESI)m/z235[(M+1)]+.
3 结论
本实验方法的优点是选择廉价易得的化学药品为反应原料,所用试剂和催化剂也比较常见,反应发生的条件较为简单,所制备的产物在抗癌、抗病毒等方面有显著的作用.
[1]董环文,李科,郑灿辉,等.3-胺基取代苯并吡喃酮类化合物的设计合成及抗肿瘤活性[J].化学学报,2009,67(8):819-820.
[2]郑玉国,薛伟,郭晴晴,等.三唑席夫碱苯并吡喃酮衍生物的合成及其抗病毒活性[J].合成化学,2013,20(3):316-318.
[3]董环文,刘珏莹,张月莉,等.3-取代苯基苯并吡喃酮类化合物的设计合成及抗肿瘤活性[J].中国药物化学杂志,2010,20(4):252-254.
(责任编辑:水行)
2013-09-10
茹婷婷(1985-),女,吉林长春人,硕士,讲师.
吉林省教育厅“十一五”科学技术研究项目(吉教科合字2010第314号)
O
A
1008-7974(2014)01-0038-02

