密度信号对两种臂尾轮虫种群增长的影响
李 陈,牛翠娟
(生物多样性与生态工程教育部重点实验室,北京师范大学生命科学学院,北京 100875)
化学信号是水生生物信号传递的主要手段之一[1]。水体中的各种化学信号以及代谢产物对水生动物捕食和逃避捕食者,种群间与种群内个体间的竞争,防止种群过量增长等都具有重要影响,构成水生态系统化学生态学的主要研究内容[2]。轮虫作为化学生态学主要研究对象之一已经有较多的相关研究,如捕食者信号介导的诱导防御[3- 5],枝角类和轮虫释放的某些化学信号可抑制其自身的生长和繁殖[6- 8],同种的密度信号诱导轮虫发生的有性生殖[9- 10]。除密度信号诱导的有性生殖和自毒作用[11]外,关于轮虫自身释放的化学物质对种间关系影响的研究比较少[12]。
萼花臂尾轮虫(Brachionuscalyciflorus)和角突臂尾轮虫(Brachionusangularis)是广泛分布于淡水水域的两种常见的营浮游生活的臂尾轮虫,亲缘关系近,且同域分布。有关这两个物种之间的竞争,由于小个体的角突臂尾轮虫生长繁殖所需食物阈浓度更低[13],根据Tilman的资源竞争法则[14],在有限食物资源的情况下,角突臂尾轮虫最终会将萼花臂尾轮虫排除。但是在许多竞争实验中观察到,即使在食物很充足还未发生资源竞争的情况下,某些轮虫的种群增长也会受到竞争者的干扰[15- 17],因此我们推测在轮虫的种间竞争中除了资源竞争之外,必定还存在其他方式的干扰。目前对于化学性干扰所起的作用研究资料较少。本研究拟通过实验检测萼花臂尾轮虫和角突臂尾轮虫的密度信号分别对同种和异种种群增长的影响,观察不同物种对密度信号的响应情况。由于预实验过程中发现萼花臂尾轮虫种群增长受自身密度信号抑制较明显,为探讨原因,在观测密度信号对萼花臂尾轮虫种群增长的实验中同时观测密度信号对萼花臂尾轮虫种群混交率的影响。本研究成果可为评价化学性干扰在种间竞争中的作用,以及深入了解单巢类轮虫的竞争机制提供依据。
1 实验材料与方法
1.1 实验轮虫种群的培养和种群密度信号的制备
饵料藻的培养: 本实验饲养轮虫所用饵料为蛋白核小球藻(Chlorellapyrenoidosa),购自中国科学院典型培养物保藏委员会淡水藻种库。在温度25 ℃,光照3000 lx,光照时间L∶D=16∶8的恒温光照培养箱中培养。使用前将处于指数增长期的藻液在4 ℃、7500 r/min离心5 min,将收集的浓缩藻液计数并置于4 ℃冰箱内备用。
轮虫的培养: 本研究所用的萼花臂尾轮虫和角突臂尾轮虫均采自北京市西海,在实验室挑选单只轮虫进行单克隆培养,采用Modified MBL培养液[18](pH值 7.5)在恒温光照培养箱(20 ℃,2000 lx光照,L∶D=16∶8)进行培养。整个实验期间的食物浓度均为1×106个/mL,每天更换1次培养液,萼花臂尾轮虫预培养种群密度维持在1 个/mL左右,角突臂尾轮虫种群密度维持在2 个/mL左右,均进行一个月以上的预培养。
密度信号的制备: 实验中分别用不同密度的萼花臂尾轮虫滤液和角突臂尾轮虫滤液来代表不同强度的密度信号。根据预实验的种群增长情况,每种轮虫设置两个密度信号强度,角突臂尾轮虫低密度信号和高密度信号分别表示为AL和AH,萼花臂尾轮虫低密度信号和高密度信号分别表示为CL和CH。观测密度信号对萼花臂尾轮虫种群增长影响的实验所采用的密度信号分别为:角突臂尾轮虫AL(10 个/mL)和AH(40 个/mL),萼花臂尾轮虫CL(4个/mL)和CH(16 个/mL)。观测密度信号对角突臂尾轮虫种群增长影响的实验所采用的密度信号为AL(25 个/mL)和AH(100 个/mL),CL(4个/mL)和CH(16 个/mL)。为了描述和比较的方便,采用相同的字母标签。按照设定的密度随机挑选对应数量的萼花臂尾轮虫和角突臂尾轮虫,分别置于对应体积加有食物的培养液中,24h后用50 μm纱绢过滤除掉轮虫,然后再用0.22 μm微孔滤膜过滤,用0.1 mol/L的HCl/NaOH溶液将培养液pH值调至7.5后备用。对照组(Control)用未经处理的培养液(pH值 7.5)。
1.2 实验过程
根据萼花臂尾轮虫和角突臂尾轮虫种群增长的特点,分别采用20 mL和5 mL的培养体积,初始接种密度均为1 个/mL。从预培养种群中随机挑选对应数量的轮虫个体,将每种轮虫分别划分到5种不同培养液的实验组中(空白对照组+4种含不同密度信号滤液组),每组实验4个重复,食物浓度均为1×106个/mL。每天更换对应含1×106个/mL食物的培养液并记数,萼花臂尾轮虫种群分别记录带非混交卵雌体数(amictic females,AF)、未带卵雌体数(non-ovigerous females,NOF)、带混交卵雌体数(mictic females,MF)。由于角突臂尾轮虫受自身密度信号的影响不明显,故不做有性生殖分析,仅记录种群个体数量变化。实验直到种群密度经过最高点后达到平稳时期时(种群密度连续3d变化幅度低于15%)停止。
1.3 结果分析方法
1.3.1 种群增长结果分析
选取种群密度至平稳期之前的数据,用IBM SPSS Statistic 21.0 中一般线性模型的重复测量分析方法分析密度信号对种群增长的影响[19]。
利用Origin Pro. 8.0中的拟合分析对增长期的种群增长进行逻辑斯谛生长曲线拟合,所用拟合公式可表示为:
式中,K为环境容纳量,r为种群增长率,t为时间,获得K,a,r的估计值以及修正后的R2。
为了更好的比较种群的增长率,选取种群峰值密度及到达峰值所用的时间,利用公式来计算增长期的种群增长率rm:
rm=(lnNt-lnN0)/t
式中,N0和Nt分别为种群的初始密度和最终密度,t为种群增长经历的时间(d)[20],用one way-ANOVA统计分析各实验组间rm的差异。
1.3.2萼花臂尾轮虫种群混交率(即有性生殖比率)结果分析
混交率(mixis)为混交个体数与雌体总数之比,由于种群中部分未成熟的个体无法判定其为混交或非混交雌体,故无法直接获得精确的混交率。假设种群中未带卵的雌体的混交率与种群的混交率相同且忽略密度信号对带卵率的影响,则m=MF/(AF+MF)[21],绘制种群的混交率变化曲线,去除异常值后用IBM SPSS Statistic 21.0 中一般线性模型的重复测量分析方法分析密度信号对种群混交率的影响。
2 结果与分析
2.1 不同实验处理下萼花臂尾轮虫和角突臂尾轮虫种群增长分析
不同实验组萼花臂尾轮虫和角突臂尾轮虫的种群密度变化如图1所示。萼花臂尾轮虫种群到达种群密度最高点的时间很短(3—8 d),其中对照组和角突臂尾轮虫密度信号处理组(AL和AH)密度峰值达10 个/mL左右,而萼花臂尾轮虫密度信号处理组(CL和CH)密度峰值仅4 个/mL左右,不到前者的一半,随后种群密度开始持续降低。CH组的萼花臂尾轮虫种群在15 d左右的时候消失。
角突臂尾轮虫种群种群增长期历时23 d左右,对照组和角突臂尾轮虫密度信号组最高种群密度为100 个/mL左右,随后种群密度开始下降,然后进入一个动态平稳的时期(27—32 d)。
用一般线性模型的重复测量分析方法对种群进行分析的结果显示,两种臂尾轮虫的种群增长都显著受密度信号的影响(B.calyciflorus:P<0.001,B.angularis:P=0.018)。
逻辑斯谛模型拟合生长曲线获得K,a,r的估计值及修正后的R2如表1所示,拟合的种群增长曲线如图2和图3所示。
统计分析结果显示,角突臂尾轮虫密度信号组(AL和AH)的萼花臂尾轮虫和角突臂尾轮虫种群的环境容纳量K均与对照组无显著差异(表1),分别在9 个/mL左右和100 个/mL左右。萼花臂尾轮虫密度信号使萼花臂尾轮虫种群的环境容纳量K降低了50%—62%,使角突臂尾轮虫的种群K值降低了29%—40%。萼花臂尾轮虫低密度信号(CL)对萼花臂尾轮虫种群的增长率r影响显著,高密度信号组(CH)未检测出对萼花臂尾轮虫种群增长率的显著影响。CH组的角突臂尾轮虫种群增长率r显著高于对照组,角突臂尾轮虫密度信号对萼花臂尾轮虫和角突臂尾轮虫种群的种群增长率影响均不显著。
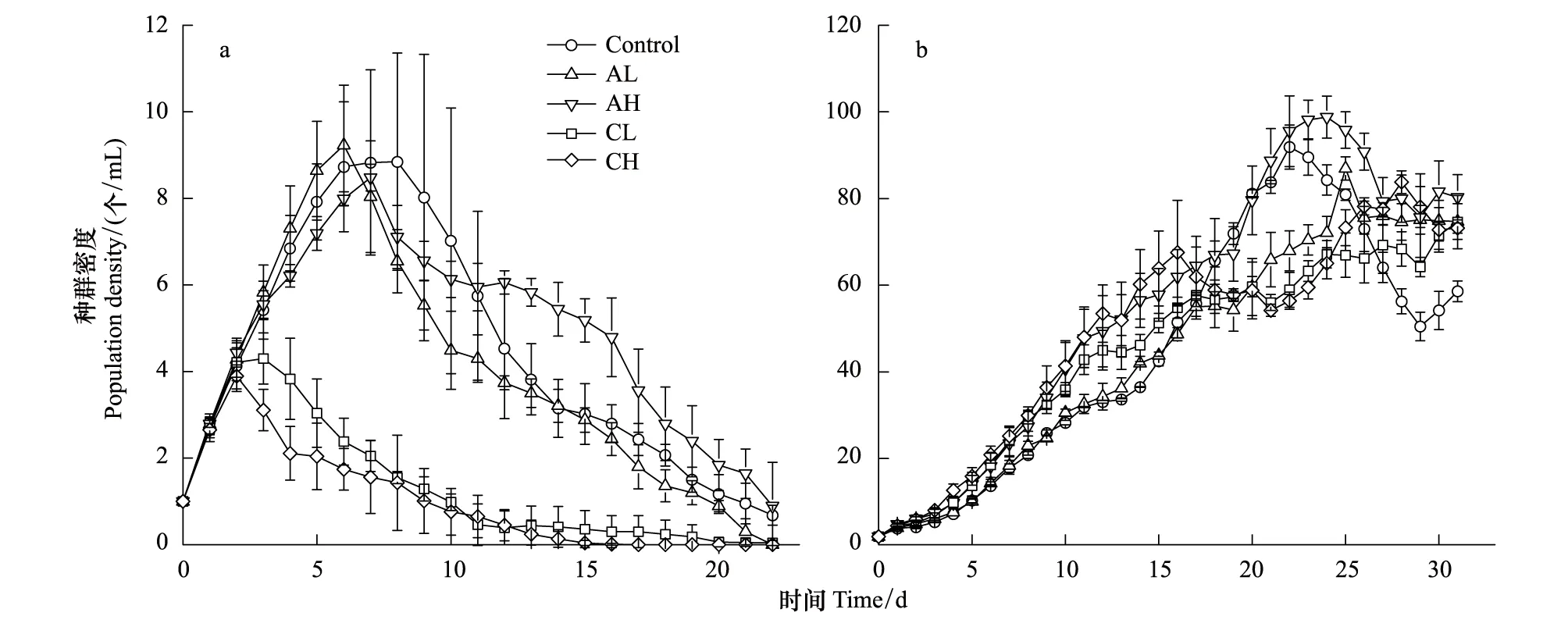
图1 萼花臂尾轮虫(a)和角突臂尾轮虫(b)的种群增长
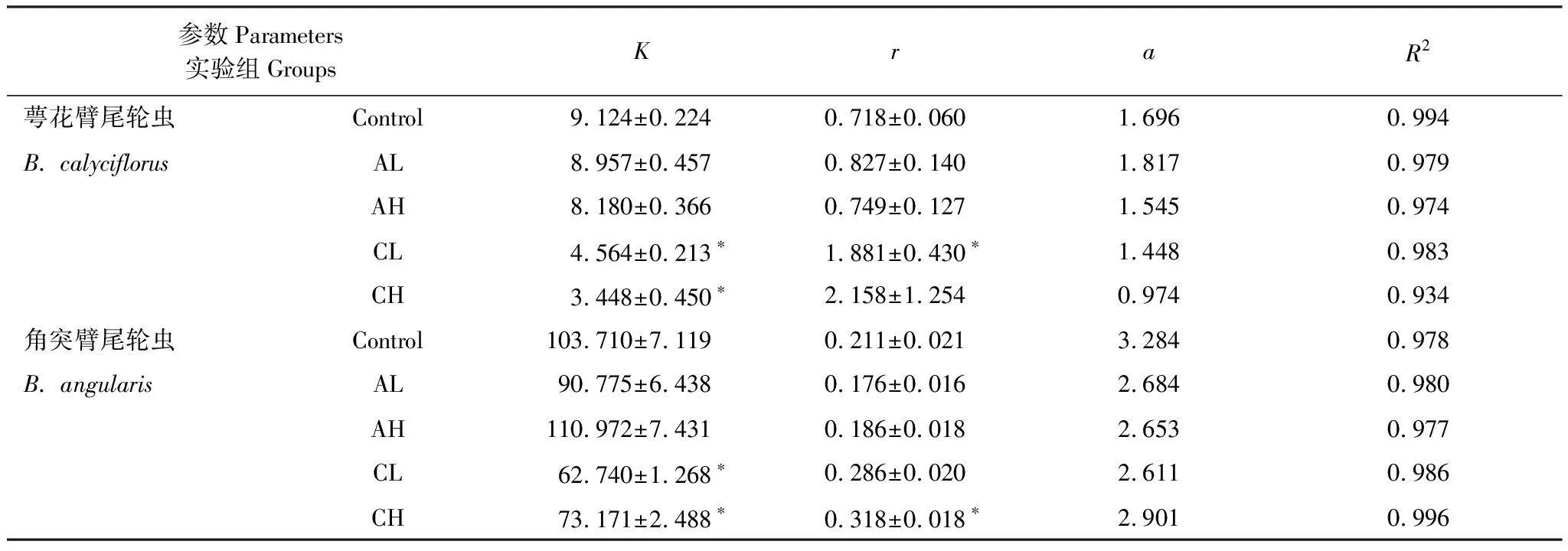
表1 logistic模型拟合生长曲线参数(Value±SE,*表示与对照组之间具有显著的差异,α=0.05)
各实验组种群增长期的种群增长率rm计算及分析结果如图4所示。
根据峰值计算的rm值的变化情况与曲线拟合的r变化趋势大体相似,角突臂尾轮虫的密度信号对两种臂尾轮虫的种群增长率均没有显著的影响(P>0.05)。萼花臂尾轮虫高密度信号(CH)下的萼花臂尾轮虫和角突臂尾轮虫的rm均显著高于对照组(P<0.001),萼花臂尾轮虫低密度信号(CL)仅对萼花臂尾轮虫的种群增长率有显著影响(P<0.001)。
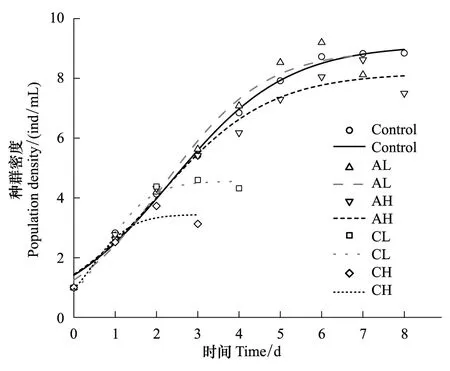
图2 不同密度信号下的萼花臂尾轮虫种群动态(符号)及logistic增长模型(线)
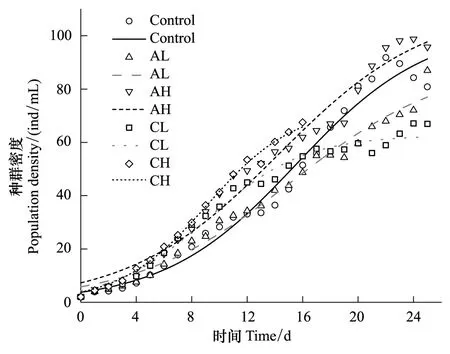
图3 不同密度信号下的角突臂尾轮虫种群动态(符号)及logistic增长模型(线)

图4 不同密度信号下萼花臂尾轮虫(a)和角突臂尾轮虫(b)的种群增长率(rm)(Mean±SE)
2.2 密度信号对萼花臂尾轮虫种群有性繁殖的影响
不同实验组萼花臂尾轮虫种群的混交率随时间的变化情况如图5所示。
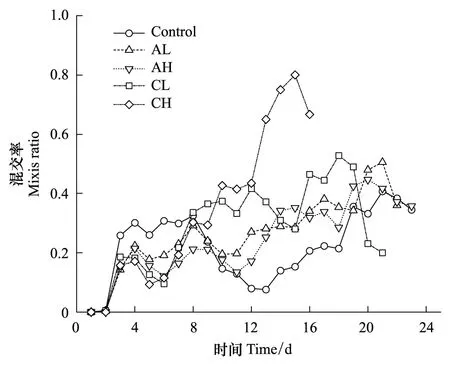
图5 不同实验组萼花臂尾轮虫种群混交率随时间的变化
重复测量分析方法对混交率进行分析的结果显示,密度信号对各实验组萼花臂尾轮虫种群的混交率无显著影响(P=0.25)。
种群的混交率在40%—80%之间波动,在各实验组之间无法看出很明显的差异。各实验组最早均在第4天出现休眠卵。
3 讨论
根据实验结果,萼花臂尾轮虫密度信号对角突臂尾轮虫和萼花臂尾轮虫的种群增长都有显著的影响,可提高种群增长率rm,降低环境容纳量K。而角突臂尾轮虫密度信号对于角突臂尾轮虫种群和萼花臂尾轮虫种群增长影响都不显著。萼花臂尾轮虫种群的混交率在各实验组之间也无显著差异。
在实验室种群动态中,除食物资源起主要限制作用外,影响种群密度的因子大概有3个:(1)密度信号诱导的有性生殖[22],(2)生物释放的某些有益的化学因子[12],(3)代谢废物的毒害作用[11]。
密度信号中含有可以诱导轮虫进行密度相关的有性生殖的物质,有性生殖最终会产生比无性卵需要更多能量投入的休眠卵[23],对种群的适合度产生代价,使种群的K值降低[22]。但是密度信号在不同的物种之间是具有特异性的[24],萼花臂尾轮虫和角突臂尾轮虫之间不能相互诱导有性生殖的发生,虽然有发现大于100 个/mL密度的角突臂尾轮虫滤液可以使萼花臂尾轮虫发生有性生殖[25],但本实验中用于萼花臂尾轮虫种群实验的角突臂尾轮虫密度信号低于100 个/mL,因此本实验中臂尾轮虫种群受非同种臂尾轮虫的密度信号产生的差异不是由有性生殖造成的。对于同种密度信号对种群的作用,种群混交率随着种群增长率的提高而增加[26],但是种群在达到一定的密度之后,有性生殖的投入是有限的,再高的密度信号也不可能诱导100%的混交率[27],混交率在种群达到一定密度之后会维持在一个比较稳定的水平,对同一个克隆,有性生殖阈密度是一定的,因此各实验组之间的混交率不会出现较大的差异。本研究中萼花臂尾轮虫种群的混交率在各实验组之间均无显著的差异,与上述推断相符,因此在本实验中展现的同种密度信号的抑制效果的差异不是由有性生殖造成的。
密度信号中含有的某些代谢物质可能会对轮虫产生影响,本实验中萼花臂尾轮虫的密度信号提高了萼花臂尾轮虫的种群增长率r,这与Yoshinaga等[12]利用褶皱臂尾轮虫进行生命表实验得到的研究结果相似,褶皱臂尾轮虫滤液使同种个体的发育时间缩短,初次性成熟年龄提前,初次性成熟时的体型变小,从而使种群增长率提高。本研究虽然是从种群增长角度做的观测,但得到的密度信号使种群增长率提高的结果相似。在水蚤种群中也有类似的发现。水蚤密度信号对幼体生长发育影响显著,大型蚤(Daphniamagna)的生长速率、初次性成熟的体长和产卵量都随着同种滤液密度的升高而增加,透明溞(Daphniahyalina)的体长则呈现出随滤液密度先增加后降低的趋势[28]。本实验中,萼花臂尾轮虫的密度信号使角突臂尾轮虫的种群增长率提高,环境容纳量K降低,所以轮虫的种间竞争除了资源竞争之外,应该还存在化学性干扰的作用。
轮虫的自毒作用(auto toxicity)是指轮虫释放的对自身有毒害作用的化学物质,可以降低个体存活率。Kirk[11]证实了由化学物质诱导的自毒作用对实验室梳状疣毛轮虫(Synchaetapectinata)种群的调节。萼花臂尾轮虫的进食率和同化率均会受自毒作用而降低[29]。类似的自毒物质对实验室种群的抑制效果在水蚤中也有发现,而且所需的密度较低,约40—150 个/L的密度下就有发现[30]。本研究中每天更换培养液可以在一定程度上消除代谢废物的积累,但密度信号滤液经过24 h的预培养可能积累了大量的代谢废物,其中的某些代谢物质的未知化学作用和自毒效果,也可致使种群的死亡率升高[31],这可能是造成各实验组之间种群增长差异的主要原因。
不同的物种自毒作用的表现程度不一样,水蚤种群对密度信号非常敏感,大于85 个/L的水蚤滤液对小体型的水蚤(成年体长<1.8 mm)有抑制个体增长速率、使体型变小和尾棘刺变短的效果,但体型较大的水蚤没有明显的受到抑制[6],说明这种抑制效果与体型有关。在轮虫的相关研究中,梳状疣毛轮虫在100 个/mL的密度时就观察到自毒作用对种群增长的抑制效果[11],而圆形臂尾轮虫(Brachionusrotundiformis)(体长约120 μm)在很高的密度(865 个/mL)下也没有表现出对同种种群的抑制[32]。萼花臂尾轮虫(体长约220 μm)自毒作用对种群的容纳量K影响显著,而角突臂尾轮虫(体长110—150 μm)种群K值在100 个/mL时所受自毒作用的影响也不显著。根据臂尾轮虫的体型推断,轮虫受自毒作用的抑制也可能与轮虫的体型有关系,自毒作用的强度随着轮虫体型的减小而降低。萼花臂尾轮虫密度信号对角突臂尾轮虫种群增长有抑制效果,角突臂尾轮虫密度信号对萼花臂尾轮虫种群无抑制效果,这有可能是由于角突臂尾轮虫的密度信号中含有的对轮虫种群产生抑制效果的代谢物质较少,而萼花臂尾轮虫产生的能够抑制轮虫种群的代谢物质较多,但这个假说目前还缺乏实证。
综合上述讨论可以看出,造成密度信号对萼花臂尾轮虫种群增长影响的主要因素是代谢产物的自毒作用,密度信号诱导的有性生殖对低有性生殖阈密度克隆的种群增长影响不明显。而体型较小的角突臂尾轮虫几乎不受自毒作用的影响,这也是为何种群培养角突臂尾轮虫可以用较小的培养体积,但萼花臂尾轮虫必须用更大的培养体积的原因之一。此外体型较小的角突臂尾轮虫食物浓度阈值更低,能更有效的利用低浓度的食物,因此在与萼花臂尾轮虫的竞争中会在后期的资源竞争中取得优势[13]。在竞争的早期,食物对两种轮虫都是足够的,不存在资源竞争的影响或其影响很小,而密度信号使种群快速增长,食物快速被消耗,从而使萼花臂尾轮虫更早的面对资源竞争,更快的被角突臂尾轮虫所排除。这可能是竞争早期的一种机制。而在高密度种群的时候,除食物资源的限制外,萼花臂尾轮虫受自身密度信号的抑制使其在竞争中更加处于劣势。但是在自然水体中还有捕食者的存在,体型较小的轮虫会受到更大的捕食压力,但是其快速的种群增长能力有可能使其实现在捕食者介导下与体型较大的萼花臂尾轮虫的共存[20]。因此,可以推断,在轮虫的竞争中,决定竞争结果的不仅仅是资源竞争,密度信号的作用差异也对竞争结果有非常重要的影响。
致谢:感谢殷旭旺副教授对本文写作的帮助。
:
[1] Snell T W. Review paper: Chemical ecology of rotifers // Rotifera VIII: A Comparative Approach. Netherlands:Springer,1998:267- 276.
[2] Brönmark C,Hansson L A.Chemical Ecology in Aquatic Systems. Oxford: Oxford University Press, 2012.
[3] Gilbert J J.Asplanchnaand posterolateral spine production inBrachionuscalyciflorus.Archiv fürHydrobiologie, 1967,64(1): 1- 62.
[4] Sarma S S S, Resendiz R A L, Nandini S.Morphometric and demographic responses of brachionid prey (BrachionuscalyciflorusPallas andPlationusmacracanthus(Daday)) in the presence of different densities of the predatorAsplanchnabrightwellii(Rotifera: Asplanchnidae).Hydrobiologia, 2011,662(1): 179- 187.
[5] Gilbert J J. Induction of different defences by two enemies in the rotiferKeratellatropica: response priority and sensitivity to enemy density.Freshwater Biology, 2011,56(5): 926- 938.
[6] Burns C W. Crowding-induced changes in growth, reproduction and morphology ofDaphnia.Freshwater Biology, 2000,43(1): 19- 29.
[7] Conde-Porcuna J M. Chemical interference byDaphniaonKeratella: a life table experiment.Journal of Plankton Research, 1998,20(8): 1637- 1644.
[8] Folt C,Goldman C R.Allelopathy between zooplankton: a mechanism for interference competition.Science, 1981,213(4512): 1133- 1135.
[9] Gilbert J J. Population density, sexual reproduction and diapause in monogonont rotifers: new data forBrachionusand a review.Journal of Limnology, 2004,63(S1): 32- 36.
[10] Gilbert J J. Contact chemoreception, mating behaviour, and sexual isolation in the rotifer genusBrachionus.Journal of Experimental Biology, 1963,40(4): 625- 641.
[11] Kirk K L. Enrichment can stabilize population dynamics: Autotoxins and density dependence.Ecology, 1998,79(7): 2456- 2462.
[12] Yoshinaga T, Hagiwara A, Tsukamoto K.Effect of conditioned media on the asexual reproduction of the monogonont rotiferBrachionusplicatilisO.F. Müller.Hydrobiologia, 1999,412: 103- 110.
[13] StembergerRS,Gilbert J J.Body size, food concentration, and population growth in planktonic rotifers.Ecology, 1985, 66(4): 1151- 1159.
[14] Tilman D. Resource Competition and Community Structure. (MPB- 17). Vol.17.Princeton: Princeton University Press, 1982.
[15] Fernández-AraizaM, Sarma S S S, Nandini S.Combined effects of food concentration and temperature on competition among four species ofBrachionus(Rotifera).Rotifera X, 2005, 181: 519- 534.
[16] Kumar R,Rao T R.Effect of the cyclopoid copepodMesocyclopsthermocyclopoideson the interactions between the predatory rotiferAsplanchnaintermediaand its preyBrachionuscalyciflorusandB.angularis.Hydrobiologia, 2001,453(1/3): 261- 268.
[17] Sarma S, Araiza M A F, Nandini S.Competition betweenBrachionuscalyciflorusPallas andBrachionuspatulus(Müller)(Rotifera) in relation to algal food concentration and initial population density.Aquatic Ecology, 1999,33(4): 339- 345.
[18] Stemberger R S. A general approach to the culture of planktonic rotifers.Canadian Journal of Fisheries and Aquatic Sciences, 1981,38(6): 721- 724.
[19] Aránguiz-Acua A, Ramos-Jiliberto R, Sarma N, Sarma S S S, Bustamante R O, Toledo V.Benefits, costs and reactivity of inducible defences: an experimental test with rotifers.Freshwater Biology, 2010,55(10): 2114- 2122.
[20] Yin X W,Niu C J.Predatory rotiferAsplanchnabrightwelliimediated competition outcome betweenBrachionuscalyciflorusandBrachionuspatulus(Rotifera).Hydrobiologia, 2008,610(1): 131- 138.
[21] Ciros-Pérez J, Carmona M, Serra M.Resource competition and patterns of sexual reproduction in sympatric sibling rotifer species.Oecologia, 2002,131(1): 35- 42.
[22] Stelzer C P. Population regulation in sexual and asexual rotifers: an eco-evolutionary feedback to population size? Functional Ecology, 2012,26(1): 180- 188.
[23] Schröder T. Diapause in monogonont rotifers.Hydrobiologia, 2005,546(1): 291- 306.
[24] Stelzer C P,Snell T W.Specificity of the crowding response in theBrachionusplicatilisspecies complex.Limnology and Oceanography, 2006, 51(1): 125- 130.
[25] Gilbert J J. Mictic female production in the rotiferBrachionuscalyciflorus.Journal of Experimental Zoology, 1963,153(2): 113- 123.
[26] Snell T W. Sex, population dynamics and resting egg production in rotifers.Hydrobiologia, 1987,144(2): 105- 111.
[27] Fussmann G F, Kramer G, Labib M.Incomplete induction of mixis inBrachionuscalyciflorus: patterns of reproduction at the individual level.Hydrobiologia, 2007,593(1): 111- 119.
[28] Burns C W. Effects of crowding and different food levels on growth and reproductive investment ofDaphnia.Oecologia, 1995,101(2): 234- 244.
[29] Verschoor A M, Zadereev Y S, Mooij W M.Infochemical-mediated trophic interactions between the rotiferBrachionuscalyciflorusand its food algae.Limnology and Oceanography, 2007,52(5): 2109- 2119.
[30] Goser B,Ratte H T.Experimental evidence of negative interference inDaphniamagna.Oecologia, 1994,98(3): 354- 361.
[31] Yoshinaga T, Hagiwara A, Tsukamoto K.Why do rotifer populations present a typical sigmoid growth curve? Hydrobiologia, 2001,446- 447(1): 99- 105.
[32] Snell T W, Dingmann B J, Serra M.Density-dependent regulation of natural and laboratory rotifer populations.Hydrobiologia, 2001,446- 447(1): 39- 44.

