GDNF基因诱导大鼠骨髓间充质干细胞促周围神经再生的实验研究
尚修超,顾加祥,张乃臣,刘宏君,田 恒,潘俊博
(1.扬州大学医学院,江苏 扬州225001;2.扬州大学临床医学院 江苏 扬州225001)
周围神经损伤是临床常见病症,损伤后如不进行及时有效的修复,损伤神经支配区肌肉必将萎缩,造成神经肌肉功能障碍,给后续康复带来不利的影响[1]。胶质细胞源性神经营养因子(glial cell linederived neurotrophic factor,GDNF),是一种有效的神经营养因子,对神经系统神经元的分化、发育、生长和存活具有重要作用[2]。BMSCs经GDNF基因诱导后可分化为神经细胞,在周围神经损伤模型中可显著促进损伤神经再生。
1 材料与方法
1.1 实验动物与试剂
SD大鼠均由扬州大学医学院动物房提供,DAPI福建迈新,HPIAS-1000彩色病理图文分析系统,电子天平,冰冻切片机,扫描电镜,
1.2 建立大鼠坐骨神经损伤模型
大鼠均用10%水合氯醛腹腔注射麻醉,俯卧位固定。碘伏消毒皮肤,作左大腿切口,约3cm,钝性分离皮下,沿股后外侧肌间隙钝性分离到腘窝上缘显露坐骨神经约20mm,轻轻游离,于坐骨神经梨状肌下缘5mm持针器咬合三齿十次,将坐骨神经夹伤达透明薄纸状,8-0普里林显微缝线标记坐骨神经夹伤两端,大鼠左下肢反应迟钝,屈伸力量大大减弱,达到造模目的。术后分笼饲养,每日肌注适量抗生素。
1.3 坐骨神经功能指数(SFI)与腓肠肌湿质量恢复率
术后4周、8周观察以下指标:①选择印迹清晰的足印分别测量正常足和伤足三个指标:足迹长度(PL):足尖到足跟的最大距离;足趾宽度(TS):第1-5趾的距离;中间足趾宽度(TT):第2-4趾的距离。②坐骨神经指数(SFI)=-38.3[(EPLNPL)/NPL]+109.5[(ETS-NTS)/NTS]]+13.3[(EIT-NIT)/NIT]-8.8。其中坐骨神经指数值为0~-11%表示神经功能完全正常,-100%表示神经功能完全丧失,-11%~-100%表示部分神经功能恢复。③腓肠肌湿质量恢复率(%)=手术侧腓肠肌湿质量/对侧正常腓肠肌湿质量×100%。
1.4 BMSCs的分离、培养与鉴定
将大鼠置于75%的酒精中消毒5min。无菌条件下取出双侧胫骨和股骨,并剪去两端,用5ml注射器抽取DMEN培养基5ml反复冲洗骨髓腔,将冲洗液缓慢置于离心管中,2 500r/min离心20 min,收集中间单层细胞,PBS冲洗2次,应用含10%胎牛血清的DMEM培养基3ml重新悬浮细胞,接种于6孔板内,置于室温、5%CO2、饱和湿度下常规培养。24h后更换新培养液去除非贴壁细胞,以后每隔3d换液一次。当1012d时,细胞生长融合达培养板孔90% ,用0.25%胰蛋白酶消化传代,3-4d传代一次。镜下观察细胞生长情况。
BMSCs经三代体外传代培养后,接种在无菌的6孔培养板中,达到80%融合时进行BMSCs向神经细胞分化的诱导实验。细胞换液后行载GDNF基因的脂质体转染,继续培养两周,于室温、5%CO2、饱和湿度培育箱内孵育,每3d全量换液一次,连续培养。
1.5 BMSCs注入大鼠损伤再生室模型
微量注射器将等量浓缩细胞打入坐骨神经再生室模型。对照组:未经诱导的BMSCs;实验组:GDNF基因诱导后的BMSCs。微量注射器注入完成后,将切口缝合,继续饲养8周。
1.6 腓肠肌冰冻切片DAPI染色
每组大鼠腓肠肌组织做一套切片,切好的组织粘附于防脱片上,晾干,DAPI染色10min,晾干后,中性树脂封片,镜下观察切片结果。
1.7 坐骨神经再生神经纤维分析
坐骨神经行Marsland和LFB染色,黑色的轴突和蓝色的髓鞘在病理图文自动分析系统放大600倍下测量各组坐骨神经损伤段再生有髓神经纤维的数目、轴突直径和再生髓鞘厚度结果。
1.8 坐骨神经切面扫描电镜观察
术后8周取各组坐骨神经于损伤标记8-0普里林边缘切下,2.5%戊二醛固定,用PBS浸洗2次,每次10min,再用4℃预冷的1% 锇酸。在4℃固定1h,然后用PBS浸洗2次,每次10min。系列梯度酒精(50%、70% 、80%、90%、100%)脱水,每种浓度酒精通过2次,每次15min。乙酸戊酯:乙醇为1∶1中通过一次30min,纯戊酯通过30min,CO2临界点干燥,粘样喷金上镜观察。
1.9 统计分析
SFI和腓肠肌湿质量恢复率结果采用方差分析,统计软件采用SPSS15.0。
2 结果
2.1 腓肠肌湿质量恢复率和SFI检测
术后4和8周分别测量每组的SFI和腓肠肌湿重恢复率,结果如下。
表1 术后各组大鼠腓肠肌湿重恢复率比较(±s,n=10,%)
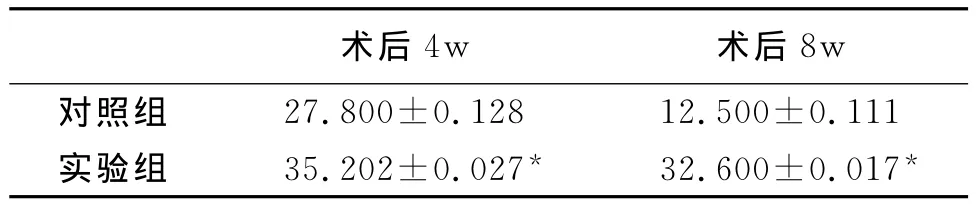
表1 术后各组大鼠腓肠肌湿重恢复率比较(±s,n=10,%)
*P0.01, 。
8w对照组术后4w 术后27.800±0.128 12.500±0.111实验组 35.202±0.027* 32.600±0.017*
表2 术后各组大鼠坐骨神经指数(SFI)比较(±s,n=10,%)
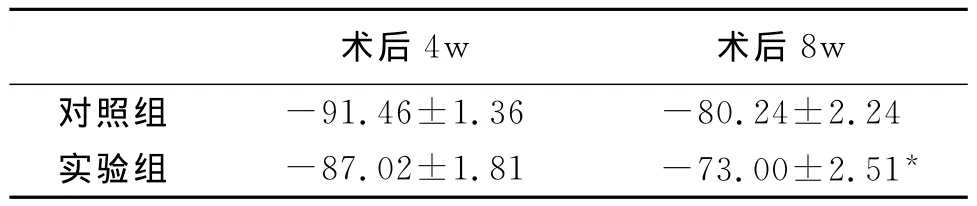
表2 术后各组大鼠坐骨神经指数(SFI)比较(±s,n=10,%)
*P<0.01,有显著差异。
8w对照组术后4w 术后-91.46±1.36 -80.24±2.24实验组 -87.02±1.81 -73.00±2.51*
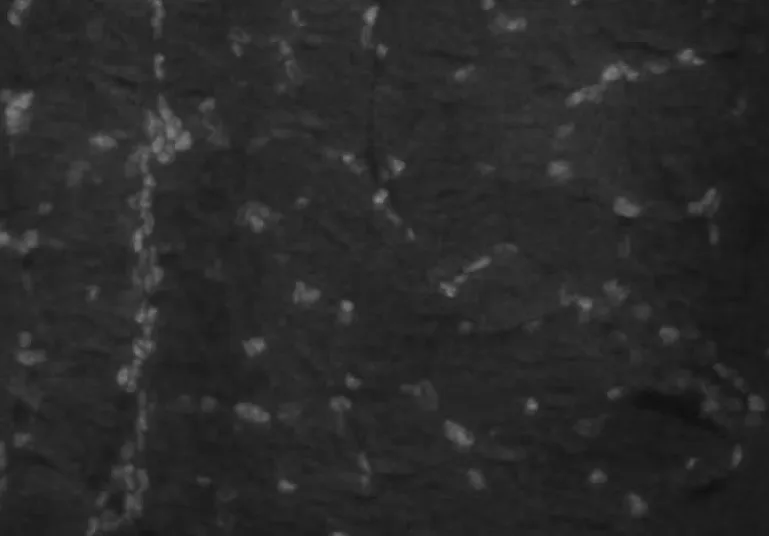
图1 腓肠肌冰冻切片DAPI染色结果(实验组)
通过表1可以看出,实验组可显著延缓大鼠腓肠肌湿质量减少速度,其恢复率情况明显优于对照组,差异有显著性意义(P<0.01)。由表2可知,术后4周四组大鼠SFI恢复情况无明显差异,但术后8周,实验组的SFI恢复情况明显优于对照组,差异有显著性意义(P<0.01)。
2.2 腓肠肌冰冻切片DAPI染色结果
400倍镜下观察可见实验组(图1)较未诱导对照组(图2)细胞核更多,而对照组腓肠肌萎缩明显。

图2 腓肠肌冰冻切片DAPI染色结果(对照组)
2.3 坐骨神经再生神经纤维分析结果
GDNF基因诱导组与未诱导对照组相比,GDNF基因诱导组再生神经纤维计数、轴突直径和髓鞘厚度大于未诱导对照组(见表3),差异有显著性意义(P<0.01)。
表3 再生神经纤维病理图像分析(±s)

表3 再生神经纤维病理图像分析(±s)
*P<0.01
组别 轴突直径(μm) 髓鞘厚度(μ㎡) 有髓神经纤维计数(根)2.14±0.15 0.99±0.12 65.54±5.01实验组 3.21±0.08* 1.63±0.11* 86.54±5.50对照组*
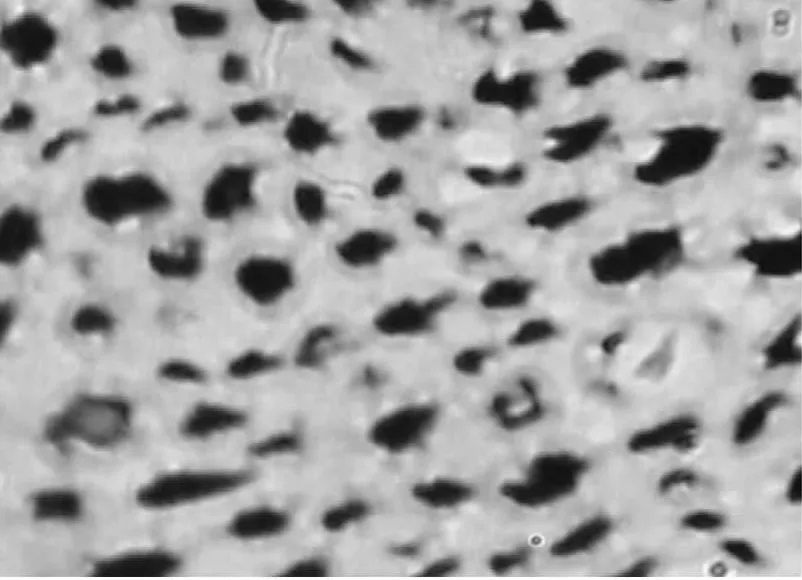
图3 坐骨神经再生神经纤维分析结果(实验组)
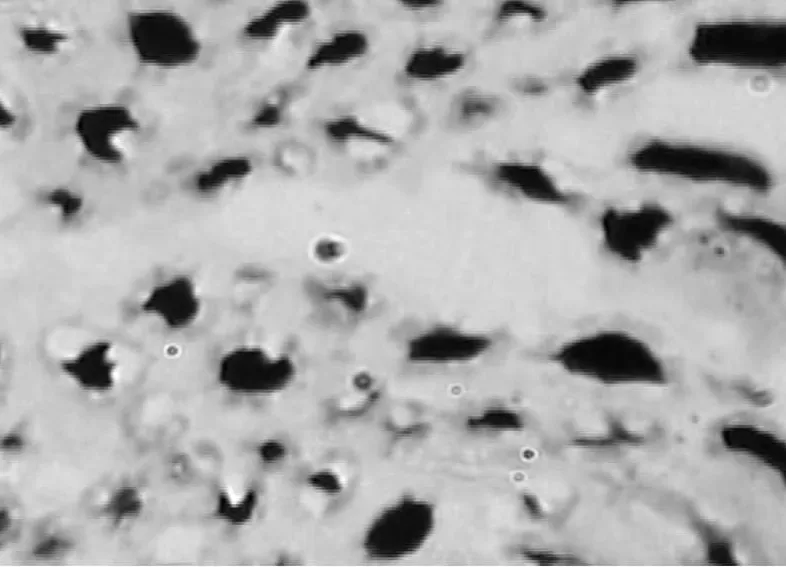
图4 坐骨神经再生神经纤维分析结果(对照组)
实验组(图3)神经纤维数、轴突直径和髓鞘厚度明显大于对照组(图4),且排列更加整齐。
2.4 坐骨神经切面扫描电镜观察结果
扫描电镜下观察实验组(图5)可见明显高放电神经丝交联,比对照组(图6)神经再生更加明显。
3 讨论
胶质细胞源性神经营养因子(glial cell line-derivedneurot rophic factor,GDNF),对多巴胺能神经元、运动神经元等多种神经元均具有促存活及损伤保护作用,对感觉神经元有营养作用,因此其可应用于神经损伤和神经退行性疾病的治疗[4-7]。

图5 坐骨神经切面扫描电镜观察结果(实验组)

图6 坐骨神经切面扫描电镜观察结果(对照组)
通过DAPI染色,GDNF基因诱导组较未诱导对照组细胞核更多,并且未诱导对照组腓肠肌萎缩更加明显。在坐骨神经再生神经纤维分析中,GDNF基因诱导组坐骨神经损伤段再生有髓神经纤维的数目、轴突直径和再生髓鞘厚度明显增加,并且排列比较整齐。扫描电子显微镜下,GDNF基因诱导组有明显高放电神经丝交联,神经再生更加明显。GDNF基因诱导组可显著延缓大鼠腓肠肌湿质量减少速度。术后8周,GDNF基因诱导组的SFI恢复情况明显优于对照组。由上述结果可知,经GDNF基因诱导BMSCs组各方面检测指标均较对照组为好,其中诱导后实验组扫描电镜下观察周围神经再生更加明显。因此,GDNF基因诱导的间充干细胞对周围神经再生有着显著的疗效。
DAPI是一种能够与DNA强力结合的荧光染料,它能粘附在DNA双螺旋的小沟区。DAPI作为一种能与DNA分子特异结合的荧光染料,无明显细胞毒性,可穿透活细胞胞膜,所以它可用于活细胞和固定细胞的染色。DAPI标记细胞由于操作简便,被标记细胞的生命活动无明显影响,可直接观察,费用低廉,因此得到广泛使用。DAPI未导致细胞死亡和没有破坏细胞骨架结构有关。细胞的弹性模量的变化受各种生理、病理以及外界物理、化学、生物等因子刺激的影响,其中细胞骨架结构动力学变化以及骨架重排对细胞弹性影响最显著。DAPI穿透活细胞膜与DNA特异结合没有影响细胞的骨架结构,所以DAPI染色对细胞的弹性模量没有影响,同时可通过DAPI的染色初步区分出细胞核大小。因此,本实验可见GDNF基因诱导组较未诱导对照组细胞核更多,明显可见未诱导对照组腓肠肌萎缩明显。
骨髓间充质干细胞(bone marrow derivedmesenchymal stem cells,BMSCs),是来源于骨髓的单胚层多能干细胞,能自我增殖。因其取材容易,能迅速体外培育和增殖,同时具有多向分化潜能,并且避免了伦理方面的冲突。因此,其在组织工程、细胞移植和基因治疗方面有十分广阔的前景[8-16]。
然而,BMSCs向神经细胞的诱导分化过程中仍有一些不足之处[17-26]:①没有BMSCs的特异性标记分子,而且没有标准的分离纯化、培养扩增和鉴定的方法;②BMSCs可跨胚层分化为神经元样细胞,有望成为神经细胞替代治疗的种子细胞,但诱导后的细胞是否具有神经细胞的生理功能尚待进一步研究;③BMSCs分化为神经细胞仍处在实验研究阶段。
同时,在后续实验中我们应对BMSCs诱导分化后的神经细胞内是否含有神经递质进行检测:①该物质是否存在于轴突末梢内;②神经兴奋时该物质是否能释放至突触间隙,并且作用于突触后膜上的特异性受体;③神经元中是否有合成该物质的前体和中间物,是否有合成酶和分解酶;④神经末梢内是否有对该物质迅速灭活的机制系统;⑤该物质作用于突触后膜时是否能模拟神经生理效应。
[1]Raheja Amol,Suri Vaishali,Suri Ashish.Dose-dependent facilitation of peripheral nerve regeneration by bone marrow-derived mononuclear cells:a randomized controlled study[J].Neurosurg,2012,117(6):1170.
[2]刘 卓,徐 运,黄丹青.骨髓间充质干细胞向多巴胺能神经元的诱导分化[J].中国组织工程研究与临床康复,2010,14(23):4227.
[3]Basso DM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats[J].Neurotrauma,1995,12(1):1.
[4]Xu Pin,Rosen Kenneth M,Hedstrom Kristian.Nerve injury induces glial cell line-derived neurotrophic factor(gdnf)expression in schwann cells through purinergic signaling and the pkc-pkd pathway[J].Glia,2013,61(7):1029.
[5]Decressac Mickael,Kadkhodaei Banafsheh,Mattsson Bengt.α-Synuclein-Induced Down-Regulation of Nurr1Disrupts GDNF Signaling in Nigral Dopamine Neurons[J].Sci Transl Med,2012,4(163):156.
[6]Yoo YMi,Lee CJg,Kim YJg.Exogenous GDNF increase the migration of the neural stem cells with no protection against kainic acid-induced excitotoxic cell death in rats[J].Brain Res,2012,1486:27.
[7]王俊芳,罗永湘,方 煌.大鼠骨髓间充质干细胞的体外培养及初步鉴定[J].实用手外科杂志,2006,20(3):160.
[8]胡资兵,曾 荣,郭伟韬.骨髓间充质干细胞诱导分化特征[J].中国组织工程研究与临床康复,2008,12(43):8561.
[9]Miura Yasuo,Yoshioka Satoshi,Yao Hisayuki.Chimerism of bone marrow mesenchymal stem/stromal cells in allogeneic hematopoietic cell transplantation:Is it clinically relevant?[J].Chimerism,2013,4(3):48.
[10]Shuai Hongxia,Zhang Ji.Role of stereotaxically injected IgG from db/db mice in the phosphorylation of the microtubule-associated protein tau in hippocampus[J].Brain Res,2012,1486:14.
[11]卓本慧,江和碧,瞿 平.骨髓间充质干细胞向神经细胞定向分化的体外研究[J].中国修复重建外科杂志,2005,19(5):373.
[12]杨乃龙,杨 芬,徐丽丽.共培养法神经细胞诱导骨髓间充质干细胞向神经元的分化[J].中国组织工程研究与临床康复,2008,12(29):5611.
[13]Kwon C,Kovesdi Erzsebet,Gyorgy B.Stress and traumatic brain injury:a behavioral,proteomics,and histological study[J].Front Neurol,2012,2(12):1.
[14]Ciccocioppo Rachele,Bernardo Maria Ester,Sgarella Adele.Autologous bone marrow-derived mesenchymal stromal cells in the treatment of fistulising Crohn's disease[J].Gut,2011,60(6):788.
[15]Su Guan-Hua,Sun Yu-Fei,Lu Yong-Xin.Hepatocyte growth factor gene-modified bone marrow-derived mesenchymal stem cells transplantation promotes angiogenesis in a rat model of hindlimb ischemia[J].J Huazhong Univ Sci Technolog Med Sci,2013,33(4):511.
[16]Hu Weihua,Ye Yaping,Wang Jiang.Bone morphogenetic proteins induce rabbit bone marrow-derived mesenchyme stem cells to differentiate into osteoblasts via BMP signals pathway[J].Artif Cells Nanomed Biotechnol,2013,41(4):249.
[17]Quante Michael,Tu Shui Ping,Tomita Hiroyuki.Bone marrow-derived myofibroblasts contribute to the mesenchymal stem cell niche and promote tumor growth[J].Cancer Cell,2011,19(2):257.
[18]Rosland Gro Vatne,Svendsen Agnete,Torsvik Anja.Long-term cultures of bone marrow-derived human mesenchymal stem cells frequently undergo spontaneous malignant transformation[J].Cancer Res,2009,69(13):5331.
[19]王连仲,王永才,闻 华.干细胞移植治疗脊髓损伤的临床应用现状[J].中国组织工程研究与临床康复,2009,13(36):7193.
[20]Izal Shurah,Aranda Pablo,Sanz-Ramos Patricia.Culture of human bone marrow-derived mesenchymal stem cells on of poly(L-lactic acid)scaffolds:potential application for the tissue engineering of cartilage[J].Knee Surg Sports Traumatol Arthrosc,2013,21(8):1727.
[21]Kim Yang-Soo,Lee Hyo-Jin,Ok Ji-Hoon.Survivorship of implanted bone marrow-derived mesenchymal stem cells in acute rotator cuff tear[J].J Shoulder Elbow Surg,2013,22(8):1037.
[22]Guan Jian,Zhu Zhaohui,Zhao Robert Chunhua.Transplantation of human mesenchymal stem cells loaded on collagen scaffolds for the treatment of traumatic brain injury in rats[J].Biomaterials,2013,34(24):5937.
[23]Wu Bo,Ma Xu,Zhu Damu.Lentiviral delivery of biglycan promotes proliferation and increases osteogenic potential of bone marrow-derived mesenchymal stem cells in vitro[J].J Mol Histol,2013,44(4):423.
[24]Zaminy Arash,Shokrgozar Mohammad Ali,Sadeghi Yousef.Mesenchymal stem cells as an alternative for schwann cells in rat spinal cord injury[J].Iran Biomed J,2013,17(3):113.
[25]Siegel Georg,Kluba Torsten,Hermanutz-Klein Ursula.Phenotype,donor age and gender affect function of human bone marrow-derived mesenchymal stromal cells[J].BMC Med,2013,11(1):146.
[26]Huang Chieh-Cheng,Tsai Hung-Wen,Lee Wen-Yu.A translational approach in using cell sheet fragments of autologous bone marrow-derived mesenchymal stem cells for cellular cardiomyoplasty in a porcine model[J].Biomaterials,2013,34(19):4582.

