Mdivi-1对糖氧剥夺后神经元凋亡蛋白Bax活化、嵌入及细胞色素C释放的影响
崔梅,杨琦,董强
Mdivi-1对糖氧剥夺后神经元凋亡蛋白Bax活化、嵌入及细胞色素C释放的影响
崔梅,杨琦,董强
目的:研究线粒体分裂蛋白抑制剂Mdivi-1对糖氧剥夺(OGD)后神经元凋亡蛋白Bax活化、嵌入及细胞色素C(CytC)释放的影响。方法:体外培养原代皮质神经元并制备OGD模型,采用不同浓度的Mdivi-1干预细胞,MTT测定神经元存活率。之后采用10μmol/LMdivi-1干预细胞,免疫共沉淀或细胞碱处理后测定细胞凋亡蛋白Bax的活化和嵌入情况。抽提线粒体和细胞浆蛋白,Western Blot测定线粒体内CytC释放情况。结果:Mdivi-1可以剂量依赖地改善OGD后神经细胞的存活,10μmol/LMdivi-1干预可以减少凋亡蛋白Bax的激活和嵌入,并且减少CytC的释放。结论:线粒体分裂蛋白抑制剂Mdivi-1在OGD后具有明确的神经保护作用,其机制可能和其抑制细胞凋亡有关。
氧糖剥夺;神经元;线粒体;凋亡蛋白Bax;细胞色素C
dong_qiang@fudan.edu.cn
线粒体功能障碍与诸多神经系统疾病之间有着深入的联系,其中线粒体动力学机制和线粒体分裂融合失衡为众人所关注。目前有研究报导,在众多神经变性疾病和缺血性脑血管病中,线粒体存在动力学障碍和过度分裂的现象。抑制线粒体分裂蛋白Drp1是一种潜在的脑缺血治疗靶点[1-3]。近期的研究表明在体外模型中Drp1的小分子抑制剂Mdivi-1可预防由谷氨酸引起的线粒体片段化、线粒体膜电位崩解和细胞凋亡,进一步在动物实验中发现这种小分子抑制剂可以减轻谷氨酸和缺血损伤引起的毒性和梗死体积,这显示线粒体分裂蛋白Drp1在急性缺血性损伤中扮演重要角色[4]。线粒体在细胞凋亡过程中的核心作用已得到广泛认可。线粒体的融合分裂与细胞凋亡也存在密切关系,在多种细胞凋亡的模型中都发现线粒体的过度分裂。有研究表明,线粒体的过度分裂发生在凋亡早期,大概与凋亡蛋白Bax从细胞浆转位到线粒体同时,早于凋亡因子Caspase的释放。而线粒体分裂蛋白Drp1过度表达可促进线粒体的分裂及细胞色素C(cytochrome C,CytC)的释放,表明Drp1在细胞凋亡过程中发挥重要作用[5,6]。本研究在原代培养的神经元中制备糖氧剥夺(oxygen glucose deprivation,OGD)的细胞模型,采用Drp1的小分子抑制剂Mdivi-1干预细胞,检测Mdivi-1对脑缺血后线粒体凋亡蛋白Bax寡聚、嵌入及线粒体外膜通透性的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 新生SD大鼠购自复旦大学医学院实验动物中心。
1.1.2 主要试剂与仪器 Neurobasal A、DMEM、胎牛血清均购自美国Gibco公司;多聚赖氨酸、MTT试剂盒购自美国Sigma公司;免疫共沉淀试剂盒购自美国Invitrogen公司;蛋白质浓度检测试剂盒、线粒体抽提试剂盒购自美国Pierce公司;抗Bax抗体购自美国M illipore公司;抗Cyt、抗tublin抗体购自美国BD Bioscience公司;抗HSP60抗体购自美国Santa Cruz公司。
1.2 方法
1.2.1 原代神经元的培养 出生24 h内新生鼠置于超净台,用75%酒精消毒皮肤后,断头取脑,放入冰预冷的D-Hanks液中。仔细去除脑膜和血管,分离的皮质收集于装有DMEM高糖培养液的离心管中,用巴氏滴管吹打至细胞分散。制成的细胞悬液于4℃1 000 rpm离心5min,弃上清,沉淀重悬于神经元种植液(DMEM高糖培养基+10%胎牛血清),显微镜下调整细胞密度。根据实验需要,以1×105/L的密度种植于L-多聚赖氨酸(0.1mg/m L)包被的相应培养容器中,放入95%O2/5%CO2混合气体的37℃培养箱进行培养。次日将培养液更换为神经元培养液(neurobasalA+2%B27+0.5mmol/L谷氨酰胺+1%青霉素和链霉素),之后每隔3~4 d换半液,取培养第10天的神经元进行实验。
1.2.2 OGD模型的制备 取原代培养至第10天的神经元,倾尽培养液,更换为预先用 5%CO2、10%H2和 85%N2饱和的DMEM无糖培养基。将细胞置于厌氧培养箱内,通入 5%CO2、10%H2和 85%N2,使箱内氧浓度<1%。培养90min后将培养液更换为神经元培养液,置细胞培养箱培养4 h。
1.2.3 细胞存活率的测定 种植于96孔培养板的神经元随机分为OGD-组和OGD+组。2组神经元分别在正常培养后的 第 9 天 加 入 不 同 浓 度(0、5、10、20μmol/L)的 Mdivi-1干预,第 10天OGD组置缺氧箱90min,再复氧4 h。取出各组神经元,弃去培养液,每孔加入100μL 0.5mg/m L的MTT溶液,于37℃温箱显色4 h,弃上清,加入DMSO充分溶解紫蓝色结晶。以DMSO为空白,酶标仪570 nm处测量各孔吸光度(A)值。按照公式计算神经元存活率:神经元存活率=实验组A值/正常对照组A值×100%。
1.2.4 免疫共沉淀测定活性Bax将神经元以5×105个/cm2的密度种植于培养皿,在培养后的第9天给予Mdivi-1处理,第10天OGD+组置缺氧箱90min,再复氧4 h。各干预组常规收集细胞,PBS清洗2次,PMSF裂解液加 1×protease inhibitor cocktail setⅠ裂解细胞,Bradford法蛋白质定量,用PBS将总蛋白稀释到约1 g/L,加入 1μg抗 Bax(NT)抗体到 500μL总蛋白中,室温下缓慢摇动抗原抗体混合物2 h后,加入100μL蛋白A琼脂糖珠来捕捉抗原抗体复合物。室温缓慢摇动抗原抗体混合物1 h后,收集琼脂糖珠-抗原抗体复合物,去上清,用预冷的裂解液洗3遍,将上样样品煮5m in,以游离抗原、抗体、珠子,离心,将上清按照Western blot的技术介绍进行电泳和转膜,最后加入抗活性Bax抗体进行检测。
1.2.5 细胞碱处理测定Bax的嵌入 神经元以5×105个/cm2的密度种植于培养皿,在培养后的第9天给予Mdivi-1处理,第10天OGD+组置缺氧箱90min,再复氧4 h。分别收集各组细胞,采用0.05%洋地黄皂苷干预细胞,使其释放细胞浆蛋白,其余细胞组分在PBD洗涤后,加入0.1mol/LNa2CO3在pH值11.5的碱性环境下干预30min。在100 000 g下超速离心1 h,收集沉淀,按照Western blot的技术介绍进行电泳和转膜,最后加入抗Bax抗体进行检测。
1.2.6 CytC释放的测定 神经元以5×105个/cm2的密度种植于培养皿,在培养后的第9天给予Mdivi-1处理,第10天OGD+组置缺氧箱90min,再复氧4 h。分别收集各组细胞,采用线粒体抽提试剂盒抽提线粒体。上清液100 000 g超速离心1 h后,再次提取上清液作为细胞浆蛋白Bradford法蛋白质定量。取适量蛋白质,12%SDS-聚丙烯酰胺凝胶电泳中电泳分离(BIO-RAD电泳及转膜装置)2 h,电转膜(100 V,1 h)至硝酸纤维素膜,印迹膜在含有5%封闭蛋白的TBS-T缓冲液中封闭1 h,在CytC tublin或HSP60的一抗溶液(抗体用5%封闭蛋白的TBS-T缓冲液1∶1 000稀释)中4℃孵育过夜,次日加入二抗,ECL化学发光法进行测定。
1.3 统计学处理
每个实验至少重复3次,计量资料以(均数±标准差)表示,组间比较采用one-way ANOVA,P<0.05 为差异有统计学意义。
2 结果
2.1 Mdivi-1可有效减少OGD所导致的神经元死亡
MTT结果表明,OGD可显著降低神经元的存活率,应用线粒体分裂蛋白Drp1抑制剂Mdivi-1可增加OGD后神经元的存活率,与OGD+组相比差异有统计学意义(P<0.05)。并且,Mdivi-1在抑制OGD所导致的神经元死亡方面,具有剂量依赖性,10μmol/L是其最佳干预剂量,见图1。
2.2 Mdivi-1可有效抑制OGD后细胞凋亡蛋白Bax的活化和嵌入
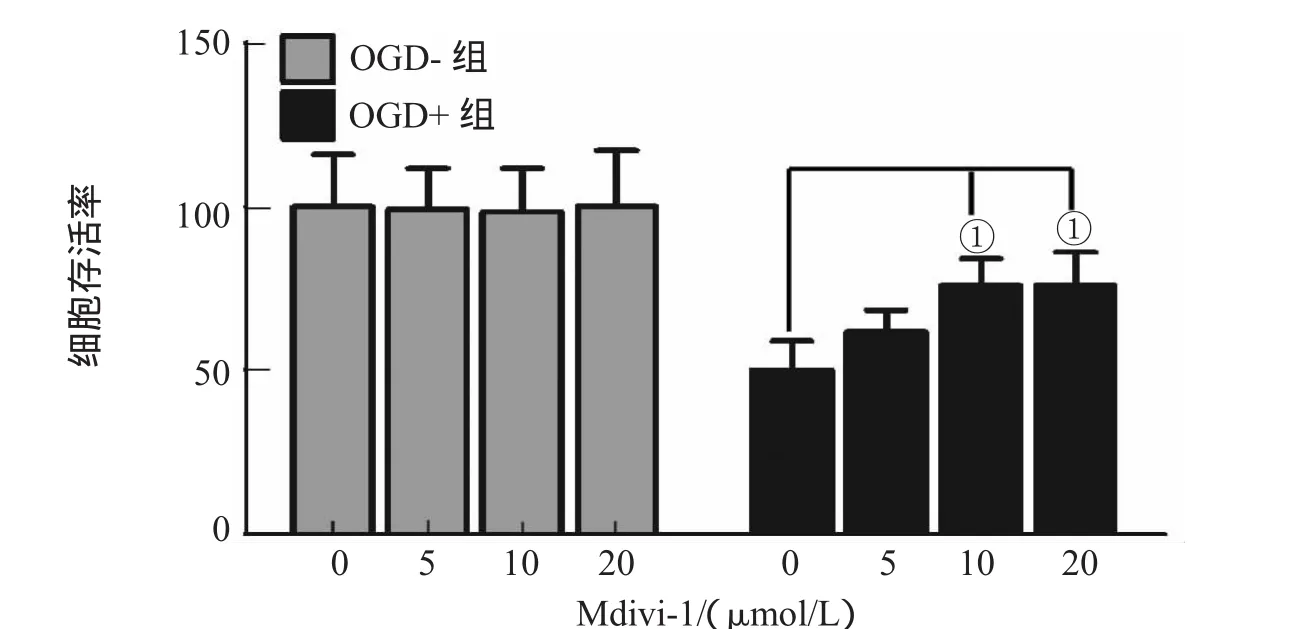
图1 Mdivi-1对OGD后神经元细胞存活率的影响
通过免疫共沉淀技术测定细胞凋亡蛋白Bax的活化提示,在正常培养状态下,神经元内活化的Bax含量极低,难以检测。在OGD干预后,活化Bax的含量显著增加;Mdivi-1干预可明显抑制OGD后细胞凋亡蛋白的活化,与对照相比差异有统计学意义(P<0.05)。细胞碱处理可以将疏松附着在线粒体表面的蛋白剥离并洗脱。在超速离心后,所得的线粒体沉淀可检测到嵌入线粒体的蛋白,Bax的特异性抗体检测嵌入到线粒体的Bax结果显示,在正常培养状态下,神经元内嵌入线粒体的Bax含量较低,在OGD干预后,嵌入线粒体的Bax含量显著增加;Mdivi-1干预可明显减少OGD后细胞凋亡蛋白Bax的嵌入,与对照相比,差异有统计学意义(P<0.05),见图 2。
2.3 Mdivi-1可明显减少OGD后Cyt C的释放
Western Blot分别检测线粒体和细胞浆中的CytC含量,结果显示,在OGD干预后,细胞浆内的CytC含量显著增高,同时伴随着线粒体内的CytC显著下降,这意味着Cyt C从线粒体向细胞浆的释放增多。Mdivi-1干预后,细胞浆内的Cyt C含量明显减少,线粒体内的CytC浓度提高,表明Mdivi-1可显著抑制OGD后CytC的释放过程,见图3。
3 讨论
线粒体分裂蛋白Drp1主要分布于细胞浆内,在细胞受到某些损伤性刺激后,Drp1可由细胞浆向线粒体外膜发生细胞内转位,迁移至线粒体外膜的Drp1可与分布与线粒体外膜的线粒体分裂蛋白hFis发生相互作用,从而诱导线粒体断裂[3,4]。笔者的前期研究结果表明,OGD 可显著诱导神经元内线粒体发生过度断裂,且这一过程和Drp1由细胞浆向线粒体转位密切相关[7]。本研究表明在OGD干预后,神经元内确实存在Drp1由细胞浆向线粒体的转位过程。既往研究表明,在使用星形孢菌素诱导细胞凋亡时,Drp1会从细胞浆转位到线粒体成点状聚集,与Bax共定位于线粒体外膜上,通过siRNA下调Drp1表达可以Bax的移位增加而CytC的释放被抑制[8]。尽管Drp1的表达下调能够抑制线粒体的分裂并部分阻止Cyt C释放,但Estaquier等[9]的研究却发现,Drp1的表达下调不能阻止那些可以引起Caspase激活和随后的细胞凋亡过程的其它辅助因子,如Omi/HtrA2、腺苷酸激酶2等。还有研究发现,当用化学抑制剂Mdivi-1抑制Drp1后,也能够阻止tBid诱导的依赖于Bax/Bak的Cyt C从线粒体释放,而此过程不涉及线粒体分裂[6],暗示Drp1可能的促凋亡作用也许与调节线粒体分裂无关。

图2 Mdivi-1可以有效抑制OGD后细胞凋亡蛋白Bax的活化和嵌入
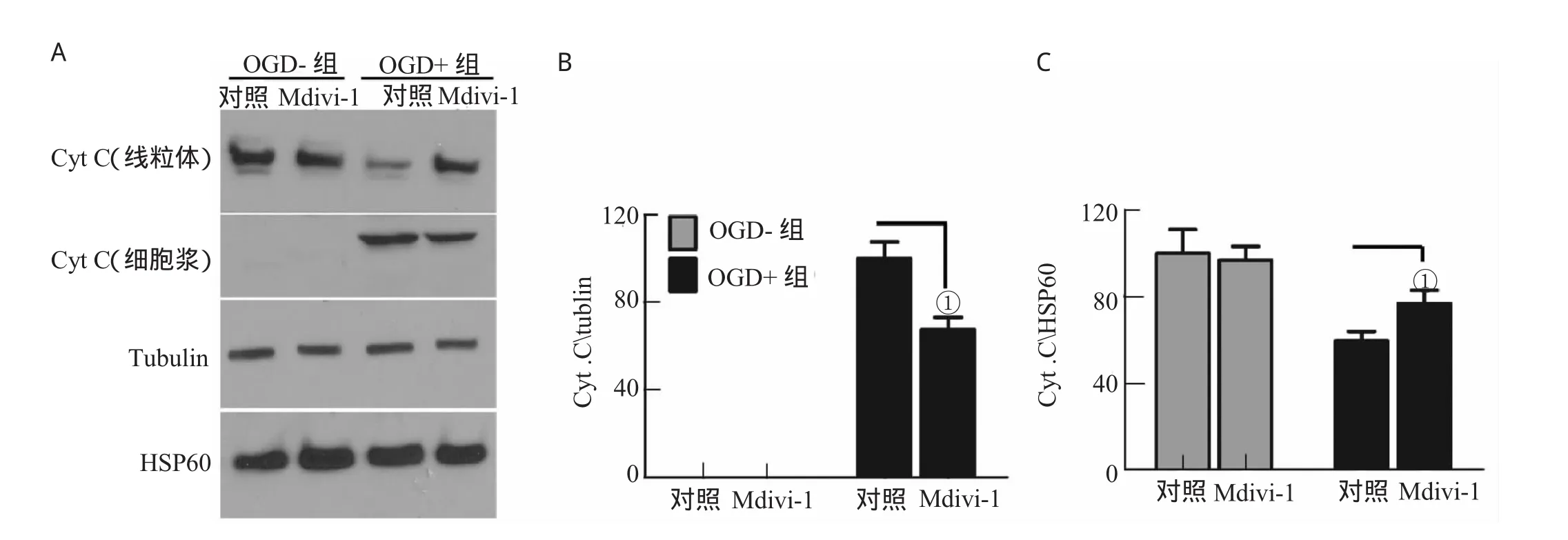
图3 Mdivi-1可明显减少OGD后CytC的释放
细胞凋亡是正常细胞分化、有毒物质致细胞损伤后清除中的重要步骤。在心脑疾病、肿瘤及自身免疫疾病等,组织内细胞凋亡调节存在失衡。近来研究指出,许多引起凋亡的因素可引起Bax和仅有BH3(Bcl-2 homology 3)结构域的 tBid 或Bim等从细胞浆至线粒体转移定位并有线粒体膜电位的改变和磷酸化,从而发生细胞凋亡。Bax平时存在于细胞浆,为无活性的单体结构,细胞发生凋亡时重新分布。在生物或病理因素刺激下,细胞浆Bax构象发生改变,继而从细胞浆向线粒体转位,结合于线粒体膜时则为二聚体或多聚体的活性分子。Bax的寡聚化可能同样是由于其构象改变所致,Bax N端和BH3结构域暴露后可促进其寡聚体的形成。在线粒体外膜上的Bax形成寡聚体,导致线粒体外膜渗透性转运孔打开,线粒体外膜通透性增高。存在于线粒体间隙的Cyt C等物质释放,从而导致细胞凋亡[10,11]。
Mdivi-1是一种脂溶性物质,有文献表明其可以迅速渗透入细胞膜,且可以透过血脑屏障。在神经系统变性疾病中,Mdivi-1可通过抑制线粒体分裂蛋白Drp1的GTP酶活性,抑制线粒体的过度断裂功能。在帕金森病模型中,Mdivi-1干预可显著减少细胞死亡,重建多巴胺能神经元内线粒体分裂/融合的平衡,并改善线粒体的功能[12]。本研究结果提示,Mdivi-1可显著减少OGD所诱导的神经元死亡,其机制可能为抑制线粒体分裂蛋白Drp1分裂蛋白的GTP酶活性,继而干预Drp1和细胞凋亡蛋白的Bax的相互作用,从而使Bax从细胞浆至线粒体的转位和嵌入明显减少,Bax活化障碍。因此在OGD处理后,采用Mdivi-1干预,可显著降低细胞内线粒体外膜的通透性,从而使细胞凋亡前体蛋白Cyt C的释放显著减少。
综上所述,在OGD后抑制Drp1不仅可改善线粒体的形态,重建线粒体动态平衡,而且可有效干预细胞凋亡,使细胞凋亡前体蛋白释放减少。对Drp1的有效干预,可能会成为未来治疗缺血性脑血管病的一个重要靶点。
[1]Chan DC. Mitochondria: dynamic organelles in disease,aging,and development[J].Cell,2006,125:1241-1252.
[2]Jezek P,Plecita-Hlavata L.Mitochondrial reticulum network dynamics in relation to oxidative stress,redox regulation,and hypoxia[J].Int J Biochem Cell Biol,2009,41:1790-1804.
[3]Lackner LL,Nunnari JM.The molecular mechanism and cellular functions of mitochondrial division [J].Biochim Biophys Acta,2009,1792:1138-1144.
[4]Grohm J,Kim SW,Mam rak U.Inhibition of Drp1 provides neuroprotection in vitro and in vivo[J].CellDeath Differ,2012,19:1446-1458.
[5]Montessuit S,Somasekharan SP,Terrones O.Membrane remodeling induced by the dynamin-related protein Drp1 stimulates Bax oligomerization[J].Cell,2010,142:889-901.
[6]Cassidy-Stone A,Chipuk JE,Ingerman E.Chemical inhibition of themitochondrialdivision dynam in reveals its role in Bax/Bak-dependent Mitochondrial outer membrane permeabilization[J].Dev Cell,2008,14:193-204.
[7]Zhao Y,Chen F,Chen S.The Parkinson's disease-associated gene PINK1 protects neurons from ischemic damage by decreasing Mitochondrial translocation of the fission promoter Drp1[J].J Neurochem,2013,127:711-722.
[8]Cereghetti GM,Costa V,Scorrano L.Inhibition of Drp1-dependent Mitochondrial fragmentation and apoptosis by a polypeptide antagonist of calcineurin[J].Cell Death Differ,2010,17:1785-1794.
[9]Estaquier J, Arnoult D. Inhibiting Drp1-mediated Mitochondrial fission selectively prevents the release of cytochrome c during apoptosis [J].Cell Death Differ,2007,14:1086-1094.
[10]Deckwerth TL,Elliott JL,Knudson CM.BAX is required for neuronal death after trophic factor deprivation and during development[J].Neuron,1996,17:401-411.
[11]Desagher S,Osen-Sand A,Nichols A.Bid-induced conformational change of Bax is responsible for Mitochondrial cytochrome c release during apoptosis[J].JCell Biol,1999,144:891-901.
[12]Cui M, Tang X, Christian WV.Perturbations inMitochondrial dynamics induced by human mutant PINK1 can be rescued by the Mitochondrial division inhibitor mdivi-1[J].J BiolChem,2010,285:11740-11752.
M d ivi-1 M ed iates Apop totic Protein Bax Insertion Activation and Cytoch rom e C Release on
Oxygen and Glucose Dep rived Cortical Neu rons
CUIMei,YANG Qi,DONG Qiang.Department of Neurology,Huashan Hospital,Fudan University,Shanghai200040
Objective:To study the effectofmitochondrial fission protein inhibitorMdivi-1 on apoptotic protein Bax activation insertion and cytochrome C release of oxygen and glucose deprived cortical neurons.Methods:Primary cultured cortical neuronswere treated with different doses of Mdivi-1 after oxygen-glucose deprivation procedure.MTT was used to evaluate the cell viability.A fter OGD treatment the neurons were treated with 10μmol/L Mdivi-1,co-immunoprecipitation or alkali treatment were used to determine Bax activation and insertion.Mitochondrial and cytosolic fraction proteins were extracted,Western Blot was used to detect the cytochrome C release.Results:Mdivi-1 significantly improved cellviability in a dose-dependentmanner.Mdivi-1 blocked apoptotic protein Bax insertion and activation and subsequent cytochrome C release induced by OGD.Conclusion:Mitochondrial fission protein inhibitor Mdivi-1 has a neuroprotective effect on neurons after OGD,probablymediated by anti-apoptotic effects.
oxygen glucosedeprivation;neurons;mitochondria;apoptotic protein Bax;cytochrome C
R741;R741.02
A
DOI10.3870/sjsscj.2014.03.001
复旦大学附属华山医院神经内科 上海200040
国家自然科学基金(No.81000487,81171 023); 上海市科委课题 (No.11QA1400900)
2014-01 -01
董强

