测试条件对Ni催化剂的金属分散度的影响
满 毅,黄文氢
(中国石化 北京化工研究院,北京 100013)
测试条件对Ni催化剂的金属分散度的影响
满 毅,黄文氢
(中国石化 北京化工研究院,北京 100013)
采用静态H2化学吸附法在选定压力下测定了不同测试条件下的Ni催化剂的金属分散度,通过H2-TPR实验研究了Ni催化剂中Ni的氧化态,考察了还原温度、还原时间、抽真空时间和吸附温度对Ni催化剂的金属分散度的影响。H2-TPR实验结果表明,Ni催化剂中含有两种氧化态Ni,分别在300,800 ℃下可被还原。静态H2化学吸附法的实验结果表明,高还原温度和长还原时间会使Ni金属发生高温烧结;长时间抽真空可去除还原过程中残留在体系内和Ni金属表面物理吸附的H2;H2在Ni金属上的化学吸附不需经过高温活化即可发生。测试Ni催化剂的金属分散度的适宜条件为:还原温度650 ℃,还原时间1 h,抽真空时间大于16 h,吸附温度50 ℃。在此条件下,Ni催化剂的金属分散度为5.46%。
镍催化剂;金属分散度;化学吸附;测试
Ni催化剂是一种重要的工业催化剂,广泛应用于化工生产。金属分散度是催化剂重要的表面性质之一,Ni催化剂的金属分散度是其表面活性Ni金属原子数与催化剂上总Ni金属原子数之比。测定金属分散度常用的方法是化学吸附法[1]。20世纪人们就开始采用各种方法[2-4]测定负载型催化剂的金属分散度,并对不同测试方法进行了比较[5-6],研究了吸附的探针分子与金属的对应关系[7],比较了不同吸附质的性质[8],不同类型金属负载催化剂的测试条件不同[9-13],但有关测试条件对金属分散度的影响未见报道。
采用化学吸附法测定金属分散度,通常先要在一定温度下用H2还原试样,然后用惰性气体吹扫或抽真空去除体系中的H2及物理吸附的H2,最后在一定温度下进行吸附测定,测试条件显著影响吸附效果,从而影响金属分散度。
本工作通过H2-TPR实验研究了Ni催化剂中Ni的氧化态,并采用静态H2化学吸附法测定了不同条件下Ni催化剂的金属分散度,考察了还原温度、还原时间、抽真空时间、吸附温度等测试条件对Ni催化剂的金属分散度的影响。
1 实验部分
1.1 试样和仪器
Ni催化剂(Ni含量20%(w),载体为Al2O3):中国石化北京化工研究院。
ASAP2020M+C型全自动物化吸附分析仪和Autochem 2920型全自动化学吸附仪:美国Micromeritics公司。
1.2 实验条件
H2-TPR实验:准确称取一定量试样,通入体积组成为10%H2-90%Ar的混合气,吹扫10 min,待基线稳定后开始计数,以10 ℃/min的速率升至某一温度。
静态H2化学吸附法:准确称取0.5 g试样,对试样进行抽真空处理后升温至某一定值,连续通入H2,还原一定时间后,对试样进行抽真空处理,然后温度降至某一定值,在一定压力范围内,测定H2的吸附等温线,然后再抽真空,重复测定H2的吸附等温线。根据测得的H2吸附量与相对压力的关系,通过差值法计算H2的化学吸附量,再计算Ni的分散度。
2 结果与讨论
2.1 H2-TPR实验结果
金属Ni化学性质比较活泼,在催化剂中Ni通常以氧化态的形式保存和运输,所以在测定金属分散度前,先要对氧化态Ni进行还原。根据文献[14]的报道,高温下,即使H2气氛下,金属也能发生烧结,分散度降低。Agostini等[15]认为在H2氛围下升温会毒化金属表面,从而降低金属分散度。因此,选择合适的还原温度对于准确测定金属分散度非常重要。为考察还原温度的影响,首先对Ni催化剂进行H2-TPR表征。
图1是Ni催化剂的H2-TPR曲线。由图1可见,Ni催化剂有2个还原峰,还原温度分别为192,708℃。这表明Ni催化剂中含有两种氧化态Ni,一种是易还原的氧化态Ni,在300 ℃以下即可还原,另一种氧化态Ni需在800 ℃时才能被还原。
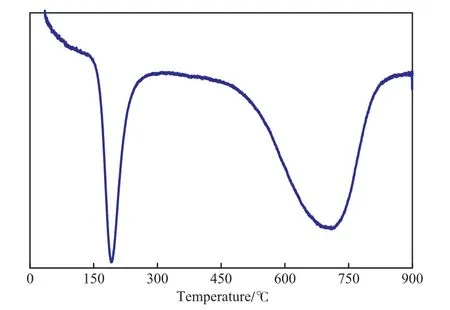
图1 Ni催化剂的H2-TPR曲线Fig.1 H2-TPR curve of Ni catalyst.
由图1还可见,选择450 ℃及更低的还原温度只能将第一种形态的氧化态Ni还原,另一种Ni还是以氧化态形式存在,因此探针分子进行吸附时,只能吸附在第一种形态的Ni上,另一种形式的氧化态Ni不会发生探针分子吸附。但选择800 ℃以上的还原温度则可将两种形式的氧化态Ni还原,但高温还原会发生高温烧结,对金属分散度有影响。
2.2 静态H2化学吸附法压力的选择
静态H2化学吸附法是通过差值法来测定H2的化学吸附量,其原理是用H2作为探针分子,在不同压力下进行吸附,测量H2的吸附量,此时H2的吸附量包括吸附在材料表面的物理吸附的H2、化学吸附的H2以及可能吸附在载体表面的溢流氢,然后对试样进行抽真空处理,将材料表面物理吸附的H2和可能吸附在载体表面的溢流氢吹扫掉,再用H2作为探针分子进行吸附,测量H2吸附量,此时H2的吸附量为吸附在材料表面的物理吸附H2和溢流氢的总和,两次吸附量的差值即为H2的化学吸附量。因为H2的物理吸附量会随吸附压力的变化而变化,但H2的化学吸附量不随吸附压力的变化而改变,所以不同压力下H2的化学吸附量应为定值。本实验分别选取13.3,20.0,26.7,33.3,40.0 kPa 5个压力,采用静态H2化学吸附法测定Ni催化剂的吸附等温线,实验结果见图2。由图2可见,不同压力下,两次H2吸附量的差值(见图2(c))几乎相同,与上述原理相吻合。将这5个H2吸附量的差值连成一条直线,该直线与纵坐标轴的交点即为H2的化学吸附量。由此可见,选择压力分别为13.3,20.0,26.7,33.3,40.0 kPa来计算H2的化学吸附量较适宜。
2.3 测定条件对Ni催化剂的金属分散度的影响
2.3.1 还原温度的影响
为研究还原温度对金属分散度的影响,采用静态H2化学吸附法在250~850 ℃的还原温度下对Ni催化剂进行还原,测得的分散度见图3。
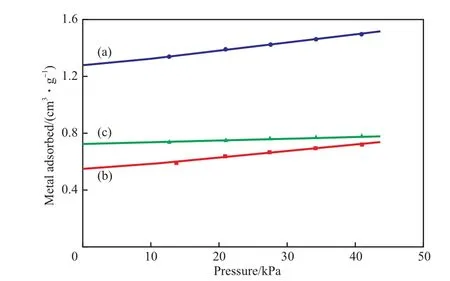
图2 静态H2化学吸附法测得的Ni催化剂的吸附等温线Fig.2 H2 adsorption isotherm plot on the Ni catalyst measured by H2 chemisorption.
2.3.2 还原时间的影响
采用静态H2化学吸附法,测定不同还原时间下Ni催化剂的金属分散度,实验结果见图4。由图4可见,随还原时间的延长,Ni催化剂的金属分散度呈现先略微增大后降低的趋势,表明短时间的还原并不能将氧化态Ni还原完全,而长时间的还原会使Ni金属发生高温烧结,但由于Ni催化剂中Ni分散在载体表面,分散度下降得不明显,故在选择还原时间时,在保证金属氧化物达到基本相同的还原程度时,应尽量选择短的还原时间。因此,选择还原时间为1 h较适宜。
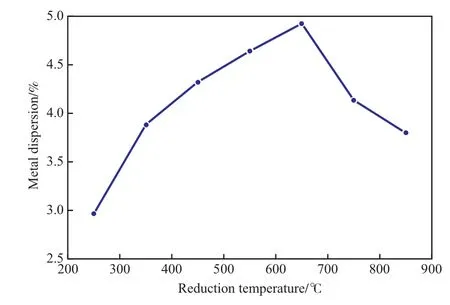
图3 不同还原温度下测得的Ni催化剂的金属分散度Fig.3 Metal dispersion on the Ni catalyst measured at different reduction temperature.
由图3可见,随还原温度的升高,Ni催化剂的金属分散度呈现先增大后降低的趋势。在还原温度较低时,根据H2-TPR实验结果可知,氧化态的Ni没有完全还原成金属Ni,氧化态Ni不会与H2发生吸附作用,所以金属分散度偏低;但当还原温度较高时,高温会将更多的氧化态Ni还原成金属Ni,同时高温还原会使Ni金属发生高温烧结[14],二者的综合作用导致Ni催化剂的金属分散度随还原温度的升高先增大后减小。对于Ni催化剂,还原温度为650℃时,金属分散度最大,基本对应于H2-TPR曲线中第二种氧化态Ni的还原峰位(见图1),这表明在还原峰位的温度下进行还原,可最大限度的将氧化态Ni还原,同时受高温烧结的影响相对较小。因此,选择还原温度650 ℃较合适。
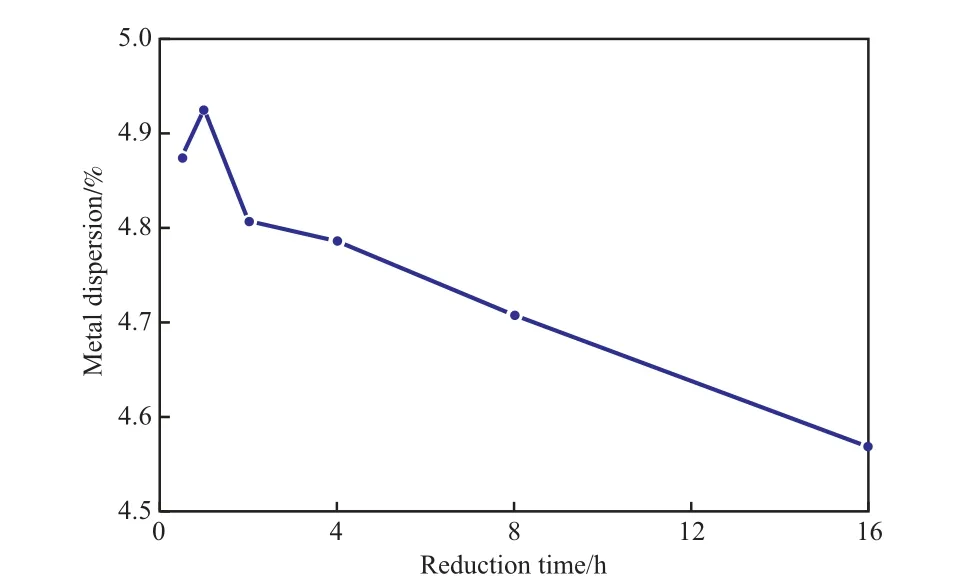
图4 不同还原时间下测得的Ni催化剂的金属分散度Fig.4 Metal dispersion of the Ni catalyst measured at different reduction time.
2.3.3 抽真空时间的影响
采用静态H2化学吸附法,测定不同抽真空时间下Ni催化剂的金属分散度,实验结果见图5。
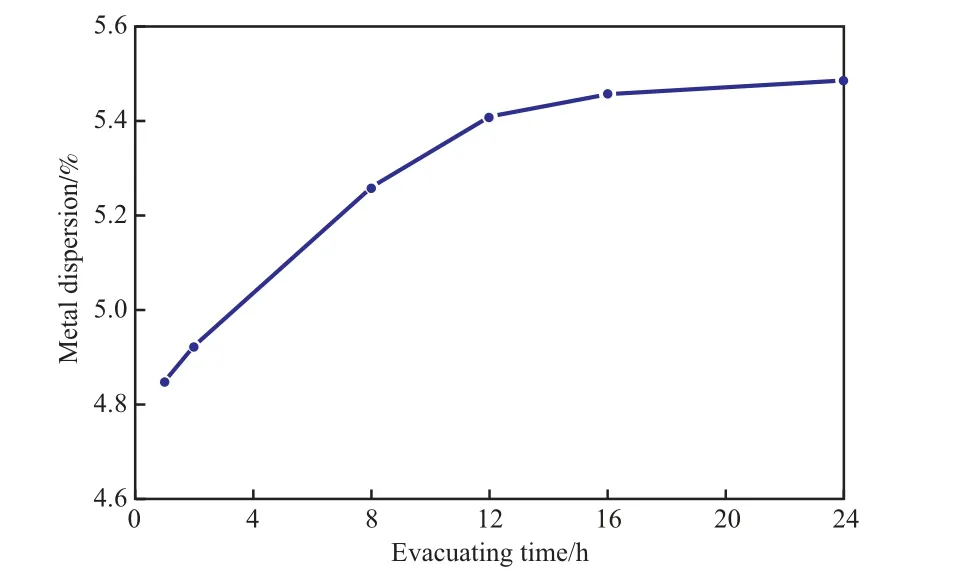
图5 不同抽真空时间下测得的Ni催化剂的金属分散度Fig.5 Metal dispersion of the Ni catalyst at different evacuating time.
由图5可见,随抽真空时间的延长,Ni催化剂的金属分散度呈小幅上升的趋势。这表明长时间抽真空会将还原过程中残留在体系内的H2和Ni金属表面物理吸附的H2去除干净,且长时间的抽真空不会降低金属分散度。因此,在选择抽真空时间时,可选择尽量长的抽真空时间。对于该Ni催化剂,选择抽真空时间大于16 h较合适。
2.3.4 吸附温度的影响
吸附温度同样是测定金属分散度的重要参数,有些气体的吸附需要活化能,需要在一定温度下才能发生。采用静态H2化学吸附法,测定不同吸附温度下Ni催化剂的金属分散度,实验结果见图6。由图6可见,随吸附温度的升高,Ni催化剂的金属分散度呈明显的下降趋势,表明H2在Ni催化剂上的化学吸附在50 ℃下即可发生,不需经过高温活化,高温下反而会明显降低Ni催化剂上的H2化学吸附量。因此,选择吸附温度为50 ℃较适宜,此时Ni催化剂的金属分散度为5.46%。
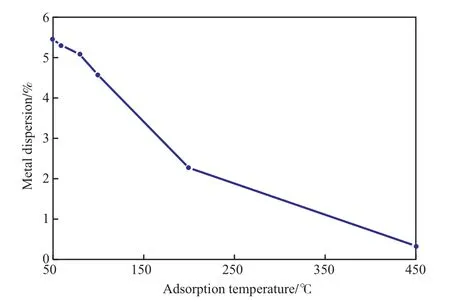
图6 不同吸附温度下测得的Ni催化剂的金属分散度Fig.6 Metal dispersion of the Ni catalyst at different adsorption temperature.
3 结论
1)H2-TPR实验结果表明,Ni催化剂中有两种氧化态Ni:一种氧化态Ni在300 ℃下即可还原,另一种氧化态Ni需在800 ℃时才能被还原。
2)采用静态H2化学吸附法,在选定压力下研究测试条件对Ni催化剂的金属分散度的影响。实验结果表明,高还原温度和长还原时间会使Ni金属发生高温烧结;长时间抽真空可去除残留在体系内和Ni金属表面物理吸附的H2;H2在Ni金属上的化学吸附不需经过高温活化即可发生。
3)采用静态H2化学吸附法测定Ni催化剂的金属分散度的适宜条件为:还原温度650 ℃,还原时间1 h,抽真空时间大于16 h,吸附温度50 ℃。在此条件下,Ni催化剂的金属分散度为5.46%。
[1] 杨春雁,杨卫亚,凌凤香,等. 负载型金属催化剂表面金属分散度的测定[J]. 化工进展,2010,29(8):1468 - 1473,1501.
[2] 刘君佐,史佩芬. 气体脉冲色谱法测定负载催化剂上金属的分散度:Ⅰ.应用于Pt/Al2O3催化剂[J]. 石油化工,1978,7(5):454 - 461.
[3] 杨锡尧,裴站芬,白瑞琴,等. 脉冲氢氧滴定法测定Pt/Al2O3催化剂的分散度[J]. 石油化工,1978,7(4):352 - 355.
[4] Brooks C S,Christopher G L M. Measurement of the State of Metal Dispersion on Supported Nickel Catalysts by Gas Chemisorption[J].J Catal,1968,10(3):211 - 223.
[5] Smith J S,Thrower P A,Vannice M A. Characterization of Ni/ TiO2Catalysts by TEM,X-Ray Diffraction and Chemisorption Techniques[J].J Catal,1981,68(2):270 - 285.
[6] 史雪芳. 负载型催化剂中金属分散度的测定[J]. 黎明化工,1993(1):21 - 26.
[7] Anderson J A. Supported Metals in Catalysis[M]. London:Imperial College Press,2005:143 - 145.
[8] 陈诵英,孙予罕,丁云杰,等. 吸附与催化[M]. 郑州:河南科学技术出版社,2001:124 - 125.
[9] Velu S,Gangwal S. Synthesis of Alumina Supported Nickel Nanoparticle Catalysts and Evaluation of Nickel Metal Dispersions by Temperature Programmed Desorption[J].Solid State Ionics,2006,177(7/8):803 - 811.
[10] Pechimuthu N A,Pant K K,Dhingra S C,et al. Characterization and Activity of K,CeO2,and Mn Promoted Ni/Al2O3Catalysts for Carbon Dioxide Reforming of Methane[J].Ind Eng Chem Res,2006,45(22):7435 - 7443.
[11] Mohamed I Z,Muhammad A H,Lata P. In Situ FTIR Spectroscopic Study of 2-Propanol Adsorptive and Catalytic Interactions on Metal-Modif ed Aluminas[J].Langmuir,2001,17(13):4025 - 4034.
[12] Kelf n M H,Cyrus G C,Adesoji A A. Multivariate Analysis of the Role of Preparation Conditions on the Intrinsic Properties of a Co-Ni/Al2O3Steam-Reforming Catalysts[J].Ind Eng Chem Res,2004,43(19):6006 - 6013.
[13] 纪敏,周美娟,毕颖丽,等. La2O3-Ni/SrAl12O19催化剂上甲烷与二氧化碳重整反应的研究[J]. 分子催化,1997,11(1):13 - 20.
[14] Aben P C. Palladium Areas in Supported Catalysts:Determination of Palladium Surface Areas in Supported Catalysts by Means of Hydrogen Chemisorptions[J].J Catal,1968,10(3):224 - 229.
[15] Agostini G,Pellegrini R,Leofanti G,et al. Determination of the Particle Size, Available Surface Area, and Nature of Exposed Sites for Silica-Alumina-Supported Pd Nanoparticles:A Multitechnical Approach[J].J Phys Chem C,2009,113(24): 10485 - 10492.
(编辑 李明辉)
Effect of Measuring Conditions on Metal Dispersion on Ni Catalyst
Man Yi,Huang Wenqing
(SINOPEC Beijing Research Institute of Chemical Industry,Beijing 100013,China)
The metal dispersion on Ni catalyst was measured by static H2chemisorption under different measuring conditions. The oxidation state of Ni on the Ni catalyst was measured by means of H2-TPR experiment. The effects of reduction temperature,reduction time,evacuating time and adsorption temperature on the metal dispersity on the Ni catalyst were investigated. The H2-TPR results showed that there were two oxidation states of Ni in the Ni catalyst,which could be reduced at 300 ℃and 800 ℃,respectively. The static H2chemisorption isotherm results showed that the Ni metal was sintered at high reduction temperature and in long reduction time. The hydrogen which was adsorbed physically on the Ni surface and remained in the system could be removed by evacuating with long time. The hydrogen could be adsorbed chemically on the Ni surface without activation. The metal dispersion on the Ni catalyst was 5.46% under the suitable conditions of reduction temperature 650 ℃,reduction time 1 h,evacuating time more than 16 h and adsorption temperature 50 ℃.
nickel catalyst;metal dispersion;chemisorption;measuring
1000 - 8144(2014)09 - 1087 - 04
TQ 426.81
A
2014 - 04 - 11;[修改稿日期] 2014 - 06 - 30。
满毅(1983—),男,山东省青岛市人,硕士,工程师,电话 010 - 59202148,电邮 many.bjhy@sinopec.com。
进展与述评

