石蒜碱对人白血病细胞K562凋亡作用的研究
于 淼,于 洋,刘林涛
(1.哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨150076;2.国家教育部抗肿瘤天然药物工程研究中心,哈尔滨150076;3.哈尔滨商业大学药物研究所博士后科研流动站,哈尔滨150076)
生物碱(alkaloid)广泛存在于自然界中,是一类碱性的含氮有机化合物,大多数生物碱含有复杂的氮环结构,如吡啶,吲哚,喹啉,嘌呤等,也有少数是胺类化合物.石蒜碱属于异喹啉类生物碱中的吡咯骈菲里啶生物碱.石蒜碱是中草药中具有显著药理活性的重要化学成分,研究发现石蒜碱具有抑制乙酰胆碱酯酶、催吐、镇静、阵痛、抗肿瘤等多种生物活性,因此具有很高的开发利用价值[1-3].本文对石蒜碱诱导人慢性髓原白血病K562细胞凋亡及膜电位进行了研究,以探讨其抗肿瘤的作用机制.
1 实验材料
1.1 细胞
K562细胞株由哈尔滨商业大学生命科学与环境科学研究中心提供.
1.2 试剂及药品
石蒜碱(质量分数98%),阿拉丁试剂有限公司;羟基喜树碱(质量分数98%),哈尔滨圣泰药业;胎牛血清(FCS),杭州四季青生物工程公司;溴化四氮唑蓝(MTT),Sigma公司;碘化丙啶(PI),Angus公司;TritonX-100,Farco公司;枸橼酸钠,北京化学试剂公司;罗丹明123(Rh123),碧云天公司.
1.3 仪器
CO-150型CO2培养箱,日本三洋公司;680型酶标仪,美国Bio-Rad公司;CLOUTER EPICSXL流式细胞仪,美国Beckman-Coulter公司;SP2激光共聚焦扫描显微镜,德国Leica公司.
2 实验方法
2.1 试剂配制
石蒜碱:称取10 mg石蒜碱并溶于10 mL PBS中配制成1 mg/mL的母液,避光4℃保存.用无血清的1640培养液配制成所需的质量浓度.
羟基喜树碱:母液质量浓度为1 mg/mL,4℃避光保存.给药前以1640培养液稀释到所需质量浓度即可.
1640培养液:将一袋1640粉末倒入大烧杯中,加双蒸水定容至1 L,待充分搅拌溶解后加入2.5gNaOH,调整 pH 到 7.2 左右,用 0.22μm微孔滤膜过滤2次,加入已过滤的胎牛血清(水浴56℃,30 min灭活),使血清终体积分数为10%,封口胶封口,4℃保存.
PBS 缓冲液:精密称取 0.1gKCl、4.0gNaCl、0.1gKH2PO4、1.78gNa2HPO4加入双蒸水溶解并定容至500mL,121℃,高压灭菌30min,用封口膜封口,4℃保存.
MTT溶液:避光称取MTT粉末50mg,用PBS缓冲液溶解,定容到100 mL,用微孔滤膜(0.22 μm)过滤,封口膜封口,4℃避光保存.
三联溶解液:称取SDS粉末10g,异丁醇5mL,10mol/L HCl0.1 mL用双蒸水溶解配成100 mL溶液.
2.2 细胞培养
从5%CO2,37℃的培养箱中取出K562细胞,在显微镜下进行观察.当细胞达到80%左右的高密度时,即可进行细胞传代.800 r/min离心去掉到离心管中的培养液,吸取3 mLPBS洗涤1次.取出新培养瓶加入适量的含10%胎牛血清的1640培养液,按1∶6或适当比例转移到新的培养瓶中,将培养瓶放入培养箱中继续培养[4].
2.3 MTT法测定石蒜碱对K562细胞的细胞毒作用
取处于对数期的K562细胞,将细胞悬液调整为5×104个/mL,接种于96孔板当中,每孔加入100μL的细胞悬液,然后每孔加入100μL的石蒜碱,终质量浓度依次为:0.25、1、4、16 μg/mL,每剂量设6个平行孔;阴性组加入相同体积的培养液;阳性对照组加入100μL羟基喜树碱,终质量浓度为5μg/mL,置于37℃,含5%的二氧化碳培养箱中培养中培养72 h后,每孔加入200μL新鲜配制含0.5 mg/mL MTT,持续培养2~4 h,每孔加150 μL三联裂解液溶解,用微型振荡器进行振荡混匀10 min,用酶标仪检测确定光密度值(OD值),参考波长490 nm,检测波长570 nm.用下面公式计算药物对肿瘤细胞的抑制率,并按中效方程计算IC50[5].细胞抑制率% =(空白对照组 OD值-给药组平均OD值)/空白对照组平均OD值×100%
2.4 流式细胞仪检测石蒜碱诱导K562细胞的凋亡率
取处于生长对数期的人慢性髓原白血病K562细胞,收集细胞,然后细胞计数,调整浓度为1.0×105个/mL接种于6孔板中,放入7℃,5%CO2的培养箱中培养24 h待细胞贴壁后,给药,石蒜碱的终浓度分别为5、10、20μg/mL,阳性药羟基喜树碱终浓度为5μg/mL.继续放入培养箱中培养48 h后,收集细胞,1 600 r/min离心10 min,弃上清液,每个离心管中加入1 mL PBS进行洗涤并离心后,弃上清液,加入70%冰乙醇-20℃固定过夜.PBS洗1次,加入配好的 PI染液(含 PI 50 mg/mL、RNase 1 g/L、0.1%TritonX -100),避光室温染色30 min,300目尼龙网过滤后上机检测,激发波长488 nm,发射波长 525 nm,检测细胞数为 104个[6-7],见图 1.
2.5 激光共聚焦检测K562细胞中线粒体膜电位变化的影响
取在生长对数期的人慢性髓原白血病K562细胞调整细胞浓度为1×105个/mL接种于6孔培养板中,每孔1 mL放入37℃,5%CO2的二氧化碳培养箱内培养,待对数期后,加入不同质量浓度的石蒜碱,使其终质量浓度为 2.5、5、10 μg/mL.阳性药羟基喜树碱的终质量浓度为2μg/mL,继续培养48 h后收集细胞,加入罗丹明123染色.37℃孵育1 h.孵育结束后,1 500 r/min离心10 min,弃上层清液,收集细胞,用PBS洗涤1次.重悬细胞后,取200μL,激光共聚焦扫描显微镜观察线粒体膜电位荧光强度(FI),激发波长为488 nm,发射波长为 540 ~570 nm[8-9],见图 2.
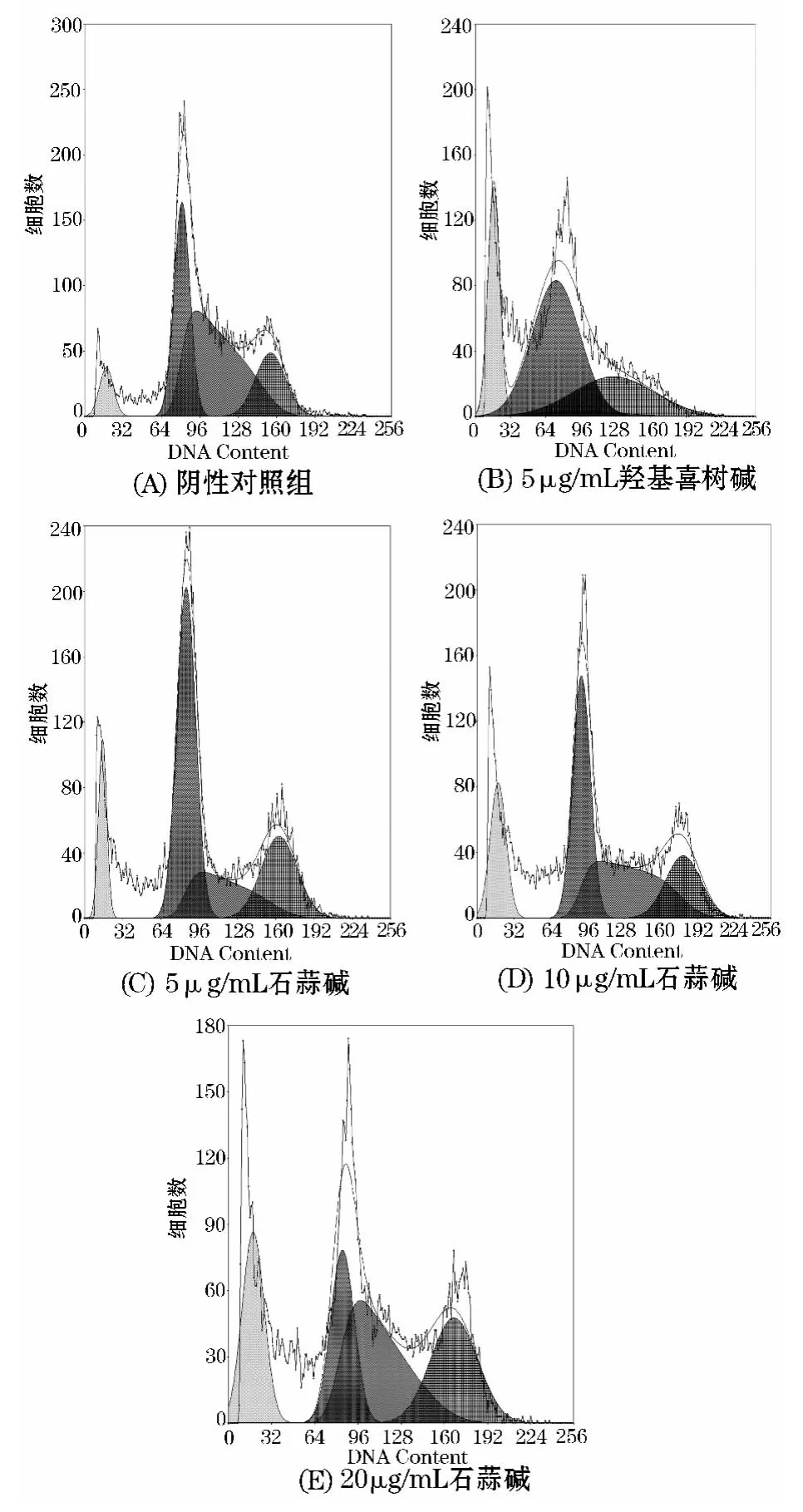
图1 流式细胞仪检测石蒜碱对K562细胞的凋亡率
2.6 数据处理
用SPSS18.0软件进行统计分析.数据资料以均数±标准差(x±S)表示,多样本均数比较采用单因素方差分析.P<0.05为具有统计学意义.
3 结果与分析
3.1 石蒜碱对K562细胞的细胞毒作用
MTT法观察石蒜碱对人慢性髓原白血病K562细胞的生长抑制作用,选取5个不同浓度的药物分别作用72 h后,计算得出石蒜碱IC50值为0.049 μmol/L,羟基喜树碱 IC50值为 0.011 μmol/L,见表1.
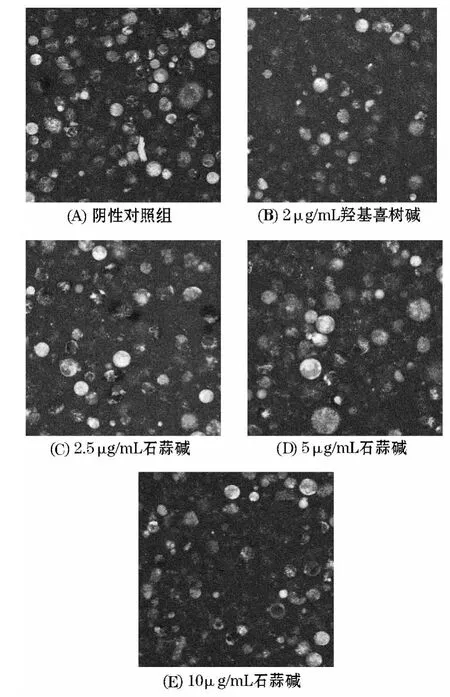
图2 石蒜碱作用48 h染色K562细胞线粒体膜电位变化

表1 MTT法测定72 h石蒜碱对K562细胞生长抑制作用
3.2 石蒜碱对K562细胞凋亡率的影响
人慢性髓原白血病K562细胞经过石蒜碱作用48 h后,细胞出现凋亡的亚二倍体峰,抑制了DNA的合成.经计算得出凋亡率分别为(10.94±1.52)%、(15.29±2.02)%、(19.05±2.36)%,有显著性差异(P<0.01),剂量越大凋亡率越高.见表2.
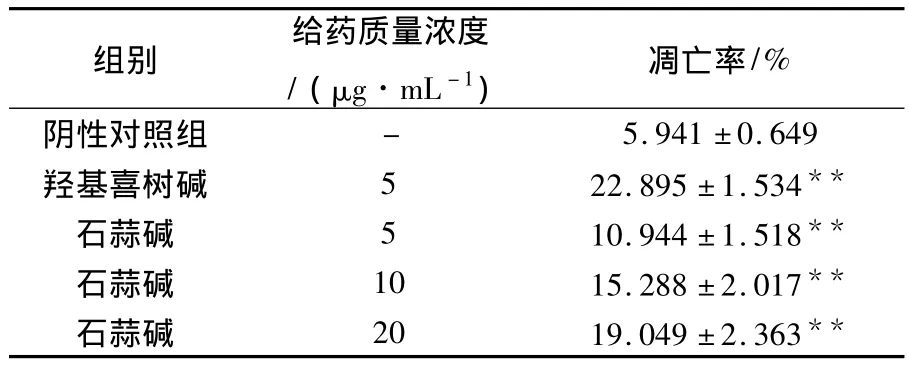
表2 流式细胞仪检测石蒜碱对K562细胞的凋亡率(x±S)
3.3 石蒜碱对-562细胞膜电位的影响
激光共聚焦扫描显微镜检测不同浓度的石蒜碱作用K562细胞72 h后细胞内的线粒体膜电位(Δψm).图2中,峰高表示荧光强度的高低,而荧光强度的高低间接的反映出线粒体膜电位的高低.给药组的荧光强度随给药剂量的增加而降低,且呈一定的剂量依赖关系.由表3可知,阴性对照组荧光强度为(75.67±1.15),低、中、高三个给药组荧光强度分别为(37.56±1.46)、(29.48±1.22)和(17.61±2.16),阳性药对照组为(19.29±0.97).与阴性对照组相比都具有统计学意义(P<0.01),且随着给药剂量增大,荧光强度降低越为显著.
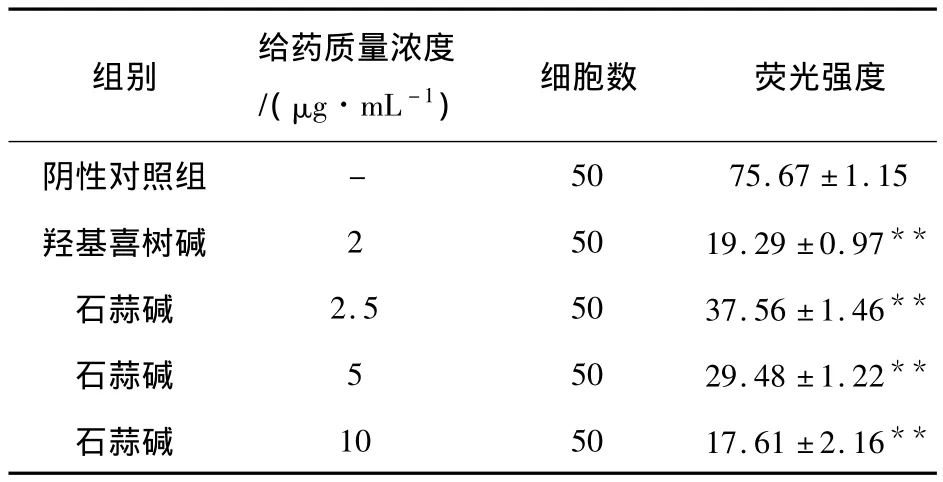
表3 石蒜碱对K562(x±S)
4 讨论
本文采用MTT比色法检测发现石蒜碱对K562细胞具有一定的细胞毒作用,并且能够抑制K562细胞的增殖.用流式细胞仪分析经PI染色后的细胞悬液,可以发现在DNA直方图上正常二倍体细胞的G0/G1峰前会出现一个亚二倍体峰(即AP峰-apoptoticpeak),此峰代表凋亡的细胞群体.根据此亚二倍体峰可以计算凋亡细胞占整个样品的百分率.结果显示,石蒜碱作用于K562细胞72 h后,DNA直方图上有明显凋亡峰出现,凋亡率随给药剂量的增加而升高,说明石蒜碱对K562细胞的抑制作用与细胞凋亡有关[8-9].
膜电位下降发生在凋亡的早期阶段,即细胞凋亡的形态学改变之前.通过抑制ΔΨm的下降可以阻止凋亡的发生,说明细胞ΔΨm变化为凋亡的特异性改变.阳离子亲脂荧光素Rhodamine123能扩散到线粒体基质中,被线粒体选择性吸收,其扩散量能反映Ψm的变化.实验采用激光共聚焦扫描显微镜观察在不同浓度石蒜碱作用72 h后线粒体膜电位的变化.结果显示阴性对照组细胞荧光强度最强,即膜电位最高;阳性对照组细胞荧光强度最弱,即膜电位最低;给药组荧光强度随给药剂量升高而减弱,这说明与阴性对照组相比,膜电位依给药剂量升高而降低,且呈一定的剂量依赖关系.即是说石蒜碱能够导致K562细胞内线粒体膜电位明显下降.线粒体膜电位的降低说明线粒体膜通透性已经发生改变.在该过程中,一旦线粒体膜电位损耗,细胞就会进入无法挽回的凋亡过程.但目前石蒜碱诱导K562细胞凋亡的机制尚不明确,有待进一步研究.
[1]MISAGHIAN N,LIGRESTI G,STEELMAN L S,etal.Targetting the leukemic stem cell:the Holy Grail of leukemia therapy[J].Leukemia,2009,23(l):25 -42.
[2]石效平.中药配合化疗治疗白血病现状与展望[J].中国中西医结合杂志,2012,14(7):446-448.
[3]熊海蓉,李 霞,文祝友,等.野生石蒜中石蒜碱和加兰他敏的分离研究[J].化学与生物工程,2012,29(9):51-53.
[4]CHATTOPADHYAY P,CHAUDHURY P,WAHI A K.Ca2+,concentrations are key determinants of isehemia-rePerfusio-induced apoptosis:significance for the molecular mechanism of Bel-2 Action[J].Applied Biochemistry and Biotechnology,2010,160(7):1968-1977.
[5]李 盈,宋冬雪,汲晨锋,等.岩藻甾醇诱导人早幼粒白血病HL-60细胞凋亡[J].哈尔滨商业大学学报:自然科学版,2011,27(6):788-793.
[6]SU X,ZHENG X,NI J.Lanthanum citrate induces anoikis of Hela cells[J].Cancer Letters,2009,285(2):200 -209.
[7]ZHU X J,SHI Y,PENG J,etal.The effects of BAFF and BAFF -R -Fc fusion protein In immune thrombocytoperia[J].Blood,2009,114(26):5362-5367.
[8]CHEN K,ZHANG Q,WANG J.Taurine protects transformed rat retinal ganglion cells from hypoxia-induced apoptosis by preventing mitochondrial dysfunction[J].Brain Research,2009,1279:131-138.
[9]SHEN L,LIU Q,NIJ.A proteomic investigation into the human cervical cancer cell lineHela treated with dicitratoytterbium complex[J].Chemico- Biological Interactions,2009,181(3):455-462.

