氧化铋光催化剂改性研究
高 红,刘可新,王学同
(1.天津现代职业技术学院,天津 300350;2.天津甘泉集团,天津 300171;3.天津市津南区环保局,天津 300350)
利用半导体材料光催化降解水中污染物是目前比较热门的研究课题之一。光催化剂可以有效利用太阳能,并在反应中产生具有强氧化能力的空穴和羟基自由基,因而备受人们的关注。氧化铋作为一种半导体光催化材料,其带隙能为2.8 eV,吸收波长较长,可以实现对太阳光的利用。但如何提高其催化活性,是氧化铋光催化剂使用过程中的重要问题。
光催化反应的量子效率低是其难以实用化的最为关键因素之一。光催化反应的量子效率取决于载流子的复合几率。对光催化剂来说,俘获光激发载流子并与电子给体/受体发生作用,增加光催化反应的量子效率,从而提高光催化活性。研究表明,提高光催化剂活性的方法有减小催化剂粒径、表面螯合、金属离子掺杂等。
1 实验部分
1.1 试剂与仪器
硝酸铋,化学纯;亚甲基蓝、甲醇钠、氢氧化钠、乙二胺四乙酸二钠、氯化铁、硝酸铁均为分析纯。
D/max-2500 X射线衍射仪;JEM-100CXⅡ透射电子显微镜;722分光光度计;白炽灯。
1.2 氧化铋的制备
配制硝酸铋溶液与NaOH溶液。将硝酸铋溶液缓慢加入NaOH溶液中,随着反应进行,温度升高,pH值逐渐增大。当温度为40~60℃,pH值达到3~5时停止反应。过滤、洗涤,加水调浆,并调节温度,继续加NaOH溶液进行反应。随着碱液的加入,生成物逐渐变黄,当pH为13~14时达到反应终点,继续搅拌30 min后,过滤、洗涤及干燥脱水,即得黄色氧化铋粉体。
1.3 氧化铋光催化剂的改性
1.3.1 减小光催化剂粉体粒径 采用金属醇盐水解法和二步法制备纳米氧化铋粉体[1]。
1.3.1.1 金属醇盐水解法 将硝酸铋和甲醇钠置于烧杯中,加水反应,静置,待其完全反应后,将反应产生的沉淀过滤、烘干、煅烧、研磨,即为氧化铋纳米粉体。
1.3.1.2 二步法 向硝酸铋溶液中滴加氢氧化钠溶液,当溶液温度为40~60℃,pH值为3~5时,停止加入氢氧化钠。过滤、洗涤,加蒸馏水打浆,继续加碱液反应,水浴温度控制在55~57℃,沉淀逐渐变为淡黄色,当pH值>12时,反应终止。将沉淀过滤、洗涤、烘干后,放入450℃电阻炉中高温煅烧,取出研磨,即得氧化铋纳米粉体[2]。
1.3.2 表面螯合 将硝酸铋溶解于硝酸,置于高温水浴中,滴加EDTA溶液和NaOH溶液,反应得到黄色沉淀物质,过滤、洗涤,烘干后得到与EDTA螯合的氧化铋粉末。
1.3.3 催化剂的固载 将活性炭进行洗涤、过滤、干燥。在三颈瓶中加入一定量氧化铋粉体和无水乙醇,充分搅拌,静置30 min。加入活性炭,水浴回流30 min。抽滤,100℃烘干,于箱式电阻炉中450℃下煅烧,即得氧化铋活性炭固载光催化剂[3]。
同上述方法制备氧化铋膨润土固载光催化剂。
1.4 实验方法
取100 mL一定浓度的亚甲基蓝溶液于光催化反应器中,加入一定量改性后的氧化铋光催化剂,用白炽灯模拟太阳光进行光催化反应。以亚甲基蓝溶液脱色率来评价催化剂的使用效果。
2 结果与讨论
2.1 减小催化剂粒径
2.1.1 氧化铋纳米粉体的检测[4]金属醇盐水解法制得的氧化铋粉体的XRD见图1。
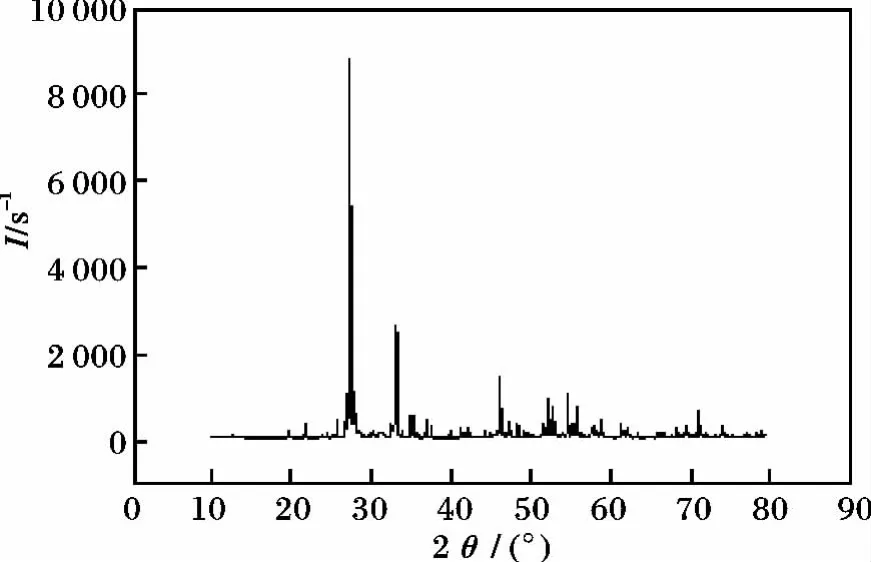
图1 氧化铋X射线衍射图谱Fig.1 Bi2 O3 X-ray diffraction pattern
将该实验中粉体的X射线衍射图谱与标准氧化铋晶体X射线衍射图谱进行比对,两者图谱基本能够吻合,说明实验制得的粉体为氧化铋粉体。
制备的氧化铋粉体的TEM照片见图2。
由图2可知,氧化铋粉体粒径在70 nm以下,为纳米级粉体,且样品分散良好,但二步法制得的氧化铋粉体存在较为严重的团聚问题,使用效果较差。

图2 制备氧化铋粉体TEM照片Fig.2 TEM photos of Bi2O3 preparation
2.1.2 纳米氧化铋光催化反应 用金属醇盐法制得的纳米氧化铋光催化剂进行光催化脱色反应,同时与普通粒径氧化铋光催化剂进行比较,结果见表1。

表1 普通氧化铋与纳米氧化铋光催化反应脱色效果比较Table1 Decolorization effect comparison of common Bi2 O3 and nano one
由表1可知,纳米氧化铋光催化剂脱色效果较普通粒径氧化铋好。氧化铋颗粒尺寸减小到纳米级,比表面积增加,表面原子数量随之迅速增加,使光吸收效率提高,表面光生载流子浓度随之增大,进而提高表面氧化还原反应的效率[5]。同时,光催化反应效果与该物质在光催化剂上的吸附量有关。光催化剂晶粒尺寸减小,比表面积增大,单位面积活性位置增加,反应物吸附量增加,反应几率增大。
2.2 光催化剂表面螯合
2.2.1 螯合量对氧化铋脱色效果影响 在制备氧化铋光催化剂过程中加入不同用量的EDTA溶液,利用所制得的螯合氧化铋光催化剂进行光催化反应,反应条件:亚甲基蓝浓度 6 mg/L,氧化铋100 mg,pH=3,H2O22 mL,反应时间 40 min,结果见图3。
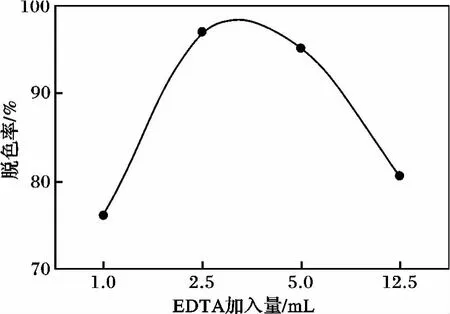
图3 不同EDTA螯合量脱色效果图Fig.3 Decoloring effects diagram of different EDTA chelating quantities
由图3可知,脱色率随EDTA量的增加出现先增大后减小的现象。EDTA分子中含有六个可与金属离子形成配位键的原子,能与金属离子形成摩尔比为1∶1的配合物[6]。螯合在光催化剂表面上的EDTA,能够延长电子的寿命,提高光催化反应活性。但当配合物形成完全后,增加EDTA的量,配合物亦不再增加。
2.2.2 螯合pH值对氧化铋脱色效果影响 在制备螯合氧化铋催化剂过程中改变螯合溶液的pH值,使用该催化剂进行光催化反应,反应条件:亚甲基蓝浓度6 mg/L,氧化铋 100 mg,H2O22 mL,反应时间40 min,结果见图4。
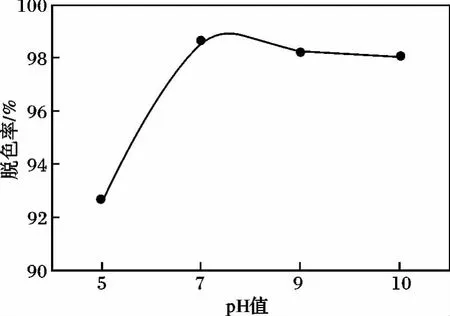
图4 不同螯合pH值脱色效果图Fig.4 pH decoloring effect diagram of different EDTA chelation
EDTA在水溶液中随pH的不同有不同的存在形式,各种存在形式的分布分数与pH有关[7]。由图4可知,随溶液pH值的升高,脱色率增大。原因是EDTA与金属离子螯合物的稳定常数K'MY=KMY/αY(H),当溶液pH值增大时,酸效应系数αY(H)随之减小,稳定常数K'MY增大,使螯合物稳定性增强。
2.3 金属离子掺杂
在氧化铋光催化体系中掺杂氯化铁和硝酸铁溶液,进行光催化反应,反应条件:亚甲基蓝浓度6 mg/L,氧化铋 100 mg,反应时间 40 min,H2O22 mL,实验结果见表2。

表2 掺杂离子对脱色率影响Table2 Doping ion impact on decolorization rate
掺杂金属离子是提高光催化剂活性有效手段。铁离子对光生电子的捕获可以促进光生载流子的分离,延长光生电子与空穴对的寿命;另外,反应体系中加入的过氧化氢与亚铁离子的结合产生Fenton试剂,Fenton试剂具有极强的氧化能力,促进反应体系中·HO的生成,从而使光催化性能得到提高。反应体系中掺杂氯化铁脱色效果较硝酸铁差,氯离子可吸附在催化剂表面,使得氧化速率降低,并阻碍有机物向活性位置扩散。因此,加入氯化铁的脱色效果差。
2.4 光催化剂的固载研究
2.4.1 活性炭固载催化剂 考察氧化铋活性炭固载光催化剂的光催化反应,反应条件:固载催化剂4.0 g,亚甲基蓝浓度6 mg/L,pH=3,H2O22 mL,反应时间40 min,结果见图5。

图5 活性炭固载重复使用效果Fig.5 Reuse effect diagram of activated carbon immobilization
由图5可知,固载光催化剂重复使用3次,脱色效果仍较好,但使用第4次后,脱色率开始出现明显下降现象。这是由于有效光催化剂固载牢固性降低而发生脱落,使固载催化剂失去使用价值。
2.4.2 膨润土固载催化剂 反应条件:固载催化剂1.0 g,亚甲基蓝浓度 6 mg/L,pH=3,H2O22 mL,反应时间40 min,氧化铋膨润土固载光催化剂的光催化反应,实验结果见图6。

图6 氧化铋膨润土固载重复使用效果Fig.6 Reuse effect diagram of Bi2O3 bentonite immobilization
由图6可知,氧化铋膨润土固载催化剂的脱色较好,使用3次后脱色率并没有明显下降,但在第4次反应过程中,膨润土颗粒破碎,不能再继续使用。
3 结论
(1)利用金属醇盐水解法和二步法制备纳米氧化铋,经X射线衍射和透射电子显微镜检测,均为纳米粉体,但金属醇盐水解法制得的纳米氧化铋性状较佳。
(2)使用由金属醇盐盐水法制得的纳米氧化铋粉体降解亚甲基蓝,脱色率达到97.1%,较普通氧化铋粉体效果好。
(3)氧化铋与EDTA螯合,增加螯合剂用量,亚甲基蓝脱色率先增大后减小;同时当螯合溶液pH值增大时,有利于光催化反应。
(4)在氧化铋中掺杂金属离子可明显提高催化活性,掺杂氯化铁和硝酸铁对脱色效果之间比较,硝酸铁效果相对较好。
(5)将氧化铋固载在活性炭和膨润土上,可实现催化剂的重复利用,可节约成本。
[1] 王世敏,许祖勋,傅晶,等.纳米材料制备技术[M].北京:化学工业出版社,2004:123-127.
[2] 孙璐薇,何永.纳米氧化铋研究[J].传感器技术,2000,19(1):21-22.
[3] 张素香,屈撑囤,王新强.光催化剂改性及固定化技术的研究进展[J].工业水处理,2002,22(7):12-15.
[4] 吴刚.材料结构表征及应用[M].北京:化学工业出版社,2003:215-218.
[5] 王光玉.纳米二氧化钛光催化材料研究现状[J].无机盐工业,2012,44(3):50-53.
[6] 华东理工大学分析化学教研组.分析化学[M].4版.北京:高等教育出版社,1999:246-249.
[7] 程艳,高静,徐红纳,等.螯合剂 EDTA 简介[J].化学教育,2009(5):4-6.

