溴离子对NDMA前体物Chlortoluron的氯化降解特性影响
田富箱,徐 斌,秦 朗,张天阳
(1.同济大学 污染控制与资源化研究国家重点实验室,上海 200092;2.长江水环境教育部重点实验室,上海 200092)
苯脲类除草剂是我国使用最为广泛的除草剂类型之一,被广泛应用于玉米、小麦、大豆、马铃薯、甘蔗等作物的生长过程[1].由于已在农业废水和饮用水中被大量检测到,这些污染物及其代谢产物对人体健康的潜在危害也已经开始引起极大的关注[2].由于苯脲类除草剂将代谢生成苯胺衍生物,后者正是血红蛋白的强氧化剂,因此由脲类除草剂导致的高铁血红蛋白症和溶血症已有报道[3].Chlortoluron即是一种被广泛使用的高效脲类除草剂,主要用于去除和控制谷物田中一年生禾本科杂草和阔叶类杂草[4].Chlortoluron性质稳定,属于低毒类农药[5].在使用后Chlortoluron会无法避免地进入地表水等水体,并可在环境中长时间稳定存在.许多学者的研究表明,Chlortoluron在水中和土壤中的半衰期可达数月之久,甚至在常态下只发生极为缓慢的降解[4,6].土壤中的Chlortoluron会发生缓慢而微弱的迁移,也会通过农业使用而进入地表水.根据一些学者在英国和德国等国家的调查研究表明,Chlortoluron在地表水和地下水中的检出质量浓度已达微克每升的水平[4].欧盟对饮用水中任一种控制农药的最大允许检出质量浓度为0.1μg·L-1,所有农药类化合物及其降解产物的允许检出质量浓度为0.5μg·L-1[7].Chlortoluron对环境的污染尤其是对水体的污染,越来越受到人们的高度重视[8].
已有研究发现,Chlortoluron在加氯消毒过程中会生成一些消毒副产物,如三卤甲烷、卤乙酸、三氯硝基甲烷、卤乙腈、卤代酮类、亚甲基二硝胺(NDMA)等[9-10],而这些消毒副产物能产生致癌、致畸、致突变作用,对人体健康造成巨大危害.二甲基亚硝胺(NDMA)是近年来水处理领域中颇为关注的氯(胺)化消毒副产物之一,国际癌症研究所通过动物实验充分证明了其对人体的致癌能力,并将致癌等级定为2B,同时该物质也属于美国环境保护署公布的200种致癌剂之一(致癌等级为2级),在暴露的质量浓度仅为0.7ng·L-1条件下,理论评估致癌风 险系数达到10-6[11].Xu的研究表明,Chlortoluron是水中氯胺化反应生成NDMA的重要前体物[10].因此研究Chlortoluron在饮用水中的转化和转移特性具有较为重要的现实意义.
氯化消毒是目前国内外绝大多数水厂采用的消毒方式[12].但目前已发现氯能与水中微量有机物发生反应产生可致癌的消毒副产物(DBPs)如三卤甲烷(trihalomethanes,THMs)等[13-14].美国癌症协会也宣布DBPs能引起试验动物致癌和后代缺陷[15].目前人们对氯化消毒所导致的DBPs对人体健康造成的危害给予越来越多关注,而氯化消毒过程中有机物的转化和转移特性更是此类研究的热点问题.确定水中其他离子对Chlortoluron氯化过程的影响,对于研究Chlortoluron在不同地域水处理的氯化消毒特性具有重要的理论和实际意义.由于许多地区尤其是沿海地带的地表水和地下水中往往含有较多的Br-,Br-容易与HOCl反应生成氧化还原电位更高的HOBr,从而促进卤化反应的速率,而鉴于HOBr的强氧化性并能近一步与有机物生成三致特性更高的溴代消毒副产物,有必要以Br-为背景离子研究Chlortoluron在氯化过程中的变化规律.基于此,本文研究了在不同pH下,在外加溴离子时Chlortoluron在氯化过程中的降解特性,并通过MATLAB优化数学工具箱中的函数求解常微分方程组得到了反应的速率常数.
1 试验材料和方法
1.1 试验试剂与仪器
试验所用的Chlortoluron为色谱纯标准品(纯度大于99.0%),购自德国Dr.Ehrenstorfer公司.试验使用的氢氧化钠、浓硫酸、浓盐酸、磷酸二氢钾、碳酸钠、碳酸氢钠、无水硫酸钠、硫代硫酸钠、溴化钾等试剂均为优级纯和分析纯试剂,购自国药集团化学试剂有限公司(上海).试验所用次氯酸纳溶液(6%有效氯)购自Sigma与国药集团化学试剂有限公司(上海),每次使用前次氯酸钠的有效氯含量均采用DPD-AES法标定[16].试验使用的有机溶剂甲醇为色谱纯试剂,购自J.T.Baker(USA).试验配置的溶液均采用超纯水配置,超纯水由Milli-Q(Reference)纯水机制备.
Chlortoluron浓度的测定采用高效液相色谱法,主要仪器为Waters e2695-2489高效液相色谱仪.色谱柱分别采用 Waters XTerra C18色谱柱(4.6mm×250mm,5μm,Waters Inc,USA)与 Welch Ultimate C18柱(100mm×4.6mm,5μm,Welch Materials Inc.,Shanghai,China).所有氯化试验均在严格控温条件下进行,试验所用恒温震荡设备为THZ-300C恒温摇床,控制反应温度为25℃,转速为200r·min-1.反应溶液的pH用雷磁PHS-3C精密pH计测量并用缓冲溶液控制.
1.2 试验分析方法
Chlortoluron测定的高效液相色谱条件为:流量1.0mL·min-1;流动相体积配比为甲醇∶水=60%∶40%;检测波长240nm;分析时间10min.由Chlortoluron储备液(20mg·L-1)配制一系列质量浓度梯度分别为5,2,1,0.5,0.1,0.05及0.01mg·L-1共7个标准质量浓度点,按照梯度稀释以减小误差,根据色谱峰面积及标准样质量浓度作标准曲线.仪器的检测限可达10μg·L-1.为了保证数据的准确性,试验过程中每批试验均重新配制标准曲线,从而使试验数据能更准确地反映试验规律.
1.3 Chlortoluron氯化降解试验
氯化降解试验于THZ-300C恒温摇床内(25℃±1℃)进行(反应容器为250mL棕色细颈磨口摇瓶).在9.4μmol·L-1的Chlortoluron反应液中,加入缓冲溶液(pH为6,7时用磷酸盐缓冲溶液;pH为10时用碳酸盐缓冲溶液),使缓冲溶液浓度达10 mmol·L-1[17],通过加入不同量的KBr液控制[Br2]/[Cl2]值,用合适浓度的硫酸溶液和氢氧化钠溶液准确调节pH,然后将一定量的次氯酸纳溶液([HClO]=188.0μmol·L-1,以Cl2计)注入反应液中,立刻迅速混合并计时.在反应的不同时刻取样,取样1mL放置于液相分析样品瓶中,并采用50 μL Na2S2O3(0.01mol·L-1)中和余氯,样品保存于4℃恒温箱中,待批次试验结束后尽快测定Chlortoluron质量浓度,平行试验同时进行.
2 试验结果与讨论
2.1 pH为6时溴离子对Chlortoluron的氯化降解速率的影响
投加不同浓度的溴离子,使得[Br2]/[Cl2]值分别为0,0.01,0.02,0.05,0.1,0.2,pH 为6时,用拟一级动力学反应速率变化模型对试验数据进行拟合,并根据ln([Chlortoluron]0/[Chlortoluron]t)(表示T=0和T=t时刻Chlortoluron的浓度之比的对数)对反应时间作图,其结果如图1所示.
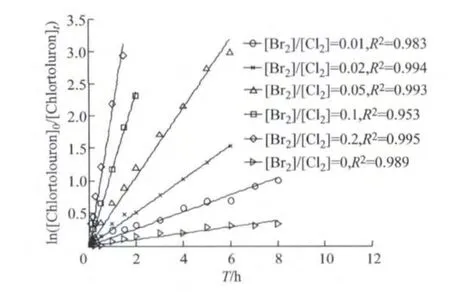
图1 不同[Br2]/[Cl2]下 Chlortoluron降解拟一级模型曲线(pH为6)Fig.1 Pseudo-first-order kinetic plot of Chlortoluron chlorination with different values of [Br2]/[Cl2]at pH 6
由图1可以看出,pH为6,外加溴离子时,Chlortoluron的降解速率明显快于无溴离子时,且随着Br-浓度的增大,Chlortoluron的降解速率也不断加快,这说明反应生成的HOBr能更快地与Chlortoluron发生反应,即HOBr是比HOCl更强的亲电子试剂,从而可以更有效地氧化Chlortoluron,这与其他物质的研究结论一致[18-19].从图1也可以看出,无溴离子存在时,Chlortoluron氯化降解符合拟一级动力学模型(相关系数R2=0.989)[9].添加 Br-后 Chlortoluron的降解试验数据也与模型拟合结果较好,ln([Chlortoluron]0/[Chlortoluron]t)对反应时间仍然具有较好的线性(相关系数R2>0.950).该结果表明,有Br-存在时,Chlortoluron的氯化反应速率仍然是符合拟一级反应规律的.而且随着[Br2]/[Cl2]的不断升高,直线斜率逐步增长,通过计算得知,[Br2]/[Cl2]分别为0,0.01,0.02,0.05,0.1,0.2时,其拟一级反应速率常数分 别 为 0.0484,0.1309,0.2572,0.5322,0.9653,1.1815,2.0774h-1.
从上述实验结果也可以推测,尽管溶液中同时存在着不同比例的HOBr和HOCl,但他们均能与Chlortoluron发生反应,且都能符合拟一级动力学模型,这一点从后面的实验结论中也可以得到证实.
2.2 pH为7时溴离子对Chlortoluron的氯化降解速率的影响
反应液pH 为7,采用不同的[Br2]/[Cl2]值时,用拟一级动力学反应速率变化模型对试验数据进行拟合,并根据ln([Chlortoluron]0/[Chlortoluron]t)对反应时间作图,结果如图2所示.
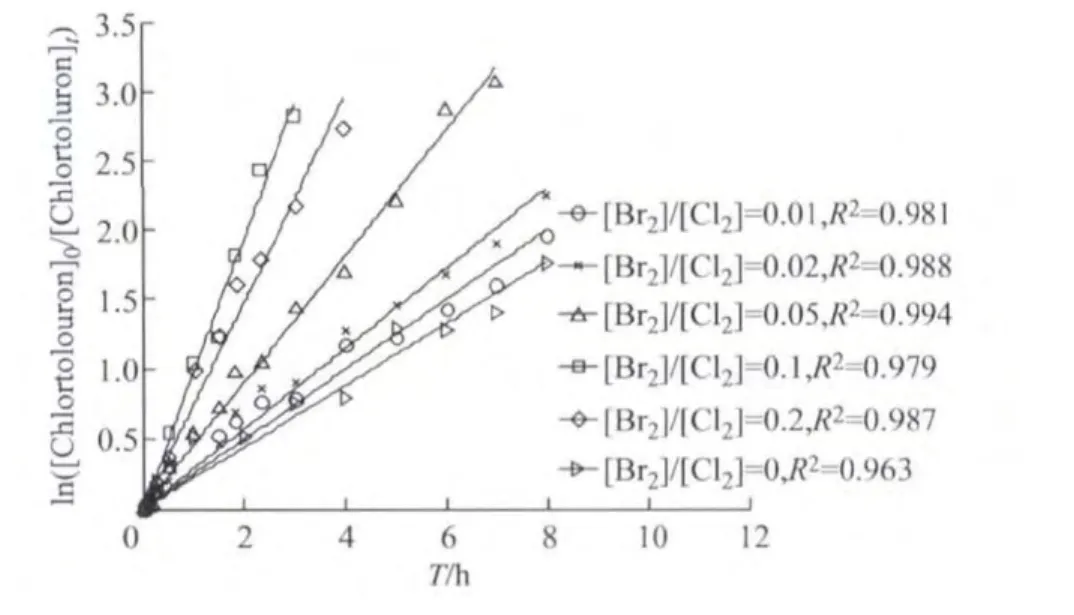
图2 不同[Br2]/[Cl2]值下 Chlortoluron降解拟一级模型曲线(pH为7)Fig.2 Pseudo-first-order kinetic plot of Chlortoluron chlorination with different values of [Br2]/[Cl2]at pH 7
从图2可以看出,pH为7时的情况与pH为6时基本相似,Chlortoluron的氯化反应速率均是随着溴离子浓度的增大而增大.受不同pH反应体系中HOBr生成率的影响,及其与Chlortoluron氯化和溴化降解联合作用的共同影响,随着[Br2/Cl2]的增加,其反应速率增加量明显小于pH为6的情形.在同一[Br2/Cl2]值下,pH 为6时 Chlortoluron的降解速率也明显快于pH为7时的情况,这可能是由于反应体系中不同的H+浓度导致的,H+浓度越大,生成的HOBr量就越大,从而降解Chlortoluron的速率就越快.
由图2也可以看到,ln([Chlortoluron]0/[Chlortoluron]t)与降解时间之间的变化呈现明显的线性关系(相关系数R2>0.960).这说明在pH为7条件下,溶液中有Br-存在时,Chlortoluron的氯化反应同样也是符合拟一级反应规律的,该结果与pH为6的情况基本相似.随着反应体系[Br2]/[Cl2]的不断升高,两者间直线斜率同样逐步增长,[Br2]/[Cl2]分别为0,0.01,0.02,0.05,0.1,0.2时,其拟一级反应速率常数分别为0.1896,0.2144,0.2464,0.3877,0.6342,0.8302h-1.
2.3 pH为10时溴离子对Chlortoluron的氯化降解速率的影响
控制反应液pH为10条件下,采用不同的[Br2]/[Cl2]值时,Chlortoluron的降解曲线如图3所示.
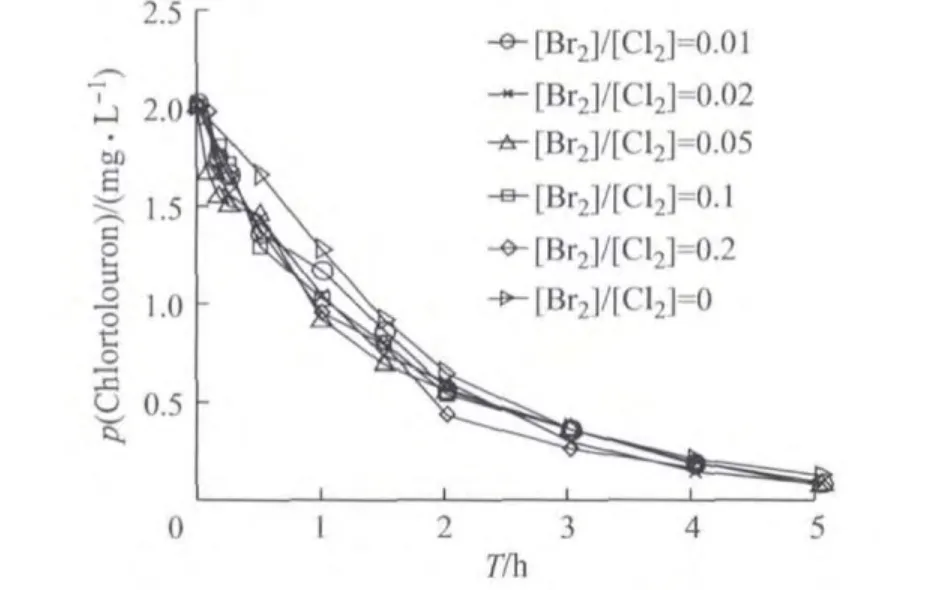
图3 不同[Br2]/[Cl2]值下Chlortoluron的质量浓度随反应时间变化(pH为10)Fig.3 Variety of Chlortoluron concentration with reaction time under different concentrations of[Br2]/[Cl2]at pH 10
从图3可以看出,pH为10时,Chlortoluron的氯化降解反应速率与pH为6和7时有很大的不同,即没有出现随着溴离子浓度增加Chlortoluron氯化降解速率随之增大的现象.溴离子浓度的增加并没有使Chlortoluron氯化降解速率有显著变化,而是几乎没有改变.
用拟一级降解动力学模型对其浓度变化数据进行拟合,并求解拟合方程的相关系数,发现pH为10时不同[Br2]/[Cl2]试验数据同样具有较好的线性(R2>0.980,这里不再列出),这表明pH 为10且有Br-存在时,Chlortoluron的氯化反应也是符合拟一级反应规律的,这与pH为6和7的情况相似.但是随着溴离子浓度的增加,Chlortoluron的氯化降解速率在开始时有所增加,但增加到[Br2]/[Cl2]为0.05以后时其斜率几乎没有变化,因此ln([Chlortoluron]0/[Chlortoluron]t)对反应时间作图所得的直线基本近于重合.分析其原因主要是:当水中存在溴离子时,氯将与其迅速反应生成氧化能力更强的次溴酸.HOBr的pKa值为8.9,比HOCl的pKa值7.5更高.在pH为10条件下,水中氯主要以ClO-形式存在,而ClO-基本与Br-不发生反应,因此氯化降解反应速率变化不大.在添加Br-后反应速率有较小的提高,可以解释为pH为10条件下水中仍然存在少量的H+和HClO,这些H+和HClO能与Br-反应生成HOBr,HOBr氧化能力更强,因此反应速率会略有增加.随着少量 H+和HClO的耗尽,添加更多的Br-也无法有效提高Chlortoluron的降解速率.
2.4 溴离子存在时Chlortoluron氯化降解动力学分析
以上3个不同pH条件下的试验结果表明,Chlortoluron的氯化降解过程仍为拟一级反应,分别求得kobs(反应的表观反应速率常数)值并对[Br2]/[Cl2]值作图,其结果如图4所示.
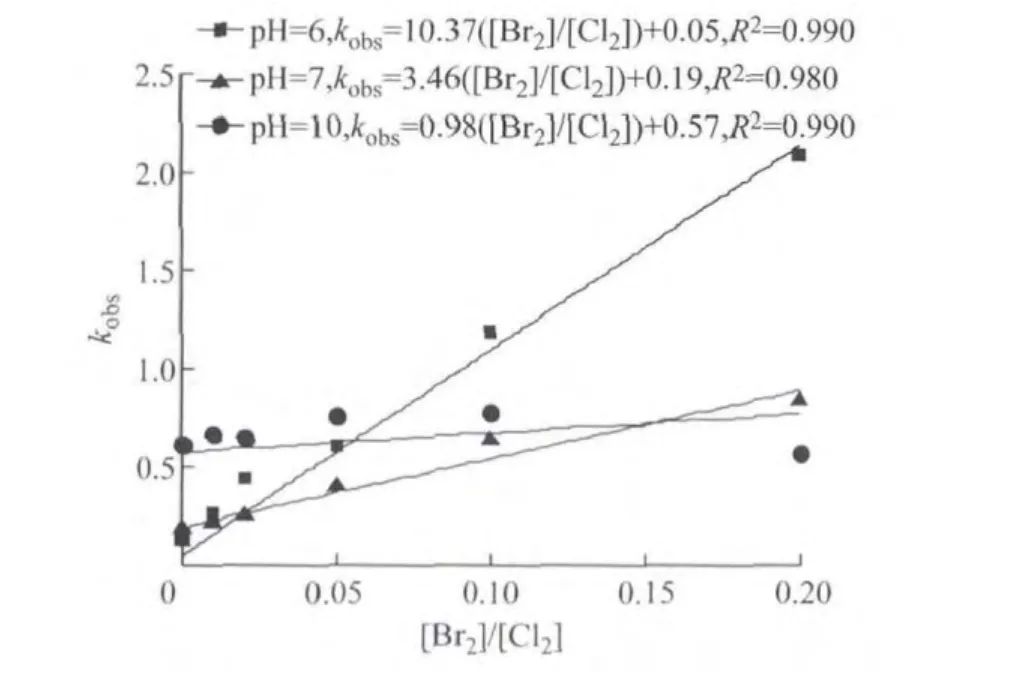
图4 不同pH 下[Br2]/[Cl2]对 Chlortoluron氯化降解的影响Fig.4 Effect of [Br2]/[Cl2]on Chlortoluron chlorination at different pH values
从图4可以看出,pH为6和pH为7条件下与无溴离子存在时相比,有溴离子存在时Chlortoluron的氯化反应明显加快,并随着溴离子浓度的增大,反应速率也增大,kobs与[Br2]/[Cl2]成较好的线性关系(相关系数R2≥0.980),这与其他学者所做研究结论相同[18-20].同一[Br2]/[Cl2]值下,pH 为6 时的kobs基本大于pH为7时的情况,这是由于在酸性pH下平衡体系式(5)中HBrO浓度要明显高于中性pH时的情况所致.从pH为10的曲线也可以看出,反应的kobs随[Br2]/[Cl2]增大变化不明显,与无溴离子存在时氯化反应的kobs相比仅仅略有增加.
Thomm和 Wayman已经证实,在一些衍生的胺基化合物(包括N-甲基甲酰胺、N-乙基甲酰胺、N-甲基乙酰胺等)的氯化过程中,OCl-是比HClO更强的氯化剂.试验中出现这样的结果可以用反应过程中在胺基上的氢原子和次氯酸根中氧原子之间形成的氢键来解释.羰基官能团的吸电子效应使得NH键削弱,从而造成OCl-反应速率的增高[21-22].在其他影响因素一样的条件下,脲类物质与OCl-的反应活性主要取决于苯环上的取代基团[23].因此,Chlortoluron与OCl-之间发生的反应可以用下式来表示:

由于Chlortoluron在水中并不会发生电离,所以溶液中不存在离子态Chlortoluron.外加溴离子时,体系所涉及的反应如下:
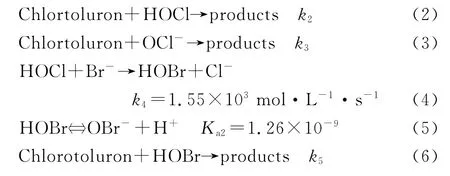
式(1)~(6)中:k1,k2,k3,k4,k5,Ka2分别表示各式的反应速率常数.
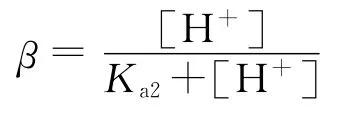
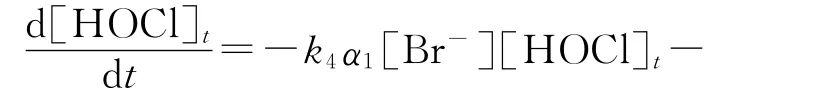
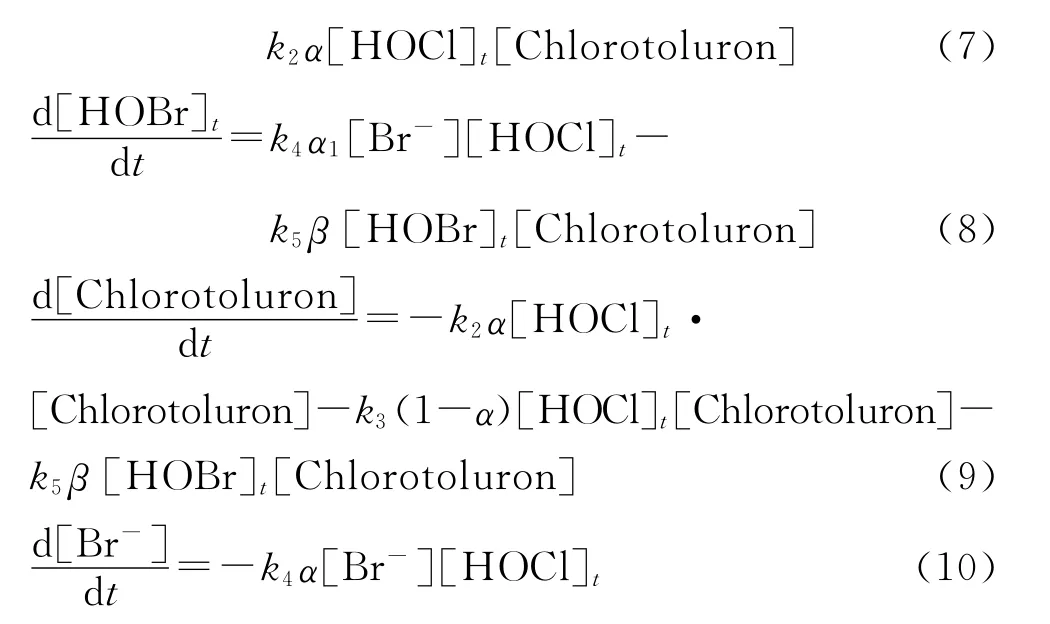
式(7)~(10)中:α1为[HOBr]占[BF]的百分比;α为[HOCl]占[HOCl]t的百分比.
由试验数据利用MATLAB优化数学工具箱中的函数求解关于式(7)~(10)的常微分方程组,可以得到k5,如表2所示.

表2 HOBr与Ametryn和Chlortoluron的反应速率常数Tab.2 Specific rate constants for the reaction o Ametryn and Chlortoluro nwithHOBr
从表2可以看到,对于有溴离子存在时的Chlortoluron的氯化反应而言,其k5为(1.95±0.44)×105mol·L-1·h-1,远远大于k2,k3(k2=(3.11±0.39)×102mol·L-1·h-1,k3=(3.06±0.47)×103mol·L-1·h-1)[9],这也解释了有溴离子存在时氯化反应明显加速的现象.根据这一值也可以推断,溴的存在有利于天然水体中Chlortoluron的去除,但是溴离子的存在也同时会导致一些溴代副产物的生成,可能会使处理后水的潜在毒性增加.这些溴代副产物往往具有比氯代消毒副产物更大的毒性[24-25].Chlortoluron的k5值远小于 Ametryn的k5值,这说明Ametryn与HOBr的反应活性远高于Chlortoluron.
3 结论
(1)当 pH 分别为6,7,10,[Chlortoluron]0=9.4μmol·L-1,[Cl2]0=188.0μmol·L-1时,投加不同浓度的溴离子,Chlortoluron的降解仍然符合拟一级动力学模型.
(2)当pH 分别为6,7时,Chlortoluron的降解速率随着溴离子浓度的增加而增大,且偏酸性环境下Chlortoluron的降解速率更快.这可能与反应体系中HOBr的生成有关.当pH为10时,外加溴离子浓度的变化对Chlortoluron的降解速率没有显著影响,这可能是由于ClO-与Br-基本不发生反应,从而没有生成HOBr造成的.
(3)根据对反应体系的动力学分析,求解了在本实验条件下,不同pH时拟一级反应动力学常数kobs与[Br2]/[Cl2]的线性关系,进而通过求解常微分方程组计算得出HOBr与Chlortoluron的反应速率常数k5为(1.95±0.44)×105mol·L-1·h-1.
(4)溴离子的存在有利于水中NDMA前体物Chlortoluron的氯化去除,但同时又会导致比氯代消毒副产物具有更大毒性的溴代消毒副产物的生成.
[1]Brock T C M,Roessink I,Belgers J D M,et al.Impact of a benzoyl urea insecticide on aquatic macroinvertebrates in ditch mesocosms with and without non-sprayed sections [J].Environmental Toxicology and Chemistry,2009,28(10):2191.
[2]Barbash J E,Thelin G P,Kolpin D W,et al.Majorherbicides in ground water:results from the national water quality assessment[J].Journal of Environmental Quality,2001,30(3):831.
[3]Watt B E,Proudfoot A T,Bradberry S M,et al.Poisoning due to urea herbicides[J].Toxicological Reviews,2005,24(3):161.
[4]World Health Organization.Chlortoluron in drinking-water background document for development of World Health Organization guidelines for drinking-water quality,health criteria and other supporting information[R].Geneva:World Health Organization,1996.
[5]Benitez F J,Real F J,Acero J L,et al.Kinetics of the transformation of phenyl-urea herbicides during ozonation of natural waters:rate constants and model predictions[J].Water Research,2007,41(18):4073.
[6]黄德智.绿麦隆光化学降解研究[D].合肥:安徽农业大学植物保护系,2004.HUANG Dezhi.Studies on photochemical degradation of chlorotoluron[D].Hefei:College of Plant Preservation of Anhui Agricultural University,2004.
[7]Council European Union.Council directive 98/83 about water quality intended for human consumption[J].Official Journal of the European Communities L,1998,330(1):32.
[8]Acero L J,Real J F,Benitez F J,et al.Kinetics of reactions between chlorine or bromine and the herbicides diuron and isoproturon [J].Journal of Chemical Technology and Biotechnology,2007,82(2):214.
[9]XU Bin,XIANG Fu,HU Chenyu,et al.Chlorination of chlortoluron:kinetics,pathways and chloroform formation[J].Chemosphere,2011,83(7):909.
[10]XU Bin,QIN Cao,HU Chenyan,et al.Degradation kinetics and N-Nitrosodimethylamine formation during monochloramination of chlortoluron[J].Science of the Total Environment,2012,417(1):241.
[11]International Agency for Research on Cancer(IARC)Working Group on the Evaluation of the Carcinogenic Risk of Chemicals to Humans.IARC monographs on the evaluation of the carcinogenic risk of chemicals to humans[M].[S.l.]:IARC,1979.
[12]路凯,井海宁,李士英,等.美国大、中型水厂饮水消毒调查报告[J].环境与健康杂志,200l,18(3):179.LU Kai,JING Haining,LI Shiying,et al.Committee report:disinfection at large and medium size systems in America[J].Journal of Environment and Health,200l,18(3):179.
[13]Rook J J.Formation of haloforms during chlorination of natural waters[J].Treatment and Examination,1974,23(2):234.
[14]Kopfler F C,Melton R G,Lingg R D,et al.GC/MS determination of volatiles for the national organics reconnaissance survey (NORS)of drinking water[J].Identification and Analysis of Organic Pollutants in Water,1976,1(1):87.
[15]National Cancer Institute.Report on the carcinogenesis bioassay of chloroform[R].Bethesda:National Cancer Institute,1976.
[16]American Public Health Association(APHA),American Water Works Association and Water Environment Federation(WEF).Standard methods for the examination of water and wastewater[S].20th ed.Washington D C:American Public Health Association,1998.
[17]Wang P,He Y L,Huang C H.Oxidation of fluoroquinolone antibiotics and structurally related amines by chlorine dioxide:reaction kinetics,product and pathway evaluation[J].Water Research,2010,44(20):5989.
[18]Acero L J,Real J F,Benitez J F,et al.Kinetics of reactions between chlorine or bromine and the herbicides diuron and isoproturon [J].Journal of Chemical Technology and Biotechnology,2007,82(2):214.
[19]孙晓峰.GAC和预氯化消毒工艺对水中几种典型内分泌干扰物去除研究[D].上海:同济大学环境科学与工程学院,2007.SUN Xiaofeng.Removal of typical endocrine disruptors from water by GAC and prechlorination process[D].Shanghai:College of Environmental Science and Engineering of Tongji University,2007.
[20]Mascolo G,Lopez A,James H,et al.By-products formation during degradation of isoproturon in aqueous solution.II:chlorination[J].Water Research,2001,35(7):1705.
[21]Thomm E W C W,Wayman M.N-chlorination of secondary amides.II.effects of substituents on rates of N-chlorination[J].Canadian Journal of Chemistry,1969,47(18):3289.
[22]Deborde M,von Gunten U.Reactions of chlorine with inorganic and organic compounds during water treatment—kinetics and mechanisms:a critical review[J].Water Research,2008,42(1/2):13.
[23]Xu B,Gao N,Cheng H,et al.Ametryn degradation by aqueous chlorine:Kinetics and reaction influences[J].Journal of Hazardous Materials,2009,169(1/3):586.
[24]Cooper W J,Zika R G,Steinhauer M S.Bromide-oxidant interactions and THM formation:a literature review[J].Journal—American Water Works Association.1985,77 (4):116.
[25]Nobukawa T,Sanukida S.Effect of bromide ions on genotoxicity of halogenated by-products from chlorination of humic acid in water[J].Water Research,2002,35(18):4293.

