兔阑尾黏膜预制尿道行阴茎再造的实验研究
朱 鴷, 芦立轩, 江 华, 朱晓海, 赵耀忠 李 宾, 刘安堂, 张盈帆
实验研究
兔阑尾黏膜预制尿道行阴茎再造的实验研究
朱 鴷, 芦立轩, 江 华, 朱晓海, 赵耀忠 李 宾, 刘安堂, 张盈帆
目的探讨以兔阑尾黏膜预制尿道行阴茎再造的可行性。方法60只雄性新西兰兔随机分为两组,分别利用阑尾黏膜和皮片预制尿道,术后3个月行阴茎再造术。观察阑尾黏膜预制尿道后2周,1、2、3个月及阴茎再造术后1、3个月时尿道的组织学变化;对比两组阴茎再造术后1、3个月阴茎大体形态变化和逆行尿道造影改变;对比两组阴茎再造术后3个月时,尿道并发症发生率的差异。结果阑尾黏膜预制尿道移植后,单层柱状上皮经历了早期脱落、再生,到后期逐渐萎缩凋亡,并被复层鳞状上皮逐渐移行、化生及取代的过程;阴茎再造术后 1个月,尿道已无单层柱状上皮存留,均被覆复层鳞状上皮,但上皮较薄,而再造术后3个月时,尿道复层鳞状上皮进一步增生增厚;两组再造阴茎大体形态无明显差异;逆行尿道造影显示,两组尿道早期吻合口处均存在管腔狭窄,逐渐趋于减轻;两组尿道狭窄及尿瘘并发症发生率差异具有统计学意义,阑尾黏膜组无尿路结石的发生,而皮片组由于毛发生长,6例出现毛石症,差异具有统计学意义(P<0.05)。结论利用阑尾黏膜预制尿道行阴茎再造术,方法可行;为避免尿道狭窄并发症的发生,宜根据尿道内上皮化生程度,调整合适的尿道预制时间。
阑尾黏膜; 尿道预制; 阴茎再造术
尿道重建是阴茎再造术的难点和关键所在[1-2],根据尿道重建方法的不同,阴茎再造术可分为单纯皮瓣法和复合皮瓣法[3]。单纯皮瓣法增加了皮瓣的面积,且过度卷曲会增加组织缝合的张力,影响皮瓣血运,形成尿道处皮瓣潜在毛发生长,常常会导致尿漏或尿道狭窄的发生[4-5]。复合皮瓣法行阴茎再造术中,对于尿道替代物的探索,一直是整形外科重要的课题。组织修复应尽量以组织学上相同或相近的组织进行移植,显然皮肤不是再造尿道理想的选择。近年来,国内外学者在复杂尿道下裂以及多次手术失败后的尿道狭窄修复手术中,应用口腔黏膜修复小段尿道缺损,取得了良好的效果,提示黏膜材料是替代尿道较理想的材料[6-7]。但由于口腔黏膜来源有限,无法直接用于阴茎再造术中的尿道重建。自2012年6月至2013年5月,笔者以成年雄兔阑尾黏膜预制尿道,复合腹壁皮瓣再造阴茎,为临床新的阴茎再造术式提供实验基础和依据。
1 材料与方法
1.1 实验动物及分组
普通级雄性新西兰兔60只,6个月龄,体质量2.5~3.5 kg,购自第二军医大学动物实验中心。饲养环境:温度22 ℃~26 ℃,湿度37%~42%,12 h昼夜交替光照(6:00~18:00)。按阴茎再造方法,随机分为阑尾黏膜预制尿道组和皮片预制尿道对照组,每组各30只。
1.2 术前处理
动物常规喂养1周,术前1周以8%硫化钠术区脱毛。腹部备皮范围:上至剑突平面,两侧至腋中线,下至肛门两侧。会阴部备皮,脱毛后,局部皮肤涂擦复方多粘菌素B软膏,保护皮肤。术前1 d禁食。
1.3 Ⅰ期尿道预制术及观测
手术均在戊巴比妥(50 mg/kg)腹腔麻醉下进行。阑尾黏膜组兔仰卧位固定,以甲紫标记左侧腹部Ⅱ期拟再造阴茎皮瓣区域(5.0 cm×3.0 cm),避开腹壁浅动脉的走行,平行皮瓣长轴方向标记拟预制尿道区域(5.0 cm×1.0 cm)(图1a),并于斜线阴影区作钝性皮下潜行分离。进一步取下腹正中切口,依次切开各层组织进入腹腔,切取阑尾,肠腔内以洗必泰溶液及生理盐水冲洗干净,翻转肠腔,从肠腔一端仔细剥离浆肌层,保留黏膜和黏膜下层(图1b),黏膜管内支撑直径为1.0 cm的引流管,将阑尾黏膜管导入皮下腔隙内,缝合固定,黏膜管内保留引流管支撑(图1c)。兔佩戴宠物头圈,以防术后自行咬食伤口。
皮片组兔麻醉后,仰卧位固定,从右侧腹部备皮区域切取5.0 cm×4.0 cm皮片,修薄成厚中厚皮片,将皮肤面朝里包绕引流管缝合成管状,在左侧腹部标记Ⅱ期拟再造阴茎区域及尿道区域,皮下造腔隙方法同阑尾黏膜组,将皮片管导入腔隙内,缝合固定,引流管支撑固定。
Ⅰ期手术后动物常规单独喂养,每日以洗必泰溶液和生理盐水冲洗黏膜和皮片预制尿道内的引流管,术后2周,1、2、3个月分别从阑尾黏膜组和皮片组各取1只兔处死,切取预制尿道管中段,行组织切片HE染色,观察两组预制尿道的组织学变化。
1.4 Ⅱ期阴茎再造术及观测
Ⅰ期手术后3个月行Ⅱ期阴茎再造术,两组术式相同。术前1 d禁食。同前麻醉后,取仰卧位固定,按Ⅰ期预订的再造阴茎皮瓣区,重新画线标记(包含预制尿道)。切取皮瓣,缝合成管状,保留血管蒂周围1.0 cm宽的筋膜组织,向股动脉处分离足够长度蒂部组织,皮管经皮下隧道转移至会阴部,切除原阴茎的皮肤组织,8号Foley导尿管导尿,显露尿道。保留阴茎内尿道长度约1.0 cm,与腹部皮瓣预制尿道近端相吻合,皮瓣近端与原阴茎根部皮肤相吻合,供区直接拉拢缝合(图1d)。术后兔常规单独喂养,Foley导尿管留置1周。术后1、2、3个月,观察两组兔再造阴茎大体形态,尿道灌注石蜡油l ml后,留置3F输尿管导管,在铅衣防护下,X线透视逆行尿道造影,边推注泛影葡胺造影剂(76%复方泛影葡胺20 ml稀释于50 ml 0.9%氯化钠溶液中),边后退输尿管导管,直至手术修复处,保存造影图片。最终分别切取术后1、3个月再造阴茎尿道组织,行切片HE染色观察。
1.5 统计学方法
2 结果
2.1 预制尿道情况
2.1.1 大体观察 阑尾黏膜组黏膜管早期淡白色分泌物较多,后期逐渐减少,经持续支撑后,尿道管直径保持粗度,管腔通畅;皮片组预制尿道早期分泌物量少,较干燥,管腔两侧端口缩窄明显, 3个月时,端口有部分兔毛长出,尚通畅。
2.1.2 预制尿道组织学变化 阑尾黏膜组尿道预制术后2周,黏膜单层柱状上皮脱落,部分单层柱状上皮再生,炎性细胞浸润(图2a);术后1个月,单层柱状上皮完全再生,细胞核较大,增生活跃,两侧端口肠黏膜上皮向复层鳞状上皮化生,腺体杯状细胞萎缩,仍有炎性细胞浸润,纤维化明显(图2b);术后2个月,阑尾黏膜单层柱状上皮萎缩,上皮层明显变薄,部分脱落,两侧端口肠黏膜上皮进一步向复层鳞状上皮化生(图2c);术后3个月,再造尿道中段残留的单层柱状上皮较少,大部分已脱落,炎性细胞浸润明显(图2d)。皮片组尿道预制术后2周,皮片成活,上皮变薄, 皮片虽经修剪,但还有多量毛囊存在(图2e);术后1个月,复层鳞状上皮增生,残存毛囊处于静息状态(图2f);术后2个月,复层鳞状上皮增生活跃,上皮层增厚(图2g);术后3个月,上皮成活良好,上皮层进一步增厚,残存毛囊出现毛发生长(图2h)。
2.2 再造阴茎情况
2.2.1 大体观察 两组术后再造阴茎全部成活,外观呈圆柱状,大体形态满意;色泽正常,表面有毛发生长,与原位阴茎大小接近,早期略有肿胀发红,整体血液循环良好;1个月左右,大小基本恢复正常。两组再造阴茎长度、直径测量比较,无明显差别,两组数据总体比较,差异无统计学意义(P>0.05,表1)。术后供受区切口Ⅰ期甲级愈合,4例腹部皮瓣供区因张力过大,切口裂开,延迟愈合。下肢无明显活动功能障碍。
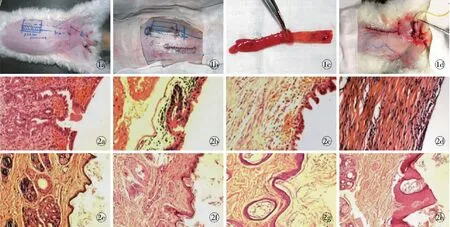
图1 阑尾黏膜预制尿道 a.术前设计 b.阑尾黏膜处理 c. 尿道预制术后即刻 d.Ⅱ期阴茎再造术后即刻图2 预制尿道组织学变化(HE×20) a.阑尾黏膜组术后2周 b.阑尾黏膜组术后1个月 c.阑尾黏膜组术后2个月 d.阑尾黏膜组术后3个月 e.皮片组术后2周 f.皮片组术后1个月 g.皮片组术后2个月 h.皮片组术后3个月
Fig1 Prefabrication of urethra with appendiceal mucous membrane. a. preview design. b. preparation of appendiceal mucous membrane. c. postview at once of urethral prefabrication. d. postview at once of Ⅱ period penial reconstruction.Fig2 Histological changes of prefabricated urethra (HE ×20) a. postview at 2 weeks in appendiceal mucous membrane group. b. postview at 1 month in appendiceal mucous membrane group. c. postview at 2 months in appendiceal mucous membrane group. d. postview at 3 months in appendiceal mucous membrane group. e. postview at 2 weeks in skin graft group. f. postview at 1 month in skin graft group. g. postview at 2 months in skin graft group. h. postview at 3 months in skin graft group.
2.2.2 尿道并发症 阴茎再造术后3个月,阑尾黏膜组6只兔出现吻合口(4只)及远端尿道(2只)的狭窄,3只兔在吻合口处出现尿瘘,无尿道结石发生;皮片组术后,4只兔阴茎根部发生尿瘘,3只兔于吻合口处发生狭窄,2只兔于远端尿道发生狭窄,6例出现再造尿道内毛发或结石出现。两组之间尿道结石发生率比较,差异具有统计学意义(P<0.05,表2)。

表1 再造阴茎术后两组阴茎的长度及直径
注:a为阑尾粘膜组;b为皮片组

表2 阴茎再造术后两组尿道并发症的情况
注:两组间尿道结石发生率比较,P<0.05
2.2.3 尿道造影 逆行尿道造影结果显示,阑尾黏膜组尿道轻度狭窄,1个月时尿道狭窄明显,尤以吻合口处为重,术区显僵硬感(图3a),挛缩率达30%;术后3个月时,尿道狭窄明显缓解,排尿通畅,尿道光滑连续,无充盈缺损,最大挛缩率仅为10%左右(图3b)。皮片组术后1个月,逆行尿道造影与阑尾黏膜组无明显区别,尿道狭窄亦在吻合口处最明显(图3c);术后3个月时明显减轻(图3d)。
2.2.4 再造尿道组织学转归 阑尾黏膜组:阴茎再造术后1个月,再造尿道内肠黏膜单层柱状上皮进一步减少,继续向复层鳞状上皮化生,但化生上皮较薄,仅为2、3层细胞,且部分上皮仍不成熟,部分脱落。腺体杯状细胞萎缩,纤维化明显(图4a)。术后3个月,再造尿道内几乎无单层柱状上皮,均被覆复层鳞状上皮,较术后1个月时明显增厚,且胶原纤维排列较整齐(图4b); 皮片组:阴茎再造术后1个月,再造尿道内上皮成活好,经尿流冲刷后,结构清晰,较正常皮肤仍偏薄,大量毛囊生存,皮下组织胶原纤维排列整齐(图4c)。术后3个月,上皮接近正常皮肤厚度,皮下组织胶原纤维紧致,毛囊生长旺盛(图4d)。
3 讨论
近10余年来,口腔黏膜替代尿道成形术的报道越来越多,已经成为治疗尿道狭窄较常用的技术,但由于来源有限,难以应用于较长段尿道狭窄或阴茎再造中的尿道重建[8]。
消化道黏膜组织学上与尿道黏膜相近,具有自分泌功能,湿润光滑,无毛,理论上可考虑应用于尿道重建。Lebret等[9]通过实验证明了以消化道黏膜再造尿道的可行性。Bales等[10]对2例超长段伴有严重瘢痕组织形成的前尿道狭窄患者,施行带蒂空肠前尿道成形术,术中把肠系膜血管和表浅股动静脉进行吻合。术后短期随访,2例患者都形成了一段新的功能良好的尿道。徐月敏等[11]对犬进行结肠黏膜游离移植替代尿道的实验研究,结果发现结肠黏膜全部存活。随后的临床研究也显示,结肠黏膜游离移植替代尿道成形术是一种切实可行的方法[12]。但应用结肠黏膜需要牺牲一段肠管,手术复杂,且全层肠壁移植时,结肠黏膜皱襞隆起,增加了排尿时的阻力[13]。而阑尾作为肠道附件,几乎为无功能器官。且阑尾黏膜无绒毛,无皱襞,更接近于大体尿道,整体长度平均7.0~9.0 cm,最长可达20.0 cm,可以满足再造尿道的要求。Aggarwal等[14]将带蒂阑尾应用于后尿道狭窄的修复,把阑尾两端分别与前列腺部尿道和球部尿道进行吻合,取得了成功。Chen等[15]进一步尝试了吻合血管游离阑尾移植,修复外伤后,尿道狭窄达8.0 cm的男性患者,术后患者排尿通畅。因此,本实验进一步探讨了阑尾黏膜游离移植预制尿道,复合腹壁皮瓣,应用于阴茎再造的可行性。
本实验结果发现,阑尾黏膜游离移植预制尿道3个月后行阴茎再造,阑尾黏膜组尿瘘和尿道狭窄发生率与皮片组之间差异无统计学意义。皮片组再造尿道内,由于毛发生长,尿道结石发生率显著高于阑尾黏膜组。此结果表明,阑尾黏膜预制尿道行阴茎再造的方法是可行的,无需单纯皮瓣法自身“管卷管”形成尿道,减少了供区面积,提高了皮瓣血运;同时预制尿路光滑,降低了尿路结石的发生率。但逆行尿道造影表明,即使经过3个月的持续引流和支撑,预制尿道黏膜挛缩的问题仍无法完全避免。阑尾黏膜为消化道上皮,由单层柱状上皮细胞构成,预制移植后,大体经历了早期脱落、再生,到后期逐渐萎缩凋亡的过程。最终再造尿道逐渐被移行、化生的复层鳞状上皮所取代。这表明阑尾黏膜游离移植后,逐步引导了周围皮肤和吻合口尿道上皮的移行再生。尿道预制术后早期(2周至1个月),尿道中段肠黏膜上皮由于萎缩凋亡,导致局部上皮缺失,此时对应于尿道狭窄或挛缩最严重的时间段,此时的胶原染色也显示了局部皮下组织纤维化反应明显,瘢痕收缩强烈,提示尿道内上皮化的过程,直接影响了再造尿道的功能恢复,有必要延长尿道预制支撑时间。因此,如何促进尿道内上皮化的过程,将是我们进一步提高再造尿道功能、减少相关并发症研究的重点。
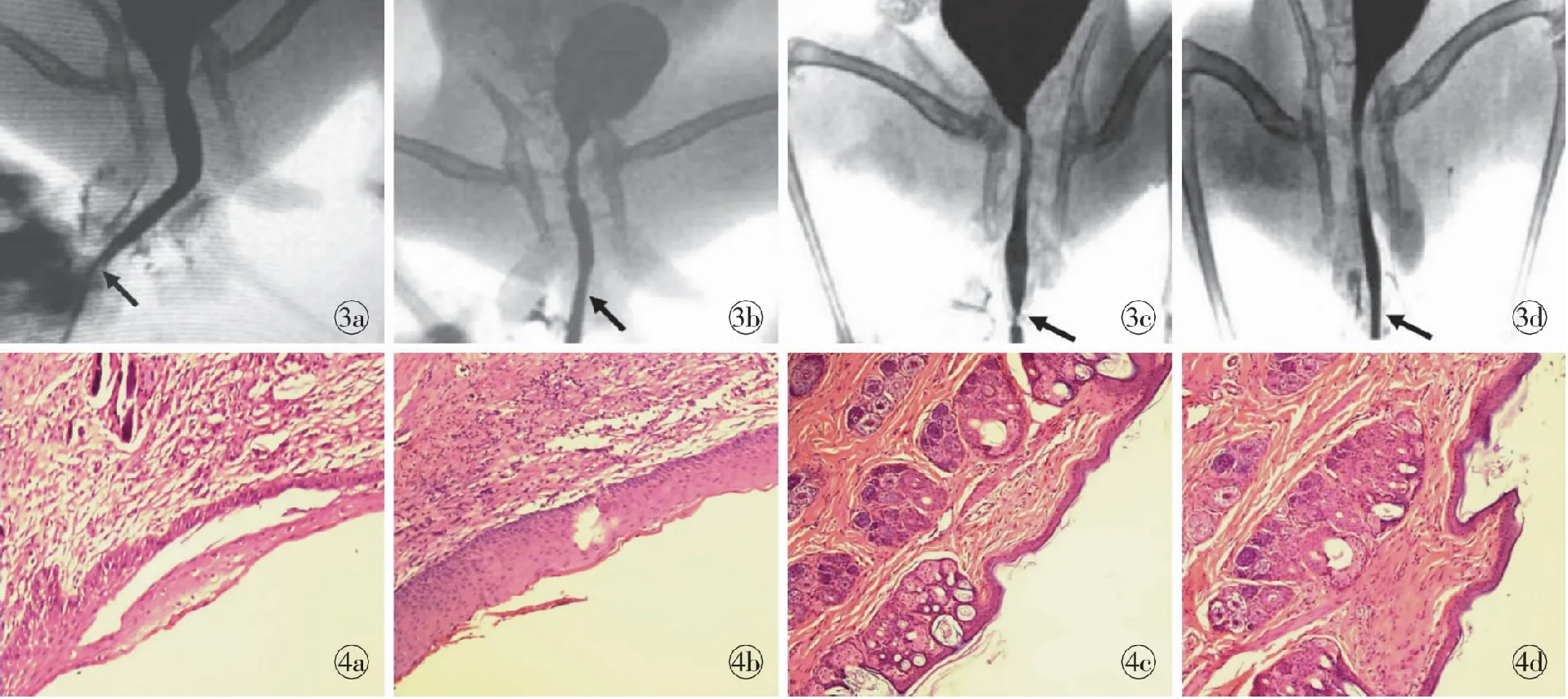
图3 阴茎再造术后逆行尿道造影 a.阑尾黏膜组术后1个月 b.阑尾黏膜组术后3个月 c.皮片组术后1个月 d.皮片组术后3个月图4 阴茎再造术后尿道组织学变化(HE ×20) a.阑尾黏膜组术后1个月 b.阑尾黏膜组术后3个月 c.皮片组术后1个月 d.皮片组术后3个月
Fig3 Retrograde urethrogram after penial reconstruction. a. postview at 1 month in appendiceal mucous membrane group. b. postview at 3 months in appendiceal mucous membrane group. c. postview at 1 month in skin graft group. d. postview at 3 months in skin graft group.Fig4 Histological changes of urethra after penial reconstruction (HE ×20). a. postview at 1 month in appendiceal mucous membrane group. b. postview at 3 months in appendiceal mucous membrane group. c. postview at 1 month in skin graft group. d.postview at 3 months in skin graft group.
[1] Garaffa G, Sansalone S, Ralph DJ. Penile reconstruction[J]. Asian J Androl, 2013,15(1):16-19.
[2] Selvaggi G, Dhejne C, Landen M, et al. The 2011 WPATH Standards of Care and Penile Reconstruction in Female-to-Male Transsexual Individuals[J]. Adv Urol, 2012,2012:581712.
[3] Kayes O, Shabbir M, Ralph D, et al. Therapeutic strategies for patients with micropenis or penile dysmorphic disorder[J]. Nat Rev Urol, 2012,9(9):499-507.
[4] 赵烨德, 李旭东, 刘 刚, 等. 阴茎再造术后尿道毛石症的处理体会[J]. 中国美容医学, 2011,20(11):1699-1700.
[5] Lumen N, Monstrey S, Goessaert AS, et al. Urethroplasty for strictures after phallic reconstruction: a single-institution experience[J]. Eur Urol, 2011,60(1):150-158.
[6] Patterson JM, Chapple CR. Surgical techniques in substitution urethroplasty using buccal mucosa for the treatment of anterior urethral strictures[J]. Eur Urol, 2008,53(6):1162-1171.
[7] Kumar S, Bansal P, Vijay MK, et al. Buccal mucosal graft urethroplasty in long segment anterior urethral stricture-is it gold standard[J]? Saudi J Kidney Dis Transpl, 2013,24(1):115-120.
[8] Lumen N, Oosterlinck W, Hoebeke P. Urethral reconstruction using buccal mucosa or penile skin grafts: systematic review and meta-analysis[J]. Urol Int, 2012,89(4):387-394.
[9] Lebret T, Gobet F, Dallaserra M, et al. Use of a digestive mucosal graft in urethroplasty. An experimental study--prospective utilization of the appendix mucosa[J]. Eur Urol, 1995,27(1):58-61.
[10] Bales GT, Kuznetsov DD, Kim HL, et al. Urethral substitution using an intestinal free flap: a novel approach[J]. J Urol, 2002,168(1):182-184.
[11] 徐月敏, 张心如, 乔 勇, 等. 结肠粘膜重建尿道的动物实验与临床应用[J]. 中华泌尿外科杂志, 2002,23(3):177-178.
[12] Xu YM, Qiao Y, Sa YL, et al. 1-stage urethral reconstrution using colonic mucosal graft for the treatment of a long complex urethral stricture[J]. J Urol, 2004,171(1):220-223.
[13] Lee YT, Cho TW, Jeong HS, et al. Reconfigured sigmoid colon neourethra substitution of refractory posterior urethral stricture[J]. Urology, 2005,65(1):157-159.
[14] Aggarwal SK, Goel D, Gupta CR, et al. The Use of pedicled appendiceal graft for substitution of urethra in recurrent urethral stricture[J]. J Pediatr Surg, 2002,37(2):246-250.
[15] Chen SH, Yeong EK, Tang YB, et al. Free and pedicled appendix transfer for various reconstructive procedures[J]. Ann Plast Surg, 2012,69(6):602-606.
Experimentalresearchofpenialreconstructionwithprefabricatedurethraofappendicealmucousmembraneinrabbit
ZHULie,LULi-xuan,JIANGHua,etal.
(DepartmentofPlasticSurgery,ChangzhengHospital,SecondMilitaryMedicalUniversity,Shanghai200003,China)
ObjectiveTo investigate the feasibility of penial reconstruction with prefabricated urethra of appendiceal mucous membrane in rabbit.MethodsSixty male New Zealand rabbits were randomly divided into two groups which urethras were separately prefabricated with appendiceal mucous membrane and flap, penial reconstruction was performed at 3 months after urethral prefabrication. Histological changes of the reconstructed penis was observed with HE staining at 2 weeks, 1 month, 2 months, 3 months after urethral prefabrication with appendiceal mucous membrane and at 1 month, 3 months after penial reconstruction. Morphological differences and retrograde urethrogram of reconstructed penis were analyzed at 1 and 3 months after penial reconstruction and urethral complications were compared between two groups.ResultsThere was no difference on gross morphology of reconstructed penis between two groups. After appendiceal mucous membrane was transplanted for prefabricated urethra, simple columnar epithelium of mucous membrane had gone through early falling off, regeneration, atrophy and apoptosis finally. Meanwhile, stratified squamous epithelium gradually migrated, metaplasiaed and replaced simple columnar epithelium during this period. There was almost no simple columnar epithelium left on the surface of reconstructed urethra, which was fully covered by thin stratified squamous epithelium at 1 month after penial reconstruction. This alternative epithelium gradually proliferated and thickened in the following 2 months. Retrograde urethrogram of two groups showed that anastomotic stenosis existed in the early postoperative stage but gradually mitigated as times went on. There was no obvious difference between two groups on urethral stricture and urinary fistula. However, because of the hair growth in the reconstructed urethra, there were 6 cases with urinary stones in the control group, which was obviously different from the experimental group without occurrence (P<0.05).ConclusionIt is feasible to use the with appendiceal mucous membrane in penial reconstruction. To avoid the complications of urethral stricture, we recommend that the time of urethral prefabrication of appendiceal mucous membrane should be adjusted according to the degree of urethral epithelial metaplasia.
Appendiceal mucous membrane; Urethral prefabrication; Penial reconstruction
R697;R318
A
1673-7040(2014)02-0117-05
2013-10-16)
上海市自然科学基金青年项目(10ZR1439200);上海市市级医院新兴前沿技术联合攻关项目(SHDC12010105)
200003 上海,第二军医大学附属长征医院 整形外科
朱 鴷(1981-),男,江苏东台人,主治医师,博士.
张盈帆,200003,第二军医大学附属长征医院 整形外科,电子信箱: tiger1182@126.com
10.3969/j.issn.1673-7040.2014.02.019

