利用14C标记技术测定海洋初级生产力的绉议
裴绍峰 , Edward A.Laws, 叶思源 , 袁红明 , 刘海月 , 丁喜桂 ,赵广明 , 杨士雄 , 王丽莎
(1.中国地质调查局滨海湿地生物地质重点实验室, 山东 青岛 266071; 2.国土资源部 海洋油气资源和环境地质重点实验室, 山东 青岛 266071; 3.青岛海洋地质研究所, 山东 青岛 266071; 4.Louisiana State University, School of the Coast & Environment, Department of Oceanography and Coastal Sciences, Baton Rouge, LA 70803, USA; 5.中国海洋大学 化学化工学院, 山东 青岛 266100)
海洋初级生产力是指海洋中初级生产者(主要是浮游植物)通过光合作用或化学合成生产有机物的能力或速率[1-2], 它是海洋生态系统中其他异养生物的生存基础, 并从根本上影响着全球生物地球化学循环[3]与气候变化[4]。研究表明, 海洋浮游植物通过光合作用不仅贡献了生物圈内的一半净初级生产力(以碳计约为 5×1013kg/a)[4], 提供了生态系统中其他有机体生长与新陈代谢所需要的初级有机物能源, 限制了整个生态系统的总生物量与生产力(包括渔产业[5]),控制了地球表面的总体生物能源流动[6-7]; 而且通过“生物泵”有效地将大气中的温室气体固化入海底,进而对全球气候起到调控作用[8]。因此, 海洋初级生产力的精确估算已成为各国研究活性有机体与无机碳库之间的碳循环、海洋固碳能力以及气候变化的重要枢纽[9-11]。
测定海洋初级生产力技术有多种, 包括在20世纪前半叶广泛使用的黑白瓶测氧法、后期发展起来的14C标记法、18O标记法、叶绿素法[12], 以及起源于20世纪70年代中期的遥感法和近期出现的三氧同位素(17Δ)技术[13-14]等。其中,14C标记法是目前为止最为经典与常用的初级生产力标准测试技术[4],由丹麦科学家 Steemann Nielsen[15]在 1952年提出,因其精确度高、操作简单、耗时短且费用低而迅速取代以往流行的黑白瓶测氧法, 被海洋学家与湖沼学家广泛采用[16-17]。我国学者[16,18-21]针对该方法也进行过深入探讨, 并将该方法广泛应用于对我国海域初级生产力和碳同化系数的测定[22-23]。
14C技术可简述为: 在水样培养瓶中加入示踪剂(NaH14CO3)后, 置于光照下培养; 水中浮游植物通过光合作用吸收同化环境中的无机碳, 并将其转化为有机物质; 一定时间后, 过滤出水样中颗粒有机物质, 并测定其14C放射性强度, 从而计算出在该环境下浮游植物的初级生产力。利用该技术, Steemann Nielsen[15]首次报道了在丹麦Galathea海洋调查中测定的初级生产力结果, 开启了精确测定海洋初级生产力的新纪元。该技术使得在全球不同区域测定的初级生产力结果更具有可比性, 为精确估算全球海洋初级生产力提供了技术支撑[4,24]。
1 技术问题及历史争议
虽然14C技术自出现后便迅速成为标准技术, 被全球广泛使用, 并基于此积累了庞大的数据库[4], 但一些争议也伴随出现, 如培养瓶的大小与材质、水样无污染采集技术及培养技术[17,19]、培养时间的长短等等[25]。然而, 这些问题并非14C技术所独有, 其他培养技术(如黑白瓶测氧法等)都会遇到类似问题。14C技术独有的争议问题是该技术究竟在测定净初级生产力、总初级生产力, 还是一个中间值[25-30]?
为更好地理解该争议问题, 在此先澄清几个基本概念。部分学者认为文献中使用的生产力(productivity)、生产量(production)或生产率(production rate)等术语是同义的[31], Falkowski[6]则在其专著《Aquatic Photosynthesis》中指出: 严格意义上讲, 生产力是包含时间尺度的, 相当于生产量在某一定时间内的变化率(production rate)。因此, 若仅考虑水体中以浮游植物为主体进行的光合作用, 初级生产力(primary productivity)等同于光合作用率(photosynthetic rate)。总初级生产力(gross primary productivity)指浮游植物在光合作用中生产有机碳的总速率。因浮游植物在光合作用同时, 一直在进行呼吸作用来为细胞活动提供所需能量, 导致部分有机碳会被消耗掉。总初级生产力减去呼吸作用率(respiration rate), 即为净初级生产力(net primary productivity, 等同于净光合作用率), 相当于浮游植物在单位时间、单位面积的有机碳净产量[31]。
而关于14C技术的争议和困惑, 并不仅仅源于对基本概念理解, 更源于我们对浮游植物细胞内部碳流动途径与模式、细胞生理特征与代谢机制的理解仍不透彻、不完整[32]。因此, 对14C技术争议的探讨过程, 也是科学家对浮游植物细胞活动、光合作用、呼吸作用[33]、有机碳释放[34]、营养盐限制、光照效应[35-36]、捕食效应[25]、昼夜循环[37]等基础概念不断加深理解的过程。那么14C技术争议是如何产生的呢?
早期, Ryther[29]在《Nature》上报道了一个有趣的分批培养实验: 他用14C均匀标定了杜氏藻(Dunaliella euchlora)的培养液, 然后将被标定的藻细胞再悬浮于不含14C的新培养液中, 均分为两份分别置于光照下与黑暗中继续培养。结果发现, 光照下的细胞在随后数天内并没有丢失14C放射性活度, 但黑暗中的细胞却几乎每天丢失 20%的14C活度。Ryther[29]提出一个假设机制, 即“最新呼吸碳的再固定机制”。基于该机制, Ryther推断14C技术测定的是净光合作用率, 即净初级生产力。
无独有偶, Steemann Nielsen[38]也进行了一个类似实验, 却得到了不同的结果。当被14C均匀标定的蛋白核小球藻(Chlorella pyrenoidosa)细胞被再悬浮于不含14C的新培养液中并在光照下培养时, 细胞中14C放射性活度减少了一部分, 尽管其减少率并不如经相同处理后培养在黑暗中的细胞。基于此, Steeman Nielsen认为14C技术测定的是位于净光合作用率与总光合作用率之间的一个值。
两个类似实验得出的截然不同的结论, 引发了关于14C技术究竟测定什么的历史性争议[27]。随后,Ryther[28]的研究表明: 尽管没有校正呼吸作用、暗吸收作用以及同位素差异,14C测定的碳固化率与细胞内颗粒碳的净增长率等同。Ryther[39]对衣藻(Chlamydomonas)进行的分批式培养表明, 无论指数生长情况下还是营养盐匮乏条件下, 用14C测定的光合作用率都很好地吻合用黑白瓶测氧法测定的净光合作用率。Bunt[40]通过用质谱仪测定氧的变化, 发现光照下呼吸作用率降低至黑暗中的 25%, 并认为如果溶解有机碳的释放可以忽略,14C技术测定的是净光合作用率。但是, Steemann Nielsen[41]通过比较使用14C与测氧法获得的磷或氮元素匮乏条件下藻类光合作用率数据, 却得出与Ryther与Bunt等不同的结论, 他认为在矫正呼吸作用率后,14C测定结果与总光合作用率相当。
与此同时, 诸多其他科研工作者也为解决此争议而进行了相关研究[27], 热论持久不衰。Peterson[27]在1980年的综述中, 对与该争议相关的诸多研究进行了详细评述, 但受限于对光抑制作用、光呼吸作用(photorespiration, 这是18O和14C标记技术的共存问题)、暗呼吸作用、细胞内碳循环机制等基础过程的理解, 所以关于14C测定结果的争议在当时未成定论。
2 解决争议过程中不同测定方法的差异比较
自20世纪80年代至今, 科学家针对14C的争议问题进行了更多其他研究, 这些研究既包括实验室测试, 也包含野外原位培养, 并且与多种其他方法测定结果进行了比较[30], 除测氧法外, 比较常见的是18O标记法和17Δ技术。18O标记法在原理上类似14C方法, 通过标记氧元素来测定光合作用产氧量, 进而计算光合作用率; 但不同于14C方法, 由于在培养过程中18O几乎不受呼吸作用影响, 该法测定的是总光合作用率[42]。17Δ技术是一种非培养技术, 类似的, 由于呼吸作用对17Δ代表的三氧同位素体系影响微乎其微,该技术测定结果往往也近似于总光合作用率[14]。
基于全球海洋通量联合研究(JGOFS)公开发表的数据, Marra[43]比较了18O标记所测的总光合作用率与14C标记测定的结果, 发现后者低于前者, 且14C测定结果更接近净群落生产力。Laws等[25]则比较了在Arabian海洋调查中基于14C所测的光合作用率与基于测氧法、18O标记所测的总光合作用率, 并通过光深计算了14C测定结果与总光合作用率的比值; 在综合考虑Mehler反应、光呼吸作用、暗呼吸、细胞分泌、捕食作用与紫外线对测定技术的影响后,其模型预测14C测定结果与总光合作用率的比值可能为0.48。Bender等[35]也比较了全球海洋通量联合研究中利用14C测定的生产率与利用测氧法试管培养测定的新生产率, 认为24小时14C标记培养所得生产率约占测氧法所测总碳生产率的 45%。考虑到Mehler反应、光呼吸作用、细胞分泌和群落线粒体呼吸作用的影响, 该差别似乎与实际相符。
Aristegui等[44]则发现在南极半岛附近沿岸表层水域, 用14C技术测定的水体每日总颗粒固碳量低于用测氧法同时测定的净群落生产量 29%~54%。2002~2003期间在夏威夷海洋时间序列(HOT)站点4次巡航调查中, Juranek[45]发现:18O同位素试管培养测定的总初级生产力(0~100 m水深)平均是14C测定的初级生产力的1.5倍。而2006~2008年间, Quay等[13]在北太平洋 ALOHA时间序列站点分别利用培养方法(14C与18O标记)和非培养方法(17Δ技术)测定了海洋初级生产力, 并进行了对比研究, 发现在可见光层(0~200 m水深),17Δ技术与18O标记所测的总光合作用率约为14C所测结果的 2~3倍。值得注意的是17Δ技术目前本身还有一定的不确定性[14], 其测定结果比18O标记所测结果高出 25%~60%甚至更多, 因此, 利用该技术对比14C结果的思路仍待探讨。
可见, 目前大部分对比试验结果似乎倾向于表明:14C标记技术所测结果低于总初级生产力。但即便如此,14C标记技术能否精确测定净初级生产力仍然是个未知问题; 如果14C测定结果高于净初级生产力, 这种偏离能有多少?如果基于此类数据来校正卫星遥感计算模式并在全球尺度上评估海洋初级生产力, 最终会导致怎样的误差?目前, 仍未有明确结论[30]。
综上可见, 关于14C技术究竟在测定净初级生产力、总初级生产力还是一个中间值的问题, 一直是海洋初级生产力研究中的争论焦点。受限于对浮游植物细胞内部碳流动途径与模式的认知、分析仪器的精度、和测试手段的局限等多种因素, 直至目前, 该争议问题仍未得到一个毫无疑义的、总结性的答案。所以, 对该争议的探讨反复出现在国内外各种专著[6,46]、教课书[47]和科技文献中。
3 解决争议的可行性假设
时至今日, 最有希望深入研究或解决14C技术争议问题的一个探讨模式仍然是由Ryther在1956年首次提出的藻细胞“最新呼吸碳的再固定机制”[25-26,30]。正如Marra[43]所述: “接受最新呼吸碳的再固定机制可以解释14C技术中的大多数理解问题, 且不需要对呼吸碳的损失做特别的解释。”Williams等[32]针对中肋骨条藻(Skeletonema costatum)的研究表明14C标定POC和 DOC生产率接近净光合作用率, 该结果与Ryther提出的呼出CO2被100%循环吸收的机制一致。
图1 A为Marra[26]近期提出的一个关于“最新呼吸碳的再固定机制”的示意图。在藻细胞中, 从线粒体呼出的 CO2并未立即被排出细胞外, 而是被细胞内的叶绿体再次吸收, 重新进入光合作用循环中。如果该机制确实存在, 那么利用14C标记所测的光合作用率与利用18O标记所测的总光合作用率[6]将有必然的差异, 因为在光合作用中, 一部分 CO2可以在细胞中被重复利用, 而 O2则不可以, 这必然会导致细胞内碳吸收与氧释放的不平衡。
Pei和Laws[30]则扩展了Marra[26]示意图的适用范围, 提出了图1 B, 并用数学模型解释了Ryther的“最新呼吸碳的再固定机制”。由于浮游植物中很多物种并不具备细胞器(如叶绿体和线粒体等)的原核细胞(如蓝细菌等), 因此图1B的适用范围更大。在该图中,P是指在光合作用中浮游植物细胞吸收无机碳的效率。细胞中的有机碳经呼吸作用后, 或者被排出细胞(即R表示有机碳释放效率), 或者在细胞内循环并重新进入光合作用(即R′)。因此, 总光合作用率等于P+R′, 而净光合作用率等于P–R。那么, 细胞对无机14C的净吸收效率则可用如下公式表示:
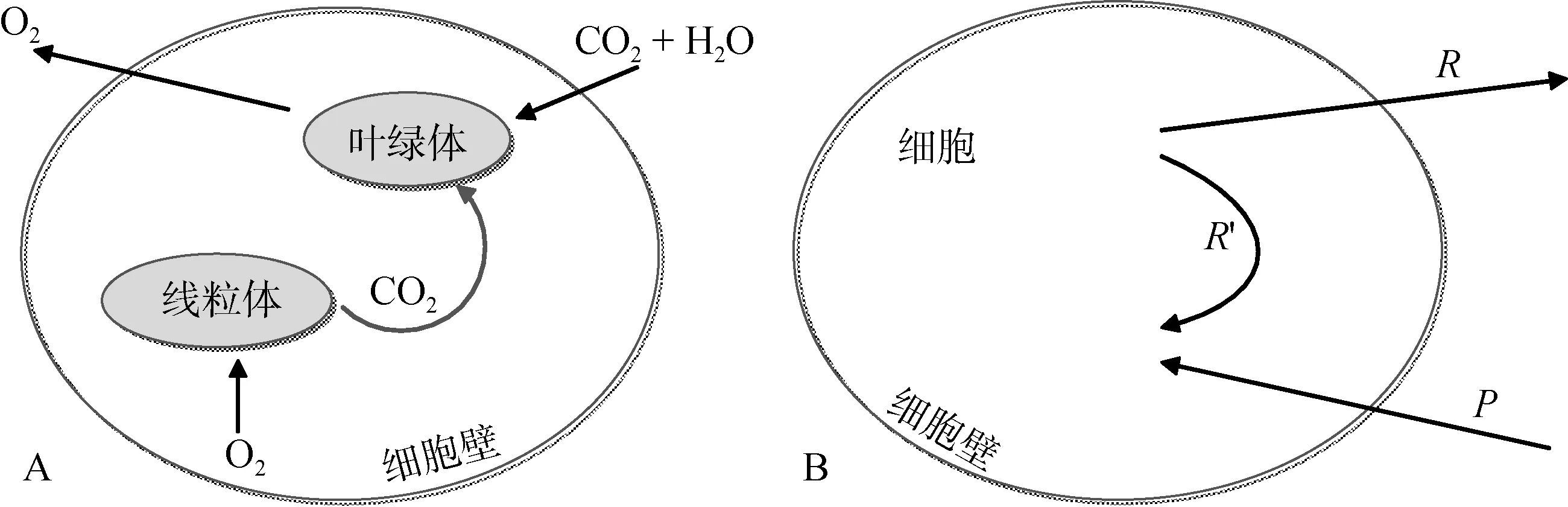
图1 浮游植物细胞光合作用与呼吸作用概念模型简图
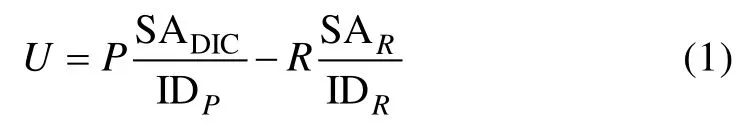
式中U是指净14C吸收率, SADIC是指环境中溶解无机碳(DIC)的比活度, SAR是被呼出细胞外的那部分碳的比活度; 而IDP与IDR则分别为光合作用与呼吸作用的碳同位素判别因子(isotope discrimination factor), 用来对比活度进行修正。因此, 被光合作用同化入细胞的碳比活度在修正后为 SADIC/IDP, 而被呼出细胞外的碳比活度则是 SAR/IDR; IDP一般为1.05。14C技术测定的光合作用率等于公式(1)右侧除以SADIC/IDP, 因此, 计算所得光合作用率(U′)为:
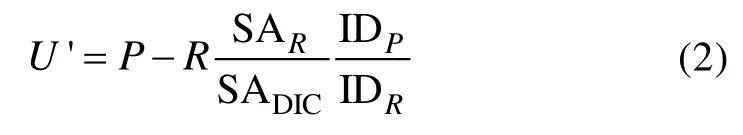
如果公式(2)中的R=0, 即图1 B中所有被呼吸作用释放出的碳都在细胞内循环, 并再次进入光合作用; 或者SAR/IDR=SADIC/IDP, 即被呼出细胞外的碳与被同化入细胞中的碳具有相同的比活度, 公式(2)计算所得的将是净光合作用率(P–R)。SAR/IDR=SADIC/IDP暗示所有被细胞呼出体外的碳其实都是Ryther[29]实验中的“新”碳, 即先前溶液中被14C均匀标定的碳。而Ryther[29]当时也是基于与此类似的推理, 而得出14C技术测定净光合作用率的推断。
否则, 如果R′=0, 即所有被呼吸作用释放出的碳都脱离了细胞, 并且 SAR=0, 即所有被呼出的碳是“旧”碳(指 Ryther[29]实验中原本就存在于细胞中且未被14C标定过的那部分碳), 那么公式(2)计算所得的将是总光合作用率。
然而, Ryther所提出的“最新呼吸碳的再固定机制”目前尚未被完全认可, 比如Dring和Jewson[48]曾拒绝了该假设, 并且该机制也不能解释 Williams等[49]和Grande等[50]在船上进行培养后所测的结果。在最近的研究中, Halsey等[51-52]的实验结果也并不完全支持该机制, 他们监测了一系列生长率被硝酸盐限制的杜氏盐藻(Dunaliella tertiolecta)稳态培养, 发现高生长率(1.2 d–1)下细胞中14C标定的碳水化合物固化效率比低生长率(0.12 d–1)高出5倍; 被细胞固定的“新碳”在参与呼吸作用后, 并未进入再循环体系,而是被释放至环境中, 且“新碳”在细胞中的停留时间与生长率有关。
因此, 关于“最新呼吸碳的再固定机制”仍存在争议, 尚未行成定论。而某些其他过程也可能会导致测试结果的不一致性, 如溶解有机物的释放[53]、最新固碳与旧碳的不同新陈代谢途径[43]、培养时间与呼吸作用的影响[25]等等。
4 最新研究进展
在近期的研究中, 利用恒化器进行连续培养成为解决14C技术争议问题的一个值得探索的思路, 因为该套设置能够在实验室精确控制光照、温度、营养盐补给或限制、细菌干扰等环境因素, 可以通过重复测定细胞颗粒有机碳、溶解有机碳等参数, 利用数学模型对藻细胞生长情况进行高精确度的评估[30,54-56]。如 Halsey等[51,52]利用恒化器针对杜氏盐藻Dunaliella tertiolecta进行了多次硝酸盐限制条件下的连续培养, 其结果表明对14C测定结果的解释应取决于浮游植物的生长率与培养时间的长短。随后, Halsey等[57]将该藻种与海洋硅藻Thalassiosira weissflogii进行了比较研究, 并发现了类似的规律, 即细胞中新形成的有机碳产物存在细胞中的时间与细胞生长率大小呈正相关性;14C标记在较短的培养期内倾向于测定总初级生产力, 而随着培养时间增长,14C标记将倾向于测定净初级生产力。但是, 目前他们仅测定了众多浮游植物中的两个藻种, 其结论是否适用于其他藻种仍不明确。
Pei和Laws[30]近期对Ryther的分批培养实验进行了优化和改进, 并以此对 7种常见藻种进行了研究, 从中鉴定出具有不同碳呼吸模式的两种典型藻种—球等鞭金藻(Isochrysis galbana)和凯氏小球藻(Chlorella kessleri)。根据Ryther的“最新呼吸碳的再固定机制”初步推测14C技术能准确测定前者的净初级生产力, 但高估后者的净初级生产力; 该推测在随后的连续培养实验中得以证实。其初步研究结果表明藻类的物种组成、生长率以及不同藻种细胞的呼吸作用与光合作用比值对判断14C测定结果有显著影响。在机理的解释上, Pei和Laws[30]将Ryther的“最新呼吸碳的再固定机制”, 与 Halsey等[51,52]提出的生长率影响机制结合起来, 从而推断出14C标记技术倾向于高估呼吸作用与光合作用比值较高的藻种细胞的净初级生产力。
随后, Pei和Laws[58]继续对以上两种具有不同碳呼吸模式的典型藻种开展了昼夜循环培养, 并以硝酸盐作为控制生长率的限制因子。发现在高生长率下,14C标记所获得的有机碳生产率与对照方法所揭示的实际生产率相当; 但在低生长率下,14C标记结果显著高估了有机碳生产率, 尤以凯氏小球藻更为明显。在昼夜24 h培养后14C标记结果与实际生产率偏离程度比白昼培养结果更为显著; 由于浮游植物细胞在夜间呼吸作用所消耗的有机碳仅有约73%源于日间的光合作用,14C标记方法估算的有机碳暗夜呼吸作用率低于对照方法所揭示的实际呼吸作用率。Pei和Laws[58]初步推测浮游植物细胞在不同生长率下胞内呼吸碳的循环效率差异可能是导致14C标记结果偏离率受生长率影响的原因, 而黑暗条件下呼吸碳组分和光照条件下胞内呼吸碳循环效率则可能对昼夜循环后14C标记结果高估实际生产率的程度造成影响。
但是, Pei和Laws[30]目前仅研究了自然界众多藻种中的很小一部分, 藻种分布亦不能囊括全球主要海域和湖泊。因此, 为彻底解决14C技术中的争议问题, 未来需要对更多的藻种进行系统研究, 同时需要将室内可控性培养结果与野外实际培养结果进行统计学上的对比。毫无疑问, Pei和Laws[30]将分批培养与连续培养实验相结合的思路在解决14C争议问题上极具可行性和潜力。
5 研究展望
关于14C技术究竟在测定什么的争议, 持续了半个多世纪仍未能解决[26,30], 但诸多海洋与湖沼学家为解决该问题而不懈努力。这不仅因为14C技术具有诸多优点, 更因为半个多世纪以来, 科学家已花费大量时间和资源利用14C技术在全球范围内成千上万的区域测定了海洋初级生产力[24], 并构建了庞大的海洋初级生产力数据库[59]。这些数据正在被用来校正卫星遥感计算模式[60-62], 在全球尺度上评估海洋初级生产力, 进而研究其对全球碳循环以及气候变化的影响[45]。在大多数情况下,14C技术的这些不确定性(包括对测定结果的解释)会在测定初级生产力时导致两倍以内的误差, 但如今全球遥感推断和生物模型校验都需要将该误差控制在20%~50%之内[32]。
此外, 考虑到时至今日乃至将来很长一段时间,14C技术仍是诸多测定初级生产力技术中不可替代的“标准方法”[4], 探讨、解决14C技术相关的争议问题, 极具科学与现实意义。而且, 对此问题的研究可加深我们对浮游植物细胞内部生理特征与代谢机制的理解[52], 有助于深入分析营养盐限制[63-66]、光照效应[35]、捕食效应[25]、昼夜循环[37]等环境条件对浮游植物生长率及固碳效率的影响, 从而更好地理解水域微生态结构, 探索其在全球碳循环与气候变化中的影响[4, 67-69]。
可以预见, 对14C技术争议的探讨仍将是今后海洋学与湖沼学研究热点之一。随着分析仪器和测试技术的不断提高, 将14C标记技术测定结果与其他技术进行系统比较可能会成为一种比较流行的研究模式, 比如Pei和Laws[30]与Halsey等[51,52]所使用的恒化器连续培养技术, 或者与经过改进后的高精度黑白瓶测氧法[32]、18O标记技术[13]、17Δ技术[14]等进行比较。
[1]李冠国, 范振刚.海洋生态学[M].北京: 高等教育出版社, 2004.
[2]阎希柱.初级生产力的不同测定方法[J].水产学杂志, 2000, 13(1): 81-86.
[3]杨东方, 高振会, 陈豫, 等.硅的生物地球化学过程的研究动态[J].海洋科学, 2002, 26(3): 39-42.
[4]Chavez F P, Messie M, Pennington J T.Marine primary production in relation to climate variability and change[J].Annual Review of Marine Science, 2011, 3: 227-260.
[5]Chassot E, Bonhommeau S, Dulvy N K, et al.Global marine primary production constrains fisheries catches[J].Ecology Letters, 2010, 13(4): 495-505.
[6]Falkowski P G, Raven J A.Aquatic Photosynthesis[M]//2 ed.Princeton, N J.USA: Princeton University Press,2007.
[7]孙军, 刘冬艳, 柴心玉, 等.1998-1999年春秋季渤海中部及其邻近海域叶绿素 a浓度及初级生产力估算[J].生态学报, 2003, 23(3): 517-526.
[8]Arrigo K R.Carbon cycle: Marine manipulations[J].Nature, 2007, 450(7169): 491-492.
[9]Behrenfeld M J, O’Malley R T, Siegel D A, et al.Climate-driven trends in contemporary ocean productivity[J].Nature, 2006, 444(7120): 752-755.
[10]Klein P, Lapeyre G.The oceanic vertical pump inducedby mesoscale and submesoscale turbulence[J].Annual Review of Marine Science, 2009, 1: 351-375.
[11]傅明珠, 王宗灵, 李艳, 等.胶州湾浮游植物初级生产力粒级结构及固碳能力研究[J].海洋科学进展,2009, 27(3): 357-366.
[12]孙晓霞, 孙松, 张永山, 等 胶州湾叶绿素a及初级生产力的长期变化[J].海洋与湖沼, 2011, 42(5): 654-661.
[13]Quay P D, Peacock C, Bjorkman K, et al.Measuring primary production rates in the ocean: Enigmatic results between incubation and non-incubation methods at Station ALOHA[J].Global Biogeochemical Cycles,2010, 24: 1-14.
[14]Juranek L W, Quay P D.Using triple isotopes of dissolved oxygen to evaluate global marine productivity[J].Annual Review of Marine Science, 2013, 5(1):503-524.
[15]Steemann Nielsen E.The use of radio-active carbon(14C) for measuring organic production in the sea[J].Journal du Conseil, 1952, 18(2): 117-140.
[16]李永祺.用14C法测定海洋初级生产力[J].海洋科学,1982, 6(6): 51-55.
[17]Laws E A.Evaluation of in situ phytoplankton growth rates: a synthesis of data from varied approaches[J].Annual Review of Marine Science, 2013, 5(1):247-268.
[18]张世强.海洋初级生产力现场测量技术研究[C]//中国科协.中国科协2004年学术年会14分会论文集.三亚: 中国科协, 2004.
[19]彭兴跃, 洪华生, 王海黎, 等.14C标记现场测定海洋初级生产力培养方法比较[J].台湾海峡, 1997, 16(1):67-74.
[20]孙军.海洋生物的初级生产力[C].相建海.中国国情系列丛书——中国海情.北京: 开明出版社, 2003:197-215.
[21]彭作圣, 李丕廉, 费修绠.14C安瓿的封装技术[J].海洋与湖沼, 1964, 6(4): 434-436.
[22]吕瑞华, 夏滨, 李宝华, 等.渤海水域初级生产力 10年间的变化[J].黄渤海海洋, 1999, 17(3): 80-86.
[23]焦念志, 王荣, 李超伦.东海春季初级生产力与新生产力的研究[J].海洋与湖沼, 1998, 2: 135-140.
[24]Behrenfeld M J, Falkowski P G.Photosynthetic rates derived from satellite-based chlorophyll concentration[J].Limnology and Oceanography, 1997, 42(1): 1-20.
[25]Laws E A, Landry M R, Barber R T, et al.Carbon cycling in primary production bottle incubations: inferences from grazing experiments and photosynthetic studies using14C and18O in the Arabian Sea[J].Deep-Sea Research, 2000, 47(7-8): 1339-1352.
[26]Marra J.Net and gross productivity: weighing in with14C[J].Aquatic Microbial Ecology, 2009, 56(2-3):123-131.
[27]Peterson B J.Aquatic primary productivity and the14C-CO2method: a history of the productivity problem[J].Annual Review of Ecology and Systematics, 1980,11: 359-385.
[28]Ryther J H, Menzel D W.Comparison of the14C-technique with direct measurement of photosynthetic carbon fixation[J].Limnology and Oceanography,1965, 10(3): 490-492.
[29]Ryther J H.Interrelation between photosynthesis and respiration in the marine flagellate,Dunaliella euchlora[J].Nature, 1956, 178(4538): 861-863.
[30]Pei S, Laws E A.Does the14C method estimate net photosynthesis? Implications from batch and continuous culture studies of marine phytoplankton[J].Deep Sea Research Part I: Oceanographic Research Papers,2013, 82(0): 1-9.
[31]沈国英, 黄凌风, 郭丰, 等.海洋生态学[M].第三版.北京: 科学出版社, 2010: 116-118.
[32]Williams P J L, Robinson C, Sondergaard M, et al.Algal14C and total carbon metabolisms.2.Experimental observations with the diatomSkeletonema costatum[J].Journal of Plankton Research, 1996, 18(10):1961-1974.
[33]Kliphuis A M J, Janssen M, van den End E J, et al.Light respiration inChlorella sorokiniana[J].Journal of Applied Phycology, 2011, 23(6): 935-947.
[34]刘诚刚, 宁修仁, 郝锵, 等.海洋浮游植物溶解有机碳释放研究进展[J].地球科学进展, 2010, 25(2):123-132.
[35]Bender M, Orchardo J, Dickson M L, et al.In vitro O2fluxes compared with14C production and other rateterms during the JGOFS Equatorial Pacific experiment[J].Deep-Sea Research, 1999, 46(4): 637-654.
[36]吴璟瑜, 商少凌, 洪华生, 等.浮游植物光吸收特性研究[J].海洋科学, 2006, 30(6): 77-81.
[37]Lacour T, Sciandra A, Talec A, et al.Diel variations of carbohydrates and neutral lipids in nitrogen-sufficient and nitrogen-starved cyclostat cultures of isochrysis sp.[J].Journal of Phycology, 2012, 48(4): 966-975.
[38]Steemann Nielsen E.The interaction of photosynthesis and respiration and its importance for the determination of14C-discrimination in photosynthesis[J].Physiologia Plantarum, 1955, 8(4): 945-953.
[39]Ryther J H.The ratio of photosynthesis to respiration in marine plankton algae and its effect upon the measurement of productivity[J].Deep Sea Research,1954, 2(2): 134-139.
[40]Bunt J.Measurements of photosynthesis and respiration in a marine diatom with mass spectrometer and with carbon-14[J].Nature, 1965, 207(5004): 1373-1375.
[41]Steemann Nielsen E, Kholy A A A.Use of14C technique in measuring photosynthesis of phosphorus or nitrogen deficient algae[J].Physiologia Plantarum,1956, 9(1): 144-153.
[42]Bender M, Grande K, Johnson K, et al.A comparison of four methods for determining planktonic community production[J].Limnology and Oceanography, 1987,32(5): 1085-1098.
[43]Marra J.Approaches to the measurement of plankton production[C].Williams P J l B, Thomas D N,Reynolds C S.Phytoplankton Productivity: Carbon Assimilation in Marine and Freshwater Ecosystems.Oxford, U.K.: Blackwell Science, 2002: 78-108.
[44]Aristegui J, Montero M F, Ballesteros S, et al.Planktonic primary production and microbial respiration measured by14C assimilation and dissolved oxygen changes in coastal waters of the Antarctic Peninsula during austral summer: implications for carbon flux studies[J].Marine Ecology-Progress Series, 1996,132(1-3): 191-201.
[45]Juranek L W, Quay P D.In vitroandin situgross primary and net community production in the North Pacific Subtropical Gyre using labeled and natural abundance isotopes of dissolved O2[J].Global Biogeochemical Cycles, 2005, 19(3): 1-15.
[46]Fahey T J, Knapp A K.Principles and Standards for Measuring Primary Production[M].Oxford, New York:Oxford University Press, 2007.
[47]Reynolds C S.The Ecology of Phytoplankton[M].New York: Cambridge University Press, 2006: 535.
[48]Dring M J, Jewson D H.What does14C uptake by phytoplankton really measure? A theoretical modeling approach[J].Proceedings of the Royal Society of London Series B-Biological Sciences, 1982, 214(1196):351-368.
[49]Williams P J L, Heinemann K R, Marra J, et al.Comparison of14C and O2measurements of phytoplankton production in oligotrophic waters[J].Nature,1983, 305(5929): 49-50.
[50]Grande K D, Williams P J L, Marra J, et al.Primary production in the North Pacific gyre: a comparison of rates determined by the14C, O2concentration and18O methods[J].Deep-Sea Research, 1989, 36(11):1621-1634.
[51]Halsey K H, Milligan A J, Behrenfeld M J.Linking time-dependent carbon-fixation efficiencies inDunaliella tertiolecta(Chlorophyceae) to underlying metabolic pathways[J].Journal of Phycology, 2011, 47(1):66-76.
[52]Halsey K H, Milligan A J, Behrenfeld M J.Physiological optimization underlies growth rate-independent chlorophyll-specific gross and net primary production[J].Photosynthesis Research, 2010, 103(2):125-137.
[53]Teira E, Pazo M J, Serret P, et al.Dissolved organic carbon production by microbial populations in the Atlantic Ocean[J].Limnology and Oceanography, 2001,46(6): 1370-1377.
[54]Laws E A, Pei S, Bienfang P, et al.Phosphate-limited growth and uptake kinetics of the marine prasinophyteTetraselmis suecica(Kylin) Butcher[J].Aquaculture,2011, 322-323(0): 117-121.
[55]Laws E A, Pei S F, Bienfang P, et al.Phosphate-limitedgrowth ofPavlova lutheri(Prymnesiophyceae) in continuous culture: determination of growth rate limiting substrate concentrations with a sensitive bioassay procedure[J].Journal of Phycology, 2011,47(5): 1089-1097.
[56]Laws E A, Pei S F, Bienfang P.Phosphate-limited growth of the marine diatomThalassiosira weissflogii(Bacillariophyceae): evidence of non-monod growth kinetics[J].Journal of Phycology, 2013, 49(2): 241-247.
[57]Halsey K H, O’Malley R T, Graff J R, et al.A common partitioning strategy for photosynthetic products in evolutionarily distinct phytoplankton species[J].New Phytologist, 2013, 198(4): 1030-1038.
[58]Pei S F, Laws E A.Does the14C method estimate net photosynthesis? II.Implications from cyclostat studies of marine phytoplankton[J].Deep Sea Research Part I:Oceanographic Research Papers, 2014, 91(0): 94-100.
[59]Barber R T, Hiking A K.History of the study of plankton productivity[C].Williams P J lB, Thomas D N,Reynolds C S.Phytoplankton Productivity: Carbon Assimilation in Marine and Freshwater Ecosystems.Oxford, U.K.: Blackwell Science, 2002: 16-43.
[60]Carr M E, Friedrichs M A M, Schmeltz M, et al.A comparison of global estimates of marine primary production from ocean color[J].Deep-Sea Research,2006, 53(5-7): 741-770.
[61]商少凌, 洪华生.海洋初级生产力模式与遥感应用研究进展[J].厦门大学学报(自然科学版), 2001, 40(3):647-652.
[62]官文江, 何贤强, 潘德炉, 等.渤、黄、东海海洋初级生产力的遥感估算[J].水产学报, 2005, 29(3):367-372.
[63]沈艳玲, 张洪, 马兴, 等.渤海湾无机氮、活性磷酸盐的变化对海洋初级生产力(叶绿素)的影响[J].中国环境监测, 2004, 20(1): 52-54.
[64]裴绍峰, 沈志良.长江口上升流区营养盐动力学及其对富营养化的影响[C]//俞志明, 沈志良, 陈亚瞿, 等.长江口水域富营养化.北京: 科学出版社, 2011: 323-336.
[65]裴绍峰, 沈志良.长江口上升流区营养盐的分布及其通量的初步估算[J].海洋科学, 2008, 32(9): 64-75.
[66]栾青杉, 孙军, 宋书群, 等.长江口夏季浮游植物群落与环境因子的典范对应分析[J].植物生态学报,2007, 31(3): 445-450.
[67]殷建平, 王友绍, 徐继荣, 等.海洋碳循环研究进展[J].生态学报, 2006, 26(2): 566-575.
[68]Gao K, Xu J, Gao G, et al.Rising CO2and increased light exposure synergistically reduce marine primary productivity[J].Nature Clim Change, 2012, advance online publication.
[69]Doney S C, Ruckelshaus M, Emmett Duffy J, et al.Climate change impacts on marine ecosystems[J].Annual Review of Marine Science, 2012, 4(1): 11-37.

