红霉素对生物膜内铜绿假单胞菌药敏的影响*
西电集团医院(西安710077) 孙安志 温红侠 王晓辉
铜绿假单胞菌(Pseudomonas aeruginosa,P.a)是有引起有基础病变患者社区获得性感染和医院获得性感染的重要条件致病菌。由于P.a易形成生物被膜(Biofilm,BF),因此该感染具有一定的难治性,且易转化为慢性感染,并对危重患者造成了一定的生命威胁。已有多项资料研究证明14、15元环大环内酯类抗生素如红霉素、阿奇霉素等可以抑制和破坏P.a BF的作用,阿奇霉素与其他有抗铜绿假单胞菌活性抗生素有协同作用。但亦有报道由于阿奇霉素的广泛使用,导致多重耐药菌株的产生[1]。但对红霉素(Erythromycin,EM)长期作用后BF内P.a的药物敏感性实验尚未见报道,因此本研究对EM在抑制BF形成的同时,是否影响BF内P.a药物敏感性进行探讨。
材料和方法
1 实验材料
1.1 将聚氯乙烯气管导管(上海景年医疗器械有限公司)制成1cm×1cm,经环氧乙烷灭菌备用。
1.2 菌株:PAO1由丹麦哥本哈根大学临床微生物科提供。质控菌株为P.a ATCC 27853,由广西医科大学一附院临床实验中心细菌室提供。
1.3 主要试剂:EM 标准粉剂(批号:130307-200215)均购自中国药品生物制品检验所。LB培养基和戊二醛(Sigma公司)。
2 研究方法
2.1 采用试管二倍稀释法测定EM对实验菌的最 低 抑 菌 浓 度 (Minimal inhibitory concentration,MIC):平行测定质控菌株ATCC 27853的 MIC作质量控制。
2.2 P.aBF模型的建立:采用文献[2]方法并改良。将培养过夜的PA01,调至0.5麦氏单位,再用生理盐水1∶200稀释,每试管加入5ml,每管置入灭菌BF载体1片,37℃培养24h后换液,以后每48h用50%LB换液。
2.3 抑制P.a生物膜形成实验:分为空白对照组、EM组。开始建模时,加入药物EM(1/8MIC)。于建模第7d采用连续稀释法[2]法行活菌计数,并于第3d、第7d行生物膜半定量测定,每组2个标本,每次测定均重复测定3次取平均值,另取分别1个标本行SEM观察,以上实验均独立重复3次。
2.4 BF细菌药敏实验:分别于建模3d和7d,生理盐水冲洗去掉载体表面浮游菌,载体置于2ml生理盐水,漩涡震荡,取生物膜细菌,然后参照[3]采用Kirby-Bauer(K-B)纸片扩散法行阿米卡星、美罗培南、哌拉西林、哌拉西林三唑坦、庆大霉素、舒普深、头孢吡肟、左氧氟沙星、环丙沙星、头孢他啶和氨曲南11种抗生素药敏实验。
2.5 SEM观察BF形成:灭菌生理盐水冲洗去掉浮游菌后用2.5%戊二醛固定,pH7.4的PBS漂洗3次,依次用50%、70%、80%、90%、100%酒精脱水,真空条件下镀金粉,SEM观察。
2.6 统计学方法:采用SPSS13.0,药物抑制P.a形成BF作用的细菌数和各药物组内不同作用时间的细菌存活数比较用单因素方差分析;P.a早期或成熟BF经药物作用后BF内细菌存活数比较用重复测量数据方差分析。
结 果
1 MIC EM 对P.a实验菌株及质控菌株ATCC 27853的 MIC均为128μg/ml。
2 抑制P.a BF形成实验
2.1 建模3d实验结果:SEM观察观察,空白对照组可见均匀、密布堆积的稀薄生物膜,可见细菌轮廓及细菌间黏液样物质。EM组可见散在的早期BF,分布较空白对照组稀疏。EM组载体表面生物膜半定量和空白对照组比较,经统计学分析,差异有显著性意义(P<0.01)。提示EM组载体表面形成的生物膜少于空白对照组。
2.2 建模7d后实验结果:SEM观察,空白对照组载体表面可见浓厚黏液样物质,菌体轮廓模糊不清,BF呈立体结构,而EM组仅见稀少的薄层生物膜。载体表面活菌计数结果显示EM组低于空白对照组(P<0.01)。载体表面生物膜半定量检测发现,EM组和空白对照组比较,经统计学分析,差异有显著性(P<0.01),提示EM组载体表面生物膜少于空白对照组。
3 EM对BF内细菌药敏影响的实验结果 经EM作用后,对所检测的抗生素均敏感,但和空白对照组比较,对于早期BF细菌,环丙沙星抑菌圈增大(P<0.05),头孢他啶和氨曲南抑菌圈亦增大(P<0.01),见表1。对于晚期BF细菌,头孢吡肟、环丙沙星和左氧氟沙星抑菌圈直径明显小于空白对照组(P<0.01),而头孢他啶组明显增大(P<0.05),见表2。
表1 红霉素干预3d后生物膜细菌的药敏实验结果(±s)
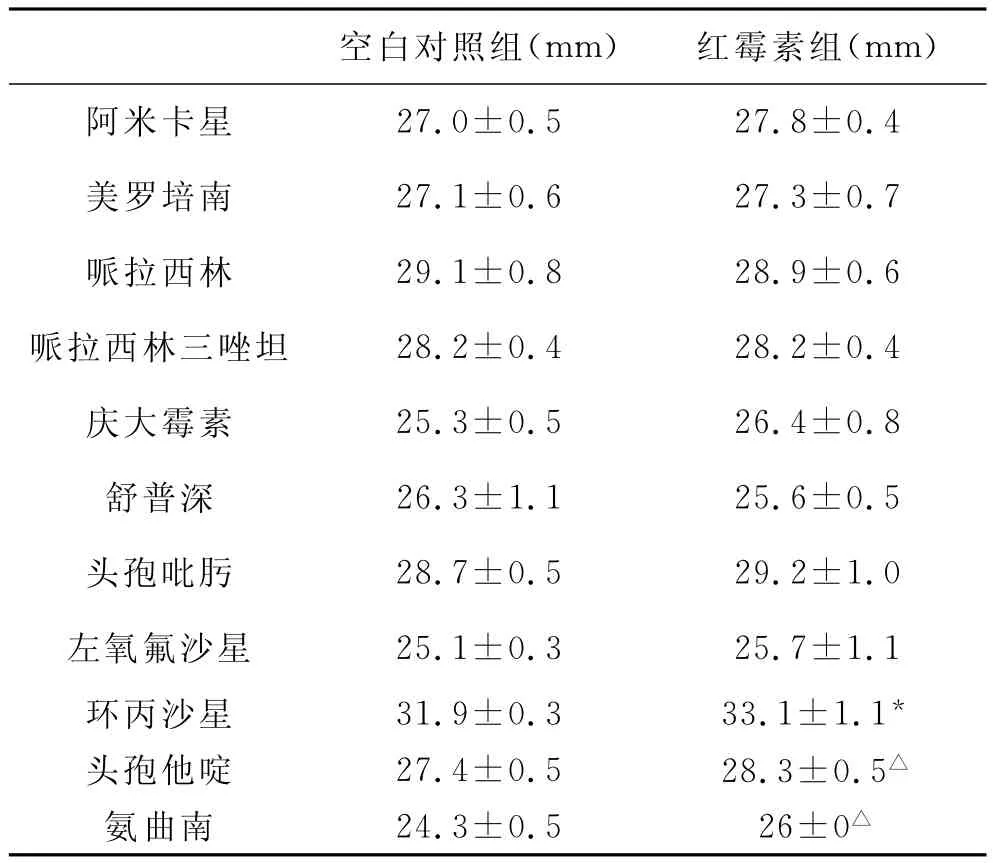
表1 红霉素干预3d后生物膜细菌的药敏实验结果(±s)
注:△与空白对照组比较,P<0.01,*与空白对照组比较,P<0.05
空白对照组(mm) 红霉素组(mm)27.0±0.5 27.8±0.4美罗培南 27.1±0.6 27.3±0.7哌拉西林 29.1±0.8 28.9±0.6哌拉西林三唑坦 28.2±0.4 28.2±0.4庆大霉素 25.3±0.5 26.4±0.8舒普深 26.3±1.1 25.6±0.5头孢吡肟 28.7±0.5 29.2±1.0左氧氟沙星 25.1±0.3 25.7±1.1环丙沙星 31.9±0.3 33.1±1.1*头孢他啶 27.4±0.5 28.3±0.5△氨曲南 24.3±0.5 26±0阿米卡星△
表2 红霉素干预7d后生物膜细菌的药敏实验结果(±s)
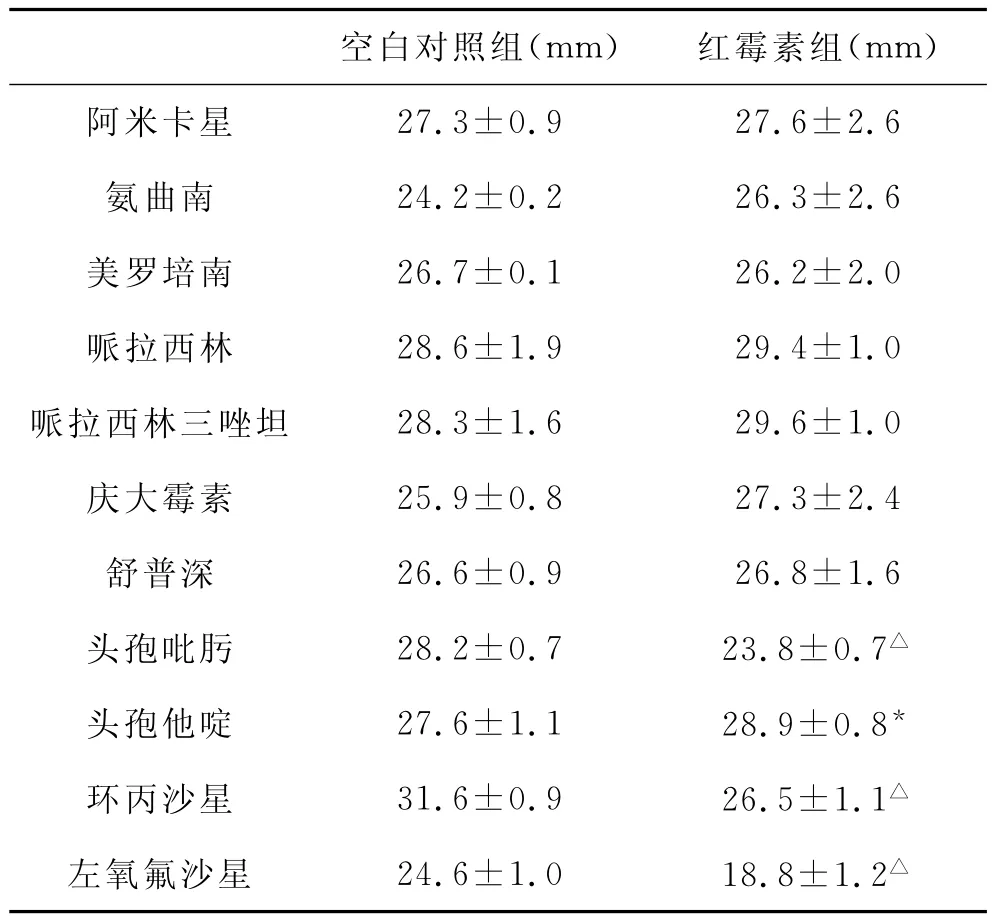
表2 红霉素干预7d后生物膜细菌的药敏实验结果(±s)
注:△与空白对照组比较,P<0.01,*与空白对照组比较,P<0.05
空白对照组(mm) 红霉素组(mm)27.3±0.9 27.6±2.6氨曲南 24.2±0.2 26.3±2.6美罗培南 26.7±0.1 26.2±2.0哌拉西林 28.6±1.9 29.4±1.0哌拉西林三唑坦 28.3±1.6 29.6±1.0庆大霉素 25.9±0.8 27.3±2.4舒普深 26.6±0.9 26.8±1.6头孢吡肟 28.2±0.7 23.8±0.7△头孢他啶 27.6±1.1 28.9±0.8*环丙沙星 31.6±0.9 26.5±1.1△左氧氟沙星 24.6±1.0 18.8±1.2阿米卡星△
讨 论
BF是细菌为适应自然环境、有利于生存而特有的生命现象,系指细菌吸附于惰性物体如生物医学材料或机体黏膜表面后,分泌多糖基质、纤维蛋白、脂蛋白等多糖蛋白复合物,形成网状立体结构,使细菌相互粘连并将其自身克隆聚集缠绕其中形成的膜样物。BF的形成和发展大致经历了粘附期、种殖期、生长期、成熟期、播散期几个时期。成熟的P.a生物膜由蘑菇样或柱样亚单位组成,每个亚单位又互相交错成网状,菌体之间互相粘连附着于网状结构的表面,外层系碳氢化合物被膜。P.a生物被膜这种特殊结构,坚实、稳定,作为一保护屏障,不易被破坏,保护细菌避免与抗生素和免疫攻击物接触。有报道[4]显示,由于细菌生物膜的立体结构,形成一定的渗透屏障,延缓了抗生素对BF的渗透。
目前研究显示十四(EM、罗红霉素、克拉酶素)、十五元环(阿奇霉素)的大环内酯抗生素能抑制藻酸盐合成的关键酶-GMD的活性,显著减少藻酸盐的合成,抑制BF的形成,临床实践也证实[5]:低剂量红霉素能改善支气管扩张并铜绿简单胞菌生物膜感染患者肺功能的急性加重的次数,但可能增加对大环内酯类抗生素的耐药性。但是对于其他抗生素的敏感性尚无报道。
本研究显示,在EM作用3d时,SEM观察发现载体表面仅形成散在、稀疏的早期BF,而空白对照组可见均匀、密布堆积的稀薄生物膜,可见细菌轮廓及细菌间黏液样物质。BF半定量测定发现,EM组明显少于空白对照组。EM作用7d后,EM组载体表面仅见稀少的薄层生物膜,而空白对照组载体表面可见浓厚黏液样物质,菌体轮廓模糊不清,BF呈立体结构。载体表面活菌计数结果显示EM组低于空白对照组。载体表面生物膜半定量检测发现,EM组载体表面生物膜少于空白对照组。以上研究结果显示,1/8MICEM可以抑制P.a生物膜的形成。
另有多项研究显示[6,7],亚抑菌浓度抗生素长期连续作用于P.a后,可诱发细菌耐药和交叉耐药产生。但是,目前尚未见到,关于长期连续使用亚抑菌浓度的EM对BF内P.a抗生素敏感性影响的相关报道。因此本实验就1/8MICEM连续作用3d和7d,在抑制P.a生物膜形成同时,是否会影响头孢他啶、左氧氟沙星、环丙沙星和氨曲南等11种抗生素对BF内P.a的敏感度进行探讨。
结果发现,根据参考文献[3],不论是早期还是晚期BF,空白对照组P.a对所检测的抗生素均敏感。单独应用敏感抗生素并不能完全清除BF内P.a,但是和能破坏BF的EM联合使用后,却产生良好的协同杀菌作用,该结果提示,BF对抗生素的渗透限制在细菌耐药方面有着重要的作用。
EM作用3d后,和空白对照组比较,对于早期BF细菌,环丙沙星抑菌圈直径增大,头孢他啶和氨曲南抑菌圈直径亦增大,其他抗生素抑菌圈直径大小无差异。但随着EM连续作用时间延长至7d时,尽管头孢吡肟、环丙沙星和左氧氟沙星依然对P.a敏感,但是所形成的抑菌圈直径却明显小于空白对照组。同时观察不同药物作用时间点的结果发现,其中环丙沙星抑菌圈直径由EM作用3d时的33.1±1.1mm,降低至作用7d时的26.5±1.1mm,左氧氟沙星抑菌圈直径由EM作用3d时的25.7±1.1mm,降低至作用7d时的18.8±1.2mm,头孢吡肟抑菌圈直径由EM作用3d时的29.2±1.0mm,降低至作用7d时的23.8±0.7mm。提示随着1/8MICEM作用时间的延长,环丙沙星、左氧氟沙星和头孢吡肟对P.a的敏感性呈下降趋势,并且以左氧氟沙星显著,甚至临近敏感标准(18mm)。但是头孢他啶抑菌圈直径较空白对照组明显增大,观察EM作用不同时间点抑菌圈的大小发现,头孢他啶抑菌圈直径由EM作用3d时的28.3±0.5mm,增大至作用7d时的28.9±0.8mm,尽管两组间差异无统计学意义,但仍有一定的增大趋势。
经分析以上结果显示,亚抑菌浓度EM可以抑制早期和晚期P.a生物膜形成的同时,随着药物作用时间的延长,EM使头孢他啶对P.a的抑菌圈有增大趋势,但却使环丙沙星、左氧氟沙星和头孢吡肟对P.a的敏感性呈下降趋势,并且以左氧氟沙星显著,甚至临近敏感标准(18mm)。
[1] Lutz L,Pereira DC,Paiva RM,et al.Macrolides decrease the minimal inhibitory concentration of anti-pseudomonal agents againstPseudomonas aeruginosa from cystic fibrosis patients in biofilm[J].BMC Microbiol,2012 ,8(12):196.
[2] Dong YH,Wang LH,Xu JL,et al.Quenching quorumsensing dependent bacterial infection by an N-acyl homoserine lactonase[J].Nature,2001,411:813-817.
[3] Brooun A,Uu SH,Lewis K.A dose-response study of antibiotic in Pseudomonas aeruginoda biofilms[J].Antimicrob A.Gents Chemother,2000,44:640-646.
[4] Wlters MC,Roe F,Bugnicout A,et al.Contributions of antibiotic penetration,oxygen limitation,and low metabolic activity to toleran ce of Pseudomonas aeruginosa biofilms to ciprofloxacin and tobramycin[J].Antimicrob A-gents Chemother,2003,47:317-323.
[5] Serisier DJ,Martin ML,Mc Guckin MA ,et al.Effect of long-term,low-dose erythromycin on pulmonary exacerbations among patients with non-cystic fibrosis bronchiectasis:the BLESS randomized controlled trial[J].JAMA,2013,309(12):1260-1267.
[6] 杨敬芳,郭 进.环丙沙星次抑菌浓度诱导铜绿假单胞菌耐药的实验研究[J].中国药师,2002,5(1):11-13.
[7] 陈 瑞,唐英春,朱家馨,等.亚抑菌浓度亚胺培南体外诱导铜绿假单胞菌耐药[J].中华医院感染学杂志,2005,15(2):131-133.

