胃癌淋巴结转移相关外周血MicroRNA分子标记物的临床价值*
郑君华,王永兵,顾天来,罗芸葆(上海市浦东新区人民医院普外科 201200)
>中国是胃癌高发区,特别是在农村地区,胃癌的总发病率在各类恶性肿瘤中居首位[1]。早期胃癌患者多无特异性症状,约三分之二的患者在确诊时便处于中晚期或出现转移[2]。影像学检查在微小病灶方面有一定的局限性[3]。而肿瘤标记物如癌胚抗原、糖链抗原(CA)72-4和CA19-9的异常一般在晚期胃癌患者中才能检出,且其阳性率不到50%[4]。MicroRNA(miRNA)在组织和细胞中的表达与肿瘤呈现显著的相关性、组织特异性和表达稳定性,并且在外周血中的表达与肿瘤中的表达具有一定的一致性[5]。目前已经证实,有5种血清miRNA(miR-1,miR-20a,miR-27a,miR-34和miR-423-5p)是胃癌的诊断标志物,且其表达水平与肿瘤的分期相关[6]。本研究选择hsa-miR-106a进行实时荧光定量聚合酶联反应(qRT-PCR)检测,评估hsa-miR-106a作为外周血中与胃癌淋巴结转移相关的分子标志物,用于临床胃癌筛查的应用前景。现将结果报道如下。
1 资料与方法
1.1 一般资料选取2010年5月至2012年12月本院普外科住院、术前行胃镜及病理检查确诊并行根治性手术治疗的80例胃癌患者为研究对象,其中男52例,女28例;年龄31~82岁,平均年龄(53.6±8.3)岁。将胃癌患者按照淋巴结转移数目分为N0组(无淋巴结转移)46例,其中男31例,女15例,平均年龄(56.0±13.2)岁;N3组(淋巴结转移大于7枚)34例,其中男21例,女13例,平均年龄(52.6±15.5)岁。并选取同一时期的体检健康者40例为健康对照组,其中男25例,女15例,平均年龄(47.2±11.2)岁。并做miRNA芯片检测。3组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 外周血miRNA的抽提及检测 分别采集研究对象3 mL全血,置乙二胺四乙酸盐(EDTA)抗凝管中,常温下1 500 r/min离心15min。将上层血浆(约1.5mL)转移到1.5mL无RNA酶的EP管中,-80℃冰箱保存备用。按照说明书步骤,用Ambion公司的mirVana miRNA Isolation Kit抽提外周血miRNA,并检测miRNA的质量。按照说明书上的步骤,采用FlashTag Biotin RNA Labeling Kit进行样品标记,再采用GeneChip miRNA 2.0进行miRNA检测。实验由博奥生物有限公司完成。
1.2.2 qRT-PCR检测 检测对象包括N0组46例、N3组34例,健康对照组40例。应用miRNA qRT-PCR引物试剂盒(美国AB公司)PCR扩增。先逆转录成熟的miRNA,反应结束后,将逆转录产物10倍稀释进行PCR反应。PCR体系为:TaqMan MicroRNA Assay 20×1.0μL,Product from RT reaction(Minimum 1∶10Dilution)2.0μL,TaqMan 2×Universal PCR Master Mix 10μL,Nuclease free water 7μL,总共20μL。95℃预变性10s;95℃变性5s,60℃退火延伸20s,重复40个循环,70~95℃绘制融解曲线结果分析以U6snRNA为内参,通过2-ΔΔCT法计算不同组之间hsa-miR-106a的表达差异。其中,ΔCt=Ct miRNA-CtU6,ΔΔCt=ΔCtM-ΔCt NM。实验重复3次。
1.3统计学处理 使用SPSS13.0统计软件进行统计分析,计量及计数资料分别采用±s或百分率表示,组间比较采用独立样本的t检验或χ2检验,以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结 果
2.1 miRNA芯片检测结果在N3、N0组胃癌患者中均明显上调的miRNA包括hsa-miR-16、hsa-miR-190、hsa-miR-101、hsa-miR-122、hsa-miR-149、hsa-miR-1、hsa-miR-20a;在N3、N0组胃癌患者中均明显下调的miRNA包括hsa-miR-148a、hsamiRPlus-C1110、hsa-miR-423-5p、hsa-miR-7、hsa-miR-877、hsamiR-185、hsa-miR-365;在N3组患者表达上调最为明显而在N0组患者中无明显变化的miRNA包括hsa-miRNA-218、hsamiR-106a、hsa-miR-103a、hsa-miR-130b、hsa-miR-141、hsa-miR-203、hsa-miR-222、hsa-miR-29b。其中hsa-miR-106a最符合作为分子标记物的条件。具体见表1。
表1 miRNA芯片检测N3组与N0组中miRNA表达情况(±s)

表1 miRNA芯片检测N3组与N0组中miRNA表达情况(±s)
?
续表1 miRNA芯片分析N3组与N0组中miRNA表达情况(±s)
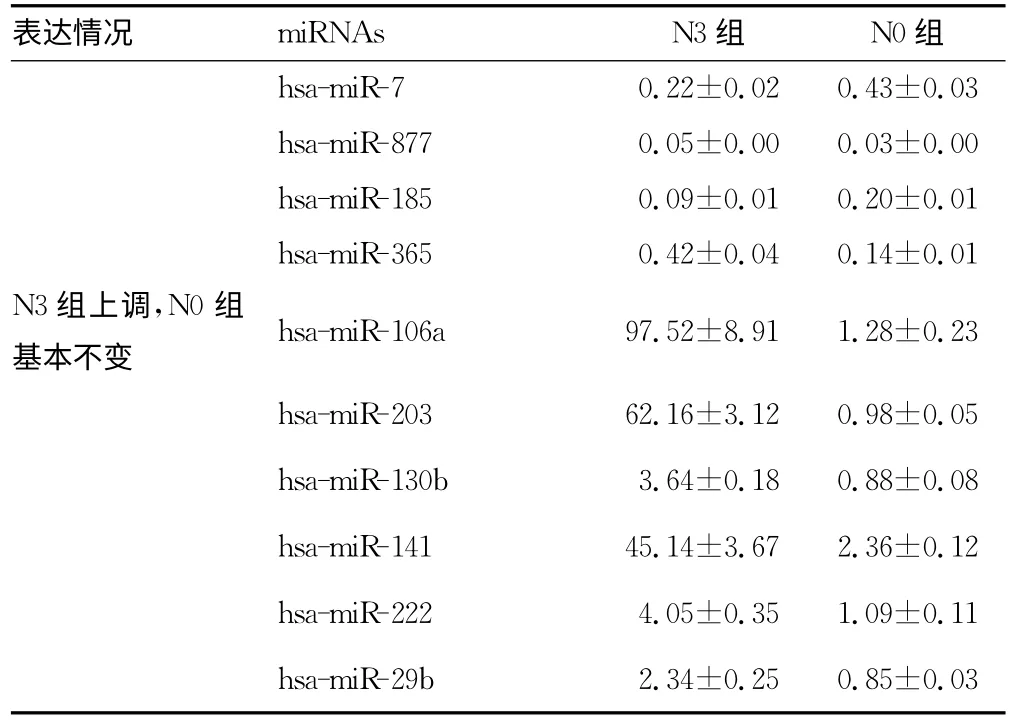
续表1 miRNA芯片分析N3组与N0组中miRNA表达情况(±s)
?
2.2 hsa-miR-106aqRT-PCR结果46例N0组胃癌患者、34例N3组胃癌患者及40例健康者外周血中hsa-miR-106a的表达情况分别见图1、图2、图3。N0组外周血hsa-miR-106a表达水平均值为(0.990±5.576),N3组外周血hsa-miR-106a均值为(-9.698±6.485),健康对照组均值为(-0.279±6.041)。经独立样本t检验分析,N3组的外周血hsa-miR-106a的表达水平与N0组及健康对照组比较显著上调,差异有统计学意义(P<0.05),但N0组与健康对照组之间外周血hsa-miR-106a的表达水平差异无统计学意义(P>0.05),见图4。

图1 N0组外周血中hsa-miR-106a的表达水平

图2 N3组外周血中hsa-miR-106a的表达水平

图3 健康对照组外周血中hsa-miR-106a的表达水平

图4 各组hsa-miR-106a表达水平比较
2.3 胃癌患者外周血hsa-miR-106a的表达与临床病理参数的关系hsa-miR-106a的表达水平除了与胃癌淋巴结转移有关外(P<0.05),与患者性别、年龄、肿瘤大小、部位、组织学类型、肿瘤类型及分化程度等均无关(P>0.05)。
3 讨 论
在不同肿瘤疾病中,miRNA具有特定的表达模式,这些特点在肝癌、肺癌、肠癌、卵巢癌和白血病等多种恶性肿瘤中得到了证实[7],也使miRNA成为肿瘤诊断的新生物学标记和治疗靶标。外周血miRNA在胃癌中的检测已有一些研究。例如通过生物芯片分析技术比较胃肿瘤组织miRNA和血浆miRNA,对hsa-miR-17-5p、hsa-miR-21、hsa-miR-106a、miR-106b和let-7a等外周血miRNA进行检测,发现血浆中miRNA的表达水平与大部分肿瘤组织miRNA的表达水平一致[8]。采用常规RNA提取方法便可以从血清中获得满足实验需要的miRNA,这也为外周血miRNA的临床检测奠定了基础。
本研究应用最新版本的miRNA生物芯片,筛选出几种具有较高差异表达水平的外周血miRNA胃癌标记物。这些miRNA在N3组表达上调,而在N0组基本不变,其中hsamiR-106a最符合作为分子标记物的条件。hsa-miR-106a定位于X染色体上,通常表达于由内胚层分化而来的组织干细胞中。通过序列搜索,已证实hsa-miR-106a潜在的目的基因超过700种,所表达的蛋白包括细胞周期调控蛋白、细胞凋亡调控蛋白、血管生成相关蛋白、肿瘤转移相关蛋白等。在乳腺癌转移研究中,发现层粘连蛋白5是基底膜的重要组成成分,而基底膜介导上皮细胞间的粘连。当层粘连蛋白5表达增加时,癌细胞转移减少。hsa-miR-106a的过表达可下调层粘连蛋白5的表达,从而刺激癌细胞的转移[9]。RB可与甲基化转移酶组成复合物行使甲基转移的功能。而RB和SUV420H1同时受hsa-miR-106a的负调控,在hsa-miR-106a的作用下表达降低,从而促进基因的低甲基化[10]。因此,本研究以hsa-miR-106a为研究对象,扩大标本量,通过qRT-PCR进行进一步的研究。经独立样本t检验分析,N3组的外周血hsa-miR-106a表达水平与N0组及健康对照组比较显著上调,差异有统计学意义(P<0.05),但N0组与健康对照组之间外周血hsa-miR-106a的表达水平差异无统计学意义(P>0.05)。这与Xiao等[11]研究中发现淋巴及远处转移的胃癌组织中hsa-miR-106a高表达相符。
胃癌的发病机制较为复杂,可能的病因包括幽门螺旋杆菌感染、环境因素以及遗传因素等[12]。传统的胃癌肿瘤标记物在特异性与敏感性的兼容性方面都不是特别理想。相比之下miRNA具有高度的保守性、时序性和组织特异性,PCR检测高灵敏度以及特异性引物的使用,使得miRNA兼容肿瘤诊断的特异性和敏感性成为可能。期望通过对hsa-miRNA-106a以及其他胃癌特异性miRNA的进一步研究,能为胃癌的预防、临床诊断和治疗开辟一条新的道路。
[1]Rifai N,Gillette MA,Carr SA.Protein biomarker discovery and validation:the long and uncertain path to clinical utility[J].Nat Biotechnol,2006,24(8):971-983.
[2]Lu J,Getz G,Miska EA,et al.MicroRNA expression profiles classify human cancers[J].Nature,2005,435(743):834-838.
[3]Lee YS,Dutta A.MicroRNAs in cancer[J].Annu Rev Pathol,2009,24(4):199-277.
[4]樊代明.肿瘤研究前沿[M].西安:第四军医大学出版社,2009:160-170.
[5]Alvarez-Garcia I,Miska EA.MicroRNA functions in animal development and human disease[J].Development,2005,132(21):4653-4662.
[6]Liu R,Zhang C,Hu Z,et al.A five-microRNA signature identified from genome-wide serum microRNA expression profiling serves as a fingerprint for gastric Cancer diagnosis[J].Eur J Cancer,2011,47(5):784-791.
[7]Zhou L,Zhao YP,Liu WJ,et al.Circulating microRNAs in Cancer:diagnostic and prognostic significance[J].Expert Rev Anticancer Ther,2012,12(2):283-288.
[8]Bartel DP.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[9]Mccave EJ,Cass CA,Burg KJ,et al.The normal microenvironment directs mammary gland development[J].J Mammary Gland Biol Neoplasia,2010,15(3):291-299.
[10]Tryndyak VP,Kovalchuk O,Pogribny IP.Loss of DNA methylation and histone H4lysine 20trimethylation in human breast Cancer cells is associated with aberrant expression of DNA methyltransferase 1,Suv4-20h2histone methyltransferase and methyl-binding proteins[J].Cancer Biol Ther,2006,5(1):65-70.
[11]Xiao B,Guo J,Miao Y,et al.Detection of miR-106ain gastric carcinoma and its clinical significance[J].Clin Chim Acta,2009,400(1/2):97-102.
[12]James GF,Timothy CW.Inflammation,atrophy and gastric cancer[J].J Clin Invest,2007,117(2):60-69.

