山东省紫椴遗传多样性AFLP分析
王东升,辛 红,邢世岩,李际红,刘晓静,吴岐奎
(山东农业大学林学院,山东泰安271018)
紫椴(Tilia amurensis Ruprecht)是椴树科(Tiliaceae)椴树属(Tilia L.)高大落叶乔木树种,用途广泛,经济价值高,为国家二级保护植物[1].由于对紫椴大规模采伐及其繁育困难,其数量逐年下降,许多优良种质资源消失,导致紫椴资源遗传多样性不断下降,遗传基础变得相对狭窄.目前对紫椴的研究主要集中在育种造林[2]、生态学[3]、木材结构[4]、优良无性系选择[5]等方面,在分子水平上的研究还不多.穆立蔷等[6]通过ISSR技术对紫椴6个种群125个个体进行多样性检测,结果表明总的多样性为93.85%,其具有较高的遗传多样性.刘赢男[7]通过ISSR分子标记技术对紫椴6个种群90个个体进行多样性检测,发现供试材料也具有较高的遗传多样性.林木基因资源是林木育种及林业可持续发展的物质基础,通过对紫椴进行遗传多样性分析,构建聚类树,以了解其系统发育,明确各种质资源间的亲缘关系,最大效率进行种质资源的收集保存.AFLP方法多样性高、重复性好[8],因此,本研究采用AFLP分子标记技术对山东省5个地区收集的紫椴进行遗传多样性和亲缘关系分析,以期为紫椴种质资源的评价、早期选育、保存与保护提供依据.
1 材料与方法
1.1 材料
于2012年5月上旬采集泰山后石坞(编号1-20)、崂山北九水(编号21-25)、鲁山雨林(编号26-30)、艾山南官山(编号31-42)、昆嵛山环山路(编号43-62)的野生紫椴的正常生长、无病斑嫩叶,作为供试材料,共62份.每份材料单株采集,单株间相距10 m以上.用装有变色硅胶的自封袋加以封存,封存过程中翻动2-3次,以保证叶片在12 h内达到完全干燥,用于DNA的提取.
1.2 试验方法
1.2.1 DNA制备 称取紫椴完全干燥叶片约50 mg,参照洪丕征[9]的CTAB法提取DNA.
1.2.2 AFLP体系的建立 酶切采用双酶切(PstⅠ和MseⅠ),与连接同时进行,加入DNA模板200 ng、1 μL Adapter(10 mmol·L-1.PstⅠ接头:5'> CTC GTA GAC TGC GTA CAT GCA < 3',5'> TGT ACG CAG TCT AC <3'.MseⅠ接头:5'> GAC GAT GAG TCC TGA G <3',5'> TAC TCA GGA CTC AT <3')、2 μL PstⅠ/MseⅠ(5 U·μL-1)、1 μL T4 Ligase(5 U·μL-1)等构建20 μL 反应体系.将此体系在37 ℃保温5 h,8℃保温4 h,4℃下过夜.
以2 μL 酶切连接后的 DNA 产物为模板,加入 1 μL 预扩引物(10 μmol·L-1,PstⅠ 5'> GAC TGC GTA CAT GCA G <3',MseⅠ 5'>GAT GAG TCC TGA GTA A C <3')、0.5 μL Taq 酶(2 U·μL-1)等,构建25 μL预扩增体系.PCR扩增程序为:在94℃预变性2 min,随后经过94℃变性30 s,56℃退火30 s,72℃延伸80 s,持续30个循环,之后72℃延伸5 min.
预扩产物稀释20倍后作为选扩模板,加入筛选出的10 μmol·L-1的PstⅠ引物和MseⅠ引物各1 μL,0.5 μL的Taq酶(2 U·μL-1)构建25 μL的选扩增体系.按以下列程序进行PCR扩增:94℃变性30 s,65℃退火30 s,72℃延伸80 s,进行第一轮扩增,以后每轮循环温度递减0.7℃,共扩增12轮;接着进行94℃变性30 s,55℃退火30 s,72℃延伸80 s,扩增23轮;然后72℃延伸5 min;最后将选扩增产物进行4%聚丙烯酰胺电泳,得到电泳图.
1.2.3 数据分析 电泳图经ABI 377 PRISM 377 sequencer测序仪检测片段大小,采用GENESCAN软件进行分析,扩增后清晰可辨的条带记为“1”,无带的记为“0”,构建“01”矩阵,以供下一步分析.利用POPGENE version 1.31软件计算多态带比例(PPB)、观测等位基因数(Na)、观测的有效等位基因数(Ne)、Nei's基因多样性(H)、Shannon's信息指数(I).采用NTSYSpc version 2.10e软件,得到相似系数SC矩阵.采用Dice系数非加权算术平均法(UPGMA)进行紫椴的聚类分析.
2 结果与分析
2.1 紫椴的AFLP分析
对9对多态性较好的引物进行扩增(图1),共获得1374个条带,其中1370条为多态带,平均多态带比率为99.70%(表1),平均每对引物产生152条多态带.引物不同则扩增效率不同.产生多态带数量最少的引物是P-GAA/M-CAA,共扩增出127条;产生多态带最多的引物是P-GAC/M-CAG,达171条.不同引物的多态带百分率为99.20%-100.00%,说明AFLP标记在所分析的紫椴资源中多态性较好,是检测紫椴遗传多样性的一种有效技术.检测出位点遗传多样性指标 Na、Ne、H 和 I分别为1.9969、1.3404、0.2132、0.3405,均较大,显示紫椴遗传多样性较高,遗传变异相对广泛.

图1P-GAT/M-CTA扩增的紫椴AFLP图谱Fig.1 AFLP profiles for singal plants of T.amurensis by P-GAT/M-CTA
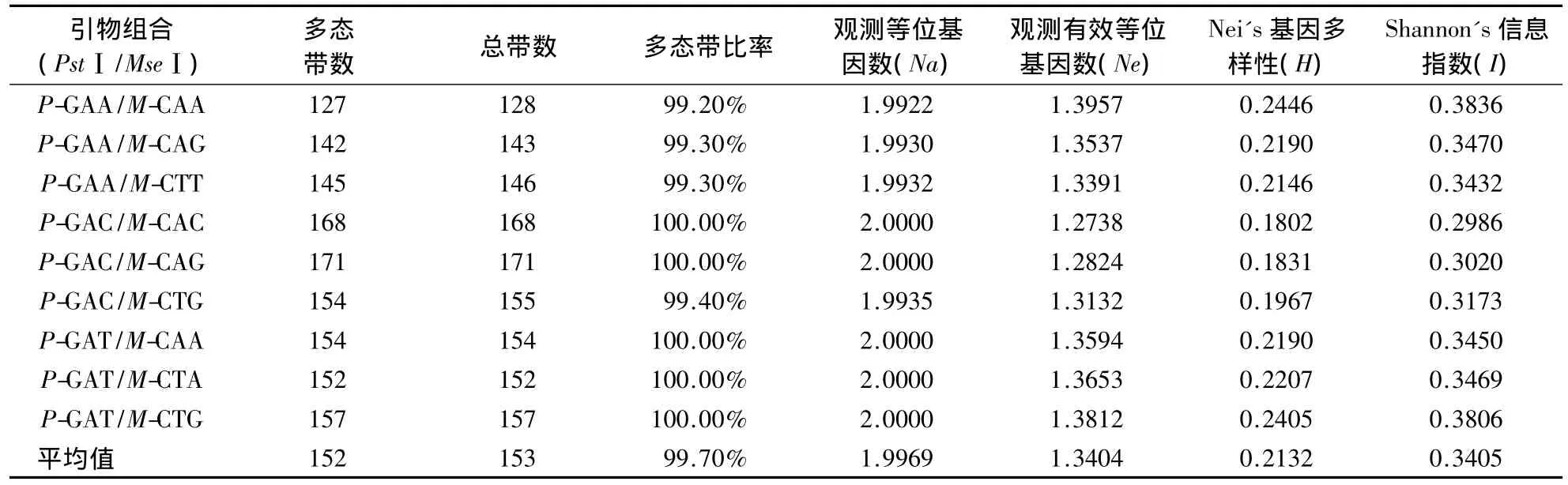
表1 62个紫椴单株AFLP引物的多态性Table 1 The strip polymorphism of 62 single plants of T.amurensis after AFLP selective amplification
2.2 紫椴的特异性条带
62个紫椴单株中有51个单株扩增出182条特异性条带,占多态带总数的13.3%,其中缺失带为6条.56号单株扩增的特异性条带最多,达到12条,包括1条缺失带;其次是51号单株,扩增出11条特异性条带,56号和51号单株都来自昆嵛山.通过特异性条带可将82.3%的紫椴单株辨别出来,说明AFLP技术在种质鉴定方面具有巨大潜力.9对引物扩增出的特异性条带数为11-24,其中P-GAT/M-CAA扩增出的特异性条带最多,达到24条;其次是 P-GAC/M-CAC、P-GAC/M-CAG、P-GAC/M-CT、P-GAT/M-CTA,都扩增出了23条特异性条带;扩增出特异性条带最少的是P-GAA/M-CAA,仅有11条.扩增出的条带数量表明不同引物组合通过特异性条带鉴别种质有效性的高低.
2.3 紫椴的遗传相似性及其聚类分析
采用NTSYSpc version 2.10e软件检测62个紫椴单株间的相似性,相似系数为0.3911-0.7953,平均值为0.5761.1号与2号的相似性系数最大,说明1号与2号的亲缘关系最近,这可能与这两者来源地相同有关,它们都来自泰山后石坞.来自泰山的12号与来自昆嵛山的56号的相似性系数最小,说明这两者间的相似性较低,亲缘关系较远,这可能与它们来源地相距较远、生长条件差异性较大有关.
对62个紫椴单株进行UPGMA聚类,在相似性系数为0.60处,将其分成12组.第1组包括1、2、3、7、10、11、12、14、15、17、18、19、20、31 号,共 14 个单株,其中来自泰山的有 13 个单株,来自艾山的有 1 个单株;第2 组包括5、6、13、21、22、23、24、25、26、28、30、37 号,共 12 个单株,来自泰山的有 3 个单株,鲁山的有3 个单株,艾山的有1 个单株,崂山的有 5 个单株;第 3 组包括 32、33、34、35、36、38、39、40、41、42、43、44、46、47、49、50、51、52、53、55、58、59、61、62 号,共24 个单株,其中来自艾山的有 10 个单株,来自昆嵛山的有14个单株;第4组包括4、9、16号,共3个单株,均来自泰山;第5-9组各包括1个单株,分别是来自泰山的8号、昆嵛山的54号、昆嵛山的60号、昆嵛山的57号、鲁山的27号;第10组包括来自鲁山的29号和来自昆嵛山的48号单株;第11、12组各包括1个单株,分别是来自昆嵛山的45号单株和来自昆嵛山的56号单株.通过聚类分析可知,来源相同的单株并没有严格地聚成一组,说明亲缘关系与来源没有严格的一致关系.来自昆嵛山的紫椴分散在7个组中,说明昆嵛山的紫椴变异范围较广泛.
3 小结与讨论
本研究通过9对AFLP引物组合获得了千余条稳定而有效的条带,这充分验证了AFLP标记方法的可靠性、稳定性和高效性.此外,采用机器读带,避免了人工读带误差大的缺点,精确性大大提高.一般认为,P值超过50%,则认为该物种具有较丰富的遗传多样性[10].本研究检测的紫椴遗传多样性达到99.70%,比刘赢男[7]和穆立蔷等[6]通过ISSR技术检测的结果都高,这可能与采用的方法不同有关.AFLP被认为是迄今为止最有效的分子标记[11].另外,供试材料的来源、样本的大小都会对遗传多样性造成一定影响.遗传多样性能够反映一个物种对环境的适应能力、生存能力.有的学者认为,特有或濒危物种具有较低的遗传多样性[12-13].但更多的研究报道却揭示,稀有或濒危种并未表现出遗传变异水平的下降,有些特有种甚至濒危种也可能具有较高的遗传多样性[14-16],本研究也证明了这一点.因此单凭遗传多样性不能够准确而充分地反映种群的生存状态,为进一步揭示遗传多样性与物种保护之间的关系,还需要将形态生理、生态学、分子水平的相关研究综合起来进行分析.
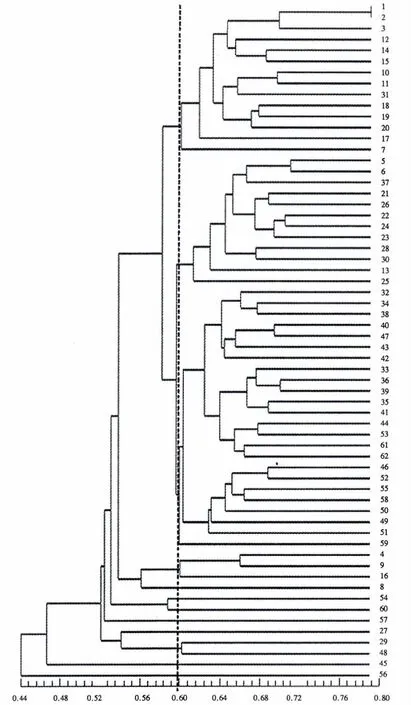
图2 62个紫椴单株基于AFLP分析的UPGMA聚类结果Fig.2 Dendrogram of UPGMA analysis of 62 signal plants of T.amurensis based on AFLP markers
51个单株扩增出了182条特异性条带,占多态带总数的13.3%,其中缺失带为6条,可将82.3%的紫椴单株辨别出来.特异性条带是某个单株的特有带,是进行特殊性状标记的基础.因此,可利用特异性条带进行种质资源的鉴定.这比依据表型性状进行种质资源分类更加全面和精确,更能真实反映不同种质资源间的遗传背景和遗传差异.此外,通过比较条带存在与否、条带的数量可发现不同紫椴单株之间遗传多样性和亲缘关系.差异带数越多,单株间的遗传相似性越低,遗传多样性越丰富,亲缘关系越远;反之,则相似性越大,亲缘关系越近[17].特异性条带的存在还可能与种质资源对环境的适应力有一定联系,可以作为基因资源保护的一个依据.
聚类分析一定程度上可以反映种质资源的起源和分类[18].62个单株相似系数为0.3911-0.7953,平均值为0.5761,在相似性系数为0.60处,可将所有单株分成12组,从个体的聚类图上可以看出:来源相同的紫椴单株不能完全按照地域聚类.不同地区的紫椴在聚类图中也没有明显界限,来源于昆嵛山的种质分布于7个组中,表明供试昆嵛山紫椴种质存在着较宽的遗传基础.这可能是紫椴的起源和亲缘关系较为复杂所致,也可能是因为地区之间紫椴的广泛交流导致了某些基因在不同地区种质间的渗入.
[1]王洪峰,安磊,穆立蔷.紫椴在不同城市生境中的生态功能比较[J].西北林学院学报,2011,26(2):81-85.
[2]郭明辉,郭丽.抚育间伐对紫椴木材材质的影响[J].东北林业大学学报,2001,29(5):26-27.
[3]王军邦,王政权,胡秉民,等.不同栽植方式下紫椴幼苗生物量分配及资源利用分析[J].植物生态学报,2002,26(3):677-683.
[4]彭海源,李坚,丁汉喜,等.东北六种阔叶树散孔材超微结构观察[J].东北林业大学学报,1990,18(1):72-79.
[5]廉守喜,乔静,张和生,等.紫椴优良无性系的初步评价[J].防护林科技,2004(4):20-22.
[6]穆立蔷,刘赢男.不同地理分布区紫椴种群的遗传多样性变化[J].植物生态学报,2007,31(6):1190-1198.
[7]刘赢男.紫椴天然种群遗传多样性和遗传分化的研究[D].哈尔滨:东北林业大学,2006.
[8]范丽景.板栗AFLP银染技术体系建立及遗传多样性研究[D].石家庄:河北农业大学,2005.
[9]洪丕征.刺槐耐盐优良无性系初步选育及AFLP遗传多样性分析[D].泰安:山东农业大学,2011.
[10]陈良华,胡庭兴,张帆.四川干旱干热河谷核桃资源遗传多样性分析[J].果树学报,2009,26(1):48-54.
[11]王斌,翁曼丽.AFLP 的原理及其应用[J].杂交水稻,1996(5):27-30.
[12]BRAUNER S,CRAWFORD D J,STUESSY T F.Ribosomal DNA and RAPD variation in the rare plant family Lactoridaceae[J].American Journal of Botany,1992,79(12):1436-1439.
[13]HAMRICK J L.Isozymes and the analysis of geneticstructure in plant populations[C]∥SOLTIS D E,SOLTIS P S.Isozymes in plant biology.London:Chapman and Hall Ltd.,1990:87-105.
[14]COSNER M E,CRAWFORD D J.Comparisons of isozyme diversity in three rare species of Coreopsis(Asteraceae)[J].Systematic Botany,1994(19):350-358.
[15]DOLAN R W,YAHR R,MENGES E S,et al.Conservation implications of genetic variation in three rare species endemic to Florida rosemary scrub[J].American Journal of Botany,1999,86(11):1556-1562.
[16]MARTINEZ P A,EGUIARTE L E,FURNIER G R.Genetic diversity of the endangered endemic Agave victoriae reginae(Agavaceae)in the Chihuahuan desert[J].American Journal of Botany,1999,86(8):1093-1098.
[17]刘爱萍.中国12个省(区)马尾松主要种质资源的RAPD与ISSR分析[D].福州:福建农林大学,2007.
[18]CASTIGLIONE S,WANG G,DAMIANI G,et al.RAPD fingerprints for identification and taxonomic studies of elite poplar(Populus spp.)clones[J].Theor Appl Genet,1997,97:54-59.

