三种食品添加剂抑制菌体生物被膜形成
周文渊, 张宏梅, 姜 燕, 黄慧嫦, 陈胜华,廖丁妹, 郭 凯, 张文艳, 杨安林
(广东工业大学 轻工化工学院,广东 广州 510006)
生物被膜是指由细菌嵌入自身分泌的多糖、蛋白质和DNA等多聚物组成的一种结构化聚合体,以增加自己对于外界环境的适应性[1-2]。据调查,生物被膜中微生物通过形成复杂的结构,其耐受杀菌剂以及机械损伤的能力可提高数百至上千倍[3-4]。随着对生物被膜研究的深入,发现生物被膜通常不是只由一种微生物构成,而是通过多种微生物形成的混合菌生物被膜,且其具有更强的胁迫环境耐受能力[5-6]。近来研究表明,群体感应与生物被膜的形成密切相关,在群体感应系统中,各类信号分子在调控生物被膜的形成中起到非常重要的作用。其中信号分子Autoinducers-II(AI-2)是细菌群体感应信号的一种,是革兰氏阳性菌和阴性菌可共同识别并作出反应的一类通用信号分子,在调控混合菌生物被膜的形成中具有重要作用[7-8]。
在食品工业中,为避免生物被膜产生抗性而过量使用消毒与防腐剂导致的食品安全问题不容忽视。致病微生物的残留或过量使用消毒剂造成药物的残留直接带来极大的食品安全隐患。因此,寻求一种天然、安全有效的天然产物抑制生物被膜刻不容缓。食品添加剂是一种少量添加于食品,以改善食品的外观、风味和组织结构或贮存性质的非营养物质。很多学者证明多种食品添加剂具有抑菌效果[9-10]。根据前人研究,我们筛选出常见抑菌效果最好的茶多酚、柠檬醛和肉桂醛作为研究对象。茶多酚、柠檬醛和肉桂醛都是来自于天然植物的最常见的食品添加剂,已有研究表明,它们对多种致病菌具有抑制作用[9-10],但关于其抑制细菌混合生物被膜的研究却很少。因此,作者通过微孔板法研究茶多酚、柠檬醛和肉桂醛对三种常见的食源性细菌(金黄色葡萄球菌,肠炎沙门氏菌,大肠杆菌)的最小抑菌浓度,及其在亚抑菌浓度时对3种细菌及其混合菌生物被膜形成能力及群体感应信号分子AI-2活力的影响,为其在食品工业中抑制生物被膜形成的广泛应用奠定研究基础。
1 材料与方法
1.1 实验材料
金黄色葡萄球菌ATCC25923、肠炎沙门氏菌ATCC14028和大肠杆菌ATCC8739:作者所在实验室于-80℃保存;哈氏弧菌V.BB170:购自美国ATCC菌株保藏中心;茶多酚(纯度≥98%):广州齐云生物技术有限公司;柠檬醛和肉桂醛 (纯度≥99%):上海晶纯试剂有限公司;胰蛋白胨大豆肉汤培养基(TSB培养基):青岛海博微生物科技有限公司。
1.2 仪器与设备
DHP-9052型电热恒温培养箱:上海一恒科技有限公司;96孔板:德国Coming Costar公司;Model 680酶标仪:BioRad公司;多功能酶标仪Infinite200:瑞士Tecan公司。
1.3 实验方法
1.3.1 最小抑菌浓度(MIC)测定 参照文献[11]并加以改进,通过二倍稀释法将购买的茶多酚、肉桂醛、柠檬醛原液分别稀释,茶多酚的质量浓度梯度为 0.125、0.25、0.5、1、2、4 mg/mL,柠檬醛和肉桂醛浓度梯度为 0.125、0.25、0.5、1、2、4 μL/mL。 将过夜培养的3种细菌金黄色葡萄球菌ATCC25923、肠炎沙门氏菌ATCC14028和大肠杆菌ATCC8739稀释一定倍数后,通过标准麦氏比浊管配成0.5麦(1.5×108cfu/mL),然后添加适量菌悬液至配有不同浓度茶多酚、柠檬醛和肉桂醛的试管中,混合均匀后,37℃摇床下培养18 h后取出观察,以不接菌的不同天然产物培养基为空白对照,以肉眼看不到试管内浑浊的最高浓度为最小抑菌浓度,重复3次。
1.3.2 生物被膜的测定 根据文献 [12]进行实验,将过夜培养的3种细菌金黄色葡萄球菌ATCC25923、肠炎沙门氏菌ATCC14028和大肠杆菌ATCC8739配成0.5麦后,分别取1 μL以及三种细菌各取1 μL接种于事先配好含有不同浓度茶多酚、柠檬醛和肉桂醛(0、1/2MIC、1/4MIC)的 100 μL TSB培养基的标准96孔板中,将未接菌的不同浓度天然产物培养基作为空白对照。37℃过夜培养24 h后,倒掉培养基,用蒸馏水水洗3次去除浮游菌,微孔板在室温下干燥2 h,加入10 g/L结晶紫100 μL/孔,放置20 min后,蒸馏水洗6~7次去除孔壁染液直至水洗液为无色,孔板在室温下干燥30 min,加入95%乙醇100 μL/孔,微量振荡器上振荡30 min后,于630 nm波长下用酶标仪测定其吸光度A值。实验平行3次。
1.3.3 细菌AI-2活力测定 参照文献[7,13],将哈氏弧菌V.BB170活化后,置于30℃恒温振荡培养箱中培养,200 r/min下培养16 h,然后用新鲜AB培养基将其稀释5 000倍后备用。同时,将3种测试菌株及其混合菌株接种于含有1/4MIC浓度的不同天然产物TSB培养基中培养,经过37℃培养24 h后,接着在13 000 r/min下离心5 min后取上清液,上清液经0.22 μm滤膜过滤后,取10 μL与稀释过的VBB170培养物100 μL混合后加入96孔板中。同时以各种细菌在不添加添加剂的培养基中培养时的无细胞上清液作为阳性对照。全部置于30℃下恒温振荡培养。用多功能酶标仪Infinite200每隔1 h测一次发光值,直至5 h。以阳性对照的发光值为基数,计算3种菌的AI-2活力引起V.BB170发光相对值,该实验平行3次。
2 结果与分析
2.1 茶多酚、柠檬醛、肉桂醛的最小抑菌浓度
通过二倍稀释法,测定3种添加剂对3种细菌的MIC。从图1可以看出,茶多酚对金黄色葡萄球菌的抑制效果最好(0.5 mg/mL),而对大肠杆菌和沙门氏菌的MIC是2 mg/mL。柠檬醛对金黄色葡萄球菌和大肠杆菌的抑制效果最好(0.5 μL/mL),而对沙门氏菌的MIC是2 μL/mL。肉桂醛对沙门氏菌和大肠杆菌的抑制效果最好(1 μL/mL),而对于金黄色葡萄球菌的MIC是2 μL/mL。结果表明,3种添加剂对3种细菌的抑制效果均不相同。

图1 茶多酚、柠檬醛、肉桂醛对金黄色葡萄球菌和肠炎沙门氏菌的最小抑菌浓度Fig.1 MICs of tea polyphenols citral and cinnamaldehyde against S.aureus,E.coli and Salmonella enteritidis
2.2 亚抑菌浓度下各种添加剂对3种细菌及其混合菌生物膜形成的影响
通过微孔板法测定3种添加剂对3种细菌及其混合菌生物膜形成的影响。以不加入添加剂微生物成膜的A630为基数,计算不同种类及浓度的添加剂影响生物膜形成相对值。由图2~5可知,随着加入3种添加剂的浓度不断增加,3种细菌以及混合菌的生物被膜形成能力不断下降。同时我们发现,茶多酚对于金黄色葡萄球菌和混合菌的生物被膜形成抑制效果最好,与不加入茶多酚的对照相比,金黄色葡萄球菌的生物被膜变为原来的80%(1/4MIC)和38%(1/2MIC),混合菌的生物被膜形成变为原来的22%(1/4MIC)和12%(1/2MIC)。肉桂醛对大肠杆菌和沙门氏菌的抑制效果最好,加入肉桂醛之后,大肠杆菌的生物被膜变为原来的29%(1/4MIC)和12%(1/2MIC),沙门氏菌的生物被膜变为原来的 41%(1/4MIC)和 10%(1/2MIC)。

图2 亚抑菌浓度的添加剂对金黄色葡萄球菌成膜率的影响Fig.2 Effects of different concentration of three additive products on biofilm formation of S.aureus

图3 亚抑菌浓度的添加剂对肠炎沙门氏菌成膜率的影响Fig.3 Effects of different concentration of three additive products on biofilm formation of Salmonella
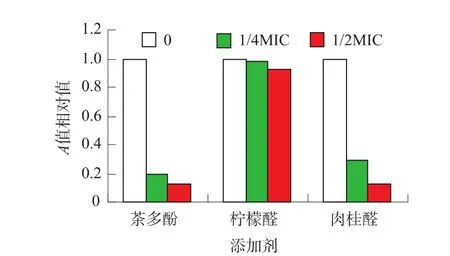
图4 亚抑菌浓度的添加剂对大肠杆菌成膜率的影响Fig.4 Effects of different concentration of three additive products on biofilm formation of E.coli

图5 亚抑菌浓度的添加剂对混合菌成膜率的影响Fig.5 Effects of different concentration of three additive products on biofilm formation of mixed isolates
2.3 亚抑菌浓度(1/4MIC)下各种添加剂对3种菌及其混合菌AI-2的影响
如图6所示,3种添加剂中只有柠檬醛对于革兰氏阳性菌金黄色葡萄球菌AI-2具有抑制作用,抑制率为33%。而对于革兰氏阴性菌大肠杆菌和沙门氏菌,三种天然添加剂对其AI-2均具有不同程度的抑制作用。但其中柠檬醛对大肠杆菌和沙门氏菌的抑制效果最明显,加入柠檬醛之后,大肠杆菌和沙门氏菌的AI-2活力分别变为原来的39%和37%。而当三种细菌混合以后,三种天然添加剂对AI-2的抑制效果都很好,其中效果最好的柠檬醛可以抑制混合菌90%的AI-2活力。由此可见,柠檬醛对于金黄色葡萄球菌(革兰氏阳性菌)、大肠杆菌和沙门氏菌(革兰氏阴性菌)及其混合菌的AI-2都具有抑制效果而且效果最好。

图6 亚抑菌浓度下茶多酚,柠檬醛和肉桂醛抑制细菌AI-2活力Fig.6 Effects of three additive products at sub-MIC on AI-2 activity of S.aureus,Salmonella,E.coli and the mixed isolates
3 结语
茶多酚提取自茶叶中,是茶叶中黄烷醇类、花色苷类和黄酮类物质的总称,具有强烈的抗氧化作用。很多研究表明,茶多酚具有抗菌抗病毒、抑制生物被膜形成等作用[14-15]。柠檬醛存在于枫茅油和山苍子油中,是开链单萜类物质。有研究证实,柠檬醛可以通过与某些酶结合,影响微生物代谢系统,抑制细菌生长及其生物被膜形成[16]。肉桂醛天然存在于桂皮油、藿香油当中,也有研究证明,肉桂醛可以通过破坏细胞壁,抑制细菌DNA、RNA以及蛋白质的合成,从而达到抑制细菌生长的作用[17-18]。在本研究中,选取了金黄色葡萄球菌、大肠杆菌以及沙门氏菌作为实验研究对象,这三种菌都是常见的食源性细菌,同时也是国内食品污染以及腐败的常见细菌[19]。多项研究证明,这三种细菌都可以通过形成生物被膜结构增加其对于不利环境的抗性,使其在工业生产以及家庭卫生环境中的变得更难清除[20-2]。
本实验结果证明,3种天然食品添加剂对于3种细菌均具有抑制作用,同时也会抑制其生物被膜形成。同时我们发现,茶多酚对于金黄色葡萄球菌的菌体生长以及生物被膜形成抑制效果更好,肉桂醛更趋向于抑制大肠杆菌和沙门氏菌的菌体生长和生物被膜形成,这可能是由于AI-2活力引起的。实验证明,肉桂醛可以抑制大肠杆菌和沙门氏菌的AI-2活力,从而减少其生物被膜形成,而对金黄色葡萄球菌的AI-2并无抑制效果,因此对金黄色葡萄球菌生物被膜形成能力抑制效果较弱。柠檬醛则是由于其对于三种细菌的AI-2活力均有抑制,使其对于革兰氏阳性菌和阴性菌的生物被膜形成都有一定的抑制效果,而茶多酚对金黄色葡萄球菌、大肠杆菌、沙门氏菌以及混合菌的生物被膜形成能力均有抑制作用。但实验结果表明,其只对大肠杆菌、沙门氏菌以及混合菌AI-2活力具有抑制作用,推测可能是由于茶多酚具有很强的抗氧化作用,可以额外通过影响生物被膜中脂质、多糖等胞外产物来抑制金黄色葡萄球菌生物膜形成[4]。本实验证实了3种天然添加剂对3种细菌及其混合菌的生物被膜形成及其AI-2信号分子的抑制作用,在今后的研究中,我们将进一步研究加入不同添加剂后,生物膜中各种蛋白质、多糖、脂质等的含量变化,以探讨各种食品添加剂抑制细菌生物被膜形成的作用机理。
[1]Hall-Stoodley L,Costerton J W,Stoodley P.Bacterial biofilms:from the natural environment to infectious diseases[J].Nature Reviews Microbiology,2004,2:95-108.
[2]Hoiby N,Bjarnsholt T,Givskov M,et al.Antibiotic resistance of bacterial biofilms[J].International Journal of Antimicrobial Agents,2010,35:322-332.
[3]Nishimura S,Tsurumoto T,Yonekura A,et al.Antimicrobial susceptibility of Staphylococcus aureus and Staphylococcus epidermidis biofilms isolated from infected total hip arthroplasty cases[J].Journal of Orthopaedic Science:Official Journal of the Japanese Orthopaedic Association,2006,11:46-50.
[4]Simoes M,Simoes L C,Vieira M J.Species association increases biofilm resistance to chemical and mechanical treatments[J].Water Research,2009,43:229-237.
[5]Van der Veen S,Abee T.Mixed species biofilms of Listeria monocytogenes and Lactobacillus plantarum show enhanced resistance to benzalkonium chloride and peracetic acid[J].International Journal of Food Microbiology,2011,144:421-431.
[6]Huang C Y,Hsieh S P,Kuo P A,et al.Impact of disinfectant and nutrient concentration on growth and biofilm formation for a Pseudomonas strain and the mixed cultures from a fine papermachine system [J].International Biodeterioration&Biodegradation,2009,63:998-1007.
[7]Surette M G,Bassler B L.Quorum sensing in Escherichia coli and Salmonella typhimurium[J].Proc Natl Acad Sci U S A,1998,95:7046-7050.
[8]Stankowska D,Czerwonka G,Rozalska S,et al.Influence of quorum sensing signal molecules on biofilm formation in Proteus mirabilis O18[J].Folia Microbiologica,2012,57:53-60.
[9]钱丽红,陶妍,谢晶.茶多酚对金黄色葡萄球菌和铜绿假单胞菌的抑菌机理[J].微生物学通报,2010,37(11):1628-1633.QIAN Lihong,TAO Yan,XIE Jing.Antimicrobial mechanisms of tea polyphenol against Staphyloccocus aureus and Pseudomonas aeruginosa[J].Microbiology,2010,37(11):1628-1633.(in Chinese)
[10]王新伟,刘欢,魏静.牛至油、香芹酚、柠檬醛和肉桂醛抑菌作用研究[J].食品工业,2010,5:13-15.WANG Xinwei,LIU Huan,WEI Jing.Antibacterial effects of oregano ossential oil,carvacrol,citral and cinnamaldehyde[J].The Food Industry,2010,5:13-15.(in Chinese)
[11]Delaquis P J,Stanich K,Girard B,et al.Antimicrobial activity of individual and mixed fractions of dill,cilantro,coriander and eucalyptus essential oils[J].International Journal of Food Microbiology,2002,74:101-109.
[12]Rode T M,Langsrud S,Holck A,et al.Different patterns of biofilm formation in Staphylococcus aureus under food-related stress conditions[J].International Journal of Food Microbiology,2007,116:372-383.
[13]Lonn-Stensrud J,Petersen F C,Benneche T,et al.Synthetic bromated furanone inhibits autoinducer-2-mediated communication and biofilm formation in oral streptococci[J].Oral Microbiol Immunol,2007,22:340-346.
[14]Evensen N A,Braun P C.The effects of tea polyphenols on Candida albicans:inhibition of biofilm formation and proteasome inactivation[J].Canadian Journal of Microbiology,2009,55:1033-1039.
[15]Matsunaga T,Nakahara A,MinnatulK M,etal.The inhibitory effectsofcatechinson biofilm formation by the periodontopathogenic bacterium,Eikenella corrodens[J].Bioscience,Biotechnology and Biochemistry,2010,74:2445-2450.
[16]方德秋,肖顺元.柠檬酸及香精油的抗菌性研究概述[J].天然产物研究与开发,1994,6(2):75-78.FANG Deqiu,XIAO Shunyuan.Antimicrobiological activity of citral and related essential oils[J].Natural Product Research and Development,1994,6(2):75-78.(in Chinese)
[17]张宽朝,魏练平,沈浩,等.肉桂醛,柠檬醛抑制黑曲霉生长的比较研究[J].中国微生态学杂志,2011,23(2):141-143.ZHANG Kuangchao,WEI Lianping,SHEN Hao,et al.Comparative study of inhibitive effect of cinnamaldehyde and citral upon Aspergillusniger growth[J].Chinese Journal of Microecology,2011,23(2):141-143.(in Chinese)
[18]Vrinda Menon K,Garg S.Inhibitory effect of clove oil on Listeria monocytogenes in meat and cheese[J].Food Microbiology,2001,18:647-650.
[19]纪丽莲,范怡梅.玉米须提取物对食品腐败菌及致病菌抑制作用的研究[J].食品科学,2000,21(12):131-134.JI Lilian,FAN Yimei.Research of inhibitive effect of maize extracts upon food spoilage and food-borne pathogens[J].Journal of Food Science,2000,21(12):131-134.(in Chinese)
[20]Murphy H M,Payne S J,Gagnon G A.Sequential UV-and chlorine-based disinfection to mitigate Escherichia coli in drinking water biofilms[J].Water Research,2008,42:2083-2092.
[21]Kwiecinski J,Eick S,Wojcik K.Effects of tea tree(Melaleuca alternifolia) oil on Staphylococcus aureus in biofilms and stationary growth phase[J].International Journal of Antimicrobial Agents,2009,33:343-347.
[22]黄宝威,张宏梅,刘学禄,等.不同食源微生物生物被膜形成特征及亚致死浓度消毒剂对菌体成膜的影响[J].食品与生物技术学报,2011,30(5):757-760.HUANG Baowei,ZHANG Hongmei,LIU Xuelu,et al.Different patterns of biofilm formation and effect of sub-MIC disinfectant on biofilm formation of foodbore pathogens[J].Journal of Food Science and Biotechnology,2011,30(5):757-760.(in Chinese)

