基于金磁微粒与酶标噬菌体抗体的磁分离免疫分析法
穆晞惠,童朝阳,黄启斌,刘 冰,刘志伟,郝兰群,张金平
(国民核生化灾害防护国家重点实验室,北京 102205)
金磁微粒(Gold-magnetic particle)是由纳米金颗粒包被超顺磁Fe3O4纳米粒子后形成的磁性无机纳米复合物,兼有纳米金颗粒与磁微粒的双重优势。作为一种新型的磁性纳米功能材料,金磁微粒凭借其良好的稳定性、分散性、生物相容性及磁性富集分离等特性,已被广泛应用于核酸杂交、疾病诊断、生物检测和生物传感等方面,可起到简化操作步骤,提高检测的灵敏度、特异性和抗干扰能力的作用[1-7]。噬菌体抗体作为免疫检测中一种非常有前景的识别分子,兼具特异的抗原结合特性和噬菌体结构特性,可与多个抗噬菌体衣壳蛋白pⅧ的酶标抗体结合,形成携带大量酶分子的酶标噬菌体抗体复合物。与传统抗体与酶标二抗结合形成的酶标抗体复合物探针相比,噬菌体抗体可产生针对靶分子的特异信号放大效应[8]。蛋白A(Staphylococcus protein A,SPA)通过疏水作用与IgG分子Fc段特异结合,可实现分子的定向固定从而提高探针活性,现已在生物检测领域得到广泛应用[9-13]。
本课题组研究发现,蛋白A和酶标噬菌体抗体在磁免疫分析中具有信号放大效应[8,13],然而目前尚缺乏对金磁微粒功能化探针以及金磁微粒、蛋白A、酶标噬菌体抗体三者在磁免疫分析中的综合放大效应的深入研究,也无针对相思子毒素(Abrin)的快速、灵敏、特异和抗干扰能力强的磁免疫分析法的文献报道。本研究以蛋白A包被金磁微粒偶联相思子毒素多抗作为功能化捕获探针,酶标相思子毒素噬菌体抗体为特异信号检测探针,采用“蛋白A包被金磁微粒功能化捕获探针-相思子毒素 -酶标噬菌体抗体信号探针”的检测模式,建立了检测相思子毒素的磁免疫分析新方法。通过与其他免疫检测方法的比较,重点探讨了金磁微粒功能化探针在提高检测灵敏度上的效果,以及金磁微粒、蛋白A与酶标噬菌体抗体三者产生的综合信号放大效应。同时重点考察了该方法对以河水、施肥土壤、奶油饼干和兔全血作为基质的模拟样品的检测能力,为其在临床诊断、环境监测、食品卫生检验及生物反恐等领域的应用提供技术基础和参考依据。
1 实验部分
1.1 试剂与仪器
相思子毒素标准品、相思子毒素多抗、相思子毒素噬菌体抗体、蓖麻毒素(Ricin)、超顺磁Fe3O4纳米粒子(粒径15 nm)、金磁微粒(粒径150 nm)均由本实验室制备;金黄色葡萄球菌肠毒素B(SEB)、氯金酸(HAuCl4·4H2O)、盐酸羟胺、蛋白A(SPA)、牛血清白蛋白(BSA)、3,3’,5,5’-四甲基联苯胺(TMB)购自Sigma公司;辣根过氧化物酶标记的抗M13单克隆抗体(HRP-抗M13单抗)购自GE公司;BioMATE 3S型紫外-可见分光光度计(美国Thermo公司);680型酶标仪(美国BioRad公司);96孔磁架(德国Dynal公司)。
1.2 金磁微粒的制备
参照文献[14]制备金磁微粒并稍加改动。取本课题组利用微波共沉淀法制备的超顺磁Fe3O4纳米粒子(磁微粒)0.2 g[15]溶于100 mL超纯水中超声15 min;加入1%HAuCl4·4H2O水溶液10 mL,搅拌速度为1 500 r/min,室温反应1 h;加入50 mmol/L盐酸羟胺40 mL,搅拌速度为2 000 r/min,室温反应1 h;磁性分离弃上清液,加入1 mol/L HCl浸泡4 h后,超纯水洗至中性并定容至50 mL备用,同时计算固形物含量。
1.3 金磁微粒功能化探针的制备
取1 mg金磁微粒,用0.01 mol/L pH 7.4的磷酸盐缓冲液(PBS)清洗金磁微粒,磁分离弃去上清液;加入一定量1 mg/mL SPA,室温旋转反应3 h,PBST(0.01 mol/L pH 7.4 PBS缓冲液,含0.1%Tween-20)清洗金磁微粒,磁分离弃上清液;加入一定量1 mg/mL相思子毒素多抗,室温旋转反应2 h,PBST清洗金磁微粒并定容至1 mL,于4℃或-20℃贮存备用。
1.4 酶标相思子毒素噬菌体抗体探针的制备
将滴度为1.0×1013pfu/mL的相思子毒素噬菌体抗体1 mL与HRP-抗M13单抗1 μL混匀,37℃温育1 h,以4℃ 9 000 g离心20 min,弃去上清液;0.01 mol/L PBS缓冲液(pH 7.4,含0.1%Tween-20)重悬沉淀后继续离心,重复3次;最后以0.01 mol/L PBS缓冲液(pH 7.4,含3%BSA)重悬沉淀,4℃贮存备用。
1.5 基于金磁微粒与酶标噬菌体抗体的磁分离免疫分析法的建立
①加待测样品:取金磁微粒功能化探针各100 μL,均加入用0.01 mol/L PBS缓冲液(pH 7.4)稀释成100 μL的不同浓度的相思子毒素标准品,另取金磁微粒、金磁微粒功能化探针各100 μL分别作为空白和阴性对照管,加0.01 mol/L PBS缓冲液(pH 7.4,含1%BSA)各100 μL,37℃温育1 h,PBST洗3次,磁分离弃去上清液。②加酶标噬菌体抗体探针:除空白管外,各加一定滴度的酶标相思子毒素噬菌体抗体100 μL,37℃温育1 h,PBST洗3次,磁分离弃去上清液。③底物显色:每管加100 μL TMB,37℃温育15 min,加2 mol/L浓H2SO450 μL终止反应;④读数:磁架收集上清液,采用酶标仪测A450nm值。检测过程见图1。
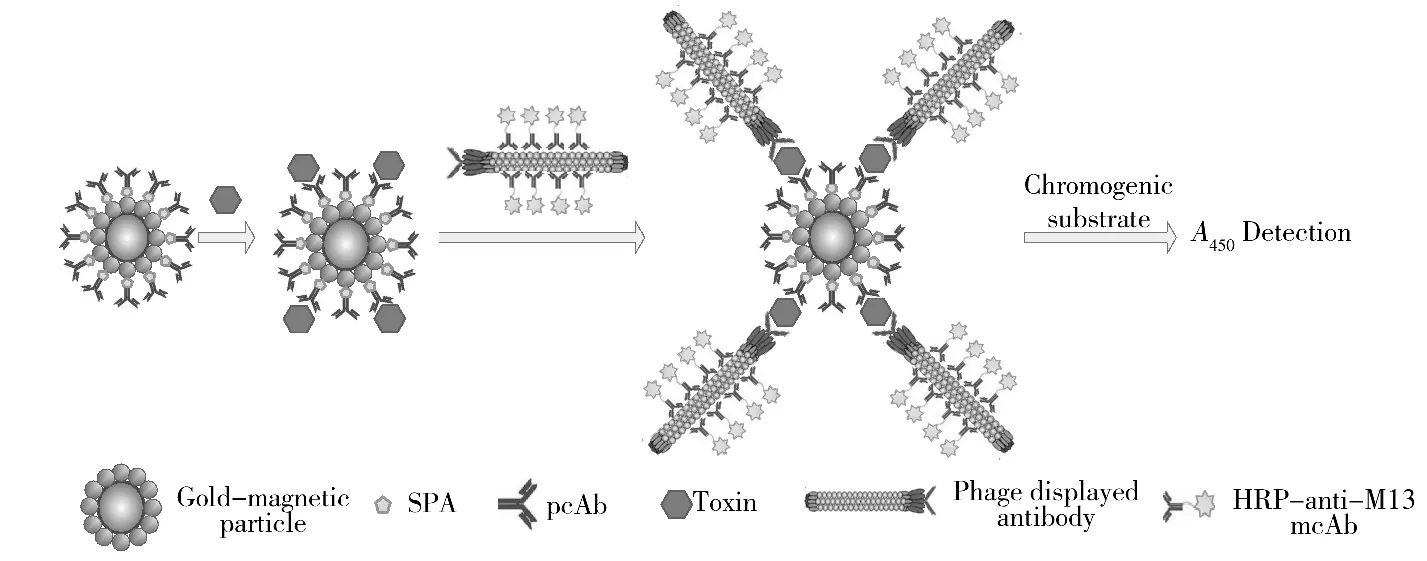
图1 基于金磁微粒与酶标噬菌体抗体的磁分离免疫分析法检测毒素原理示意图Fig.1 Model of detection toxin by magnetic affinity immunoassay(MAIA)based on gold-magnetic particle and HRP-conjugated phage antibody
1.6 相思子毒素模拟样品的测定
取1 g施肥土壤(有机质含量>5%)、1 g奶油饼干(脂肪含量>30%)、10 μL兔全血、1 mL河水,分别向各样品中加入6.24 μL 10 mg/L的相思子毒素标准品,加稀释液(0.01 mol/L pH 7.4 PBS缓冲液)混匀至8 mL,制成基质分别为施肥土壤、奶油饼干、兔全血和河水的相思子毒素模拟样品(终浓度均为7.8 μg/L)。河水样品直接取混合液测定,土壤样品以5 000 g离心20 min,饼干、全血样品以10 000 g分别离心15 min和10 min,取上清液测定相思子毒素浓度,计算回收率、相对标准偏差等指标。
2 结果与讨论
2.1 金磁微粒的制备
本研究采用微波共沉淀法获得了分散性较好、形貌呈球形、粒径为15 nm、饱和磁化强度为78.875 emu/g的磁微粒(图2A),与传统共沉淀法相比,该法简化了磁微粒制备过程,缩短了反应时间。在此基础上采用盐酸羟胺还原法获得了分散性好、形貌呈球形、粒径为150 nm、饱和磁化强度为63.151 emu/g的金磁微粒(图2B),同时测得其固形物含量为3 mg/mL。

图2 磁微粒(A)和金磁微粒(B)的透射电镜照片Fig.2 TEM images of magnetic particle(A)and gold-magnetic particle(B)
2.2 金磁微粒功能化探针的制备
2.2.1 相思子毒素多抗最适固定量的确定 利用磁微粒、金磁微粒与蛋白间的物理吸附作用,分别将不同量SPA吸附至磁微粒和金磁微粒表面,通过测定固定前后SPA溶液的A280nm值,分别计算出每毫克磁微粒和金磁微粒上的SPA固定量。从表1可知,随着SPA加入量的增加,磁微粒和金磁微粒表面固定的SPA量逐渐增加并趋于饱和,因此确定每毫克磁微粒和金磁微粒的SPA最适加入量分别为240 μg和320 μg,此时每毫克磁微粒和金磁微粒上SPA的固定量分别为111 μg和168 μg。
进一步利用SPA与IgG分子Fc段的结合特异性,加入不同量的相思子毒素多抗分别制备磁微粒功能化探针和金磁微粒功能化探针,测定固定前后相思子毒素多抗溶液的A280nm值,计算出两种功能化探针上相思子毒素多抗的实际固定量分别为453 μg和958 μg(见图3),理论最大量分别为845 μg和1 280 μg,实际固定量分别占理论最大量的53.6%和74.8%。

表1 磁微粒与金磁微粒固定前后蛋白A溶液的吸光度值变化Table 1 Absorbance value of SPA solution before and after binding to magnetic particle and gold-magnetic particle
通过比较SPA定向固定相思子毒素多抗制备的金磁微粒和磁微粒两种功能化探针,发现金磁微粒功能化探针上SPA和相思子毒素多抗的固定量均最高,说明金磁微粒比磁微粒能提供更大的活性表面,从而固定更多的生物分子探针;同时SPA可使抗体在金磁微粒表面定向固定和有序排列,减少了分子间的空间位阻,从而进一步提高了功能化探针的活性和检测灵敏度。
2.2.2 金磁微粒功能化探针磁学性质的鉴定 采用振动样品磁强计对金磁微粒功能化探针的磁学性质进行鉴定,由图4可知,金磁微粒功能化探针的饱和磁化强度为61.636 emu/g,与金磁微粒的饱和磁化强度基本相同,表明制备的金磁微粒功能化探针具有很好的磁学性质。

图3 金磁微粒和磁微粒表面多抗最适固定量的确定Fig.3 Immobilization ability of monoclonal antibody on gold-magnetic particle and magnetic particle
2.3 酶标相思子毒素噬菌体抗体探针的制备
2.3.1 HRP-抗M13单抗最适用量的确定 分别取 0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6 μL HRP-抗M13单抗与1 mL(1.0×1013pfu/mL)相思子毒素噬菌体抗体混合,制得酶标相思子毒素噬菌体抗体探针。分别取上述探针100 μL与100 μL(1 000 μg/L)相思子毒素标准品、100 μL金磁微粒功能化探针反应进行磁分离免疫测定,根据A450nm值变化确定HRP-抗M13单抗的最适用量。结果显示,随着HRP-抗M13单抗加入量的增加,其吸光度值逐渐增大,当体积大于1 μL时,吸光度值基本不再增加,表明相思子毒素噬菌体抗体上结合的HRP-抗M13单抗趋于饱和,因此确定HRP-抗M13单抗最适用量为1 μL。
2.3.2 酶标相思子毒素噬菌体抗体最适滴度的确定 分别取金磁微粒功能化探针100 μL,加入1 000 μg/L相思子毒素标准品,清洗磁微粒分别加入滴度为1.0×107,1.0×108,1.0×109,1.0×1010,1.0×1011,1.0×1012,1.0×1013pfu/mL的酶标相思子毒素噬菌体抗体100 μL,相同条件下进行磁分离免疫测定,根据A450nm值变化选择适合滴度的酶标相思子毒素噬菌体抗体。结果显示,随着酶标相思子毒素噬菌体抗体对数滴度的增大,其吸光度值逐渐增大,当对数滴度大于11时其吸光度值趋于饱和,因此确定酶标相思子毒素噬菌体抗体的最适滴度为1.0×1011pfu/mL。

图4 金磁微粒功能化探针的磁滞回线图Fig.4 Magnetic hysteresis loops curve of functionalized gold-magnetic particle probe
2.3.3 酶标相思子毒素噬菌体抗体探针的活性测定 为了验证酶标相思子毒素噬菌体抗体信号探针的活性,分别用浓度为5,10,20,40,60,80,100,120 μg/L的相思子毒素标准品100 μL包被酶标板,封闭后加入滴度为1.0×1011pfu/mL的酶标相思子毒素噬菌体抗体100 μL,同等条件下采用间接ELISA法测定,根据A450nm值变化对酶标相思子毒素噬菌体抗体的活性进行鉴定。结果表明,随着相思子毒素浓度的增大,其吸光度值逐渐增大,表明该探针可与目标物毒素结合且具有很好的量效关系,毒素的浓度(X,μg/L)与吸光度值(Y)呈显著线性相关,回归方程为Y=0.008X+0.524(r=0.995 5,P<0.000 1,n=9),因此制备的酶标相思子毒素噬菌体抗体探针具有很好的活性,可满足本实验的检测需求。
2.4 标准曲线、检出限与定量下限
用建立的磁分离免疫分析法对浓度范围为0.008~250 μg/L的相思子毒素标准品进行检测,以相思子毒素浓度为横坐标,以吸光度值为纵坐标作图(见图5)。结果显示,相思子毒素浓度的对数值(X)与其吸光度值(Y)之间呈线性相关(图5插图),回归方程为Y=0.554X+1.289(r=0.991 0,P<0.000 1,n=16)。
分别以测定值>阴性对照A450nm值+3SD和测定值>阴性对照A450nm值+10SD作为判定检出限、定量下限的标准,取20个阴性对照样本测定A450nm值为0.121±0.01,相思子毒素浓度为0.008 μg/L时的 A450nm值为0.272,因此确定检出限为0.008 μg/L,定量下限为0.008 μg/L。由于本研究中得出的标准差值很小,表明该方法具有很好的精确度,因此导致定量下限接近检出限。
相同条件下,采用“蛋白A包被金磁微粒偶联多抗捕获探针-毒素-酶标噬菌体抗体信号探针”(方法1)、“蛋白A包被磁微粒偶联多抗捕获探针-毒素-酶标噬菌体抗体信号探针”(方法2)、“金磁微粒偶联多抗捕获探针-毒素-酶标噬菌体抗体信号探针”(方法3)、“蛋白A包被金磁微粒偶联多抗捕获探针-毒素-酶标单抗信号探针”(方法4)、“金磁微粒偶联多抗捕获探针-毒素-酶标单抗信号探针”(方法5)、“磁微粒偶联多抗捕获探针-毒素-酶标单抗信号探针”(方法6)6种检测模式的双抗体夹心磁分离免疫分析法(MAIA)及传统双抗体夹心ELISA法(方法7)对相思子毒素进行检测与比较。由表2可知,该方法中金磁微粒、蛋白A和酶标噬菌体抗体的单独放大效应可使检测灵敏度分别提高5.2倍(方法5和7比较)、3倍(方法1和3比较)和4倍(方法1和4比较),三者产生的综合放大效应使其检测灵敏度比传统双抗体夹心ELISA法提高了62倍(方法1和7比较)。蛋白A-金磁微粒功能化探针与蛋白A-磁微粒功能化探针相比,具有更高的结合活性,使其检测灵敏度提高了3倍(方法1和2比较),而与传统磁微粒功能化探针相比检测灵敏度提高了9倍(方法4和6比较)。证明金磁微粒较磁微粒具有更好的生物相容性,可提供更大的活性表面固定更多生物分子;蛋白A可使抗体在金磁微粒表面定向固定和有序排列,从而进一步提高了金磁微粒功能化探针的活性和检测灵敏度;酶标噬菌体抗体和金磁微粒功能化探针在磁分离免疫中信号放大效应的存在,提高了检测灵敏度,放大了检测信号。

图5 磁分离免疫分析法检测相思子毒素的工作曲线Fig.5 Standard curve of abrin determined by magnetic affinity immunoassay(MAIA)
2.5 精密度与特异性
在检测的线性浓度范围内,选择浓度分别为250,62.5,1.95,0.032 μg/L的相思子毒素标准品进行测定,每个浓度重复测定5次,得到吸光度值的相对标准偏差(RSD)分别为1.3%,1.3%,2.8%和6.1%,表明方法具有较好的精密度。

表2 6种磁分离免疫分析法与传统ELISA方法的比较Table 2 Comparison of six MAIA and ELISA methods
采用磁分离免疫分析法分别对基质为稀释液(pH 7.4,0.01 mol/L PBS缓冲液),浓度均为15.6 μg/L的相思子毒素(Abrin)和蓖麻毒素(Ricin)、金黄色葡萄球菌肠毒素(SEB)、牛血清白蛋白(BSA)样品进行检测,同时选用基质分别为稀释液、河水、施肥土壤、奶油饼干和兔全血的无目标分子相思子毒素存在的模拟样品作为阴性对照,结果见表3。当检测 Ricin、SEB和 BSA等非目标蛋白时,其所得吸光度值基本接近阴性值,RSD为1.7%~9.0%,表明该法检测相思子毒素具有很好的特异性。
2.6 相思子毒素模拟样品的测定
对基质分别为河水、施肥土壤、奶油饼干和兔全血的相思子毒素模拟样品进行测定,其回收率均大于90%,RSD为1.2%~2.1%(见表4),表明该法具有较好的回收率和重现性,能满足水样、土样、食品及血液等人工模拟样品的分析要求。

表3 特异性测定(n=5)Table 3 Detection specificity of MAIA(n=5)

表4 相思子毒素模拟样品的测定(n=4)Table 4 Determination of abrin in the simulated samples(n=4)
3 结论
本文将蛋白A包被金磁微粒偶联相思子毒素多抗作为功能化捕获探针,酶标噬菌体抗体作为特异信号检测探针,建立了基于金磁微粒与酶标噬菌体抗体的磁分离免疫分析法,实现了微量相思子毒素的检测。该方法中金磁微粒、蛋白A及酶标噬菌体抗体三者产生的综合放大效应使其检测灵敏度比传统双抗体夹心ELISA法提高了62倍。蛋白A-金磁微粒功能化探针与蛋白A-磁微粒功能化探针相比,具有更高的结合活性,使其检测灵敏度提高3倍,而与传统磁微粒功能化探针相比可使检测灵敏度提高9倍。
本研究中的蛋白A-金磁微粒功能化探针与传统磁微粒功能化探针相比,在提高检测灵敏度方面具有以下优势:①金磁微粒具有更好的稳定性及生物相容性,可提供大的活性表面,从而提高生物分子固定量;②由于蛋白A可通过疏水作用与IgG分子的Fc段特异结合,使抗体分子探针定向固定至固相表面,这种固定抗体特性较直接物理吸附或共价结合更为有序且不影响抗体活性,从而进一步提高了功能化探针活性。因此,与传统磁微粒功能化探针相比,将金磁微粒优势与蛋白A定向固定抗体特性相结合制备的蛋白A-金磁微粒功能化探针具有更高的活性,且可提高检测灵敏度。此外,这种将蛋白A-金磁微粒功能化捕获探针、酶标噬菌体抗体信号检测探针的信号放大效应及磁免疫分离技术等多重优势结合的研究思路,在发展灵敏度高、特异性强的复杂生物样品检测领域具有广阔的应用前景。
[1]Liu B,Tong Z Y,Liu W,Hao L Q,Mu X H,Huang Q B.J.Instrum.Anal.(刘冰,童朝阳,刘威,郝兰群,穆晞惠,黄启斌.分析测试学报),2013,32(8):998-1002.
[2]Zhou H J,Lee J W,Park T J,Lee S J,Parkd J Y,Lee J B.Sens.Actuators B,2012,163(1):224 -232.
[3]Masoomi L L,Sadeghi O,Banitaba M H,Shahrjerdi A,Davarani S S H.Sens.Actuators B,2013,177:1122-1127.
[4]Peng H P,Liang R P,Zhang L,Qiu J D.Biosens.Bioelectron.,2013,42:293 -299.
[5]Parshetti G K,Lin F H,Doong R A.Sens.Actuators B,2013,186:34-43.
[6]Chen M,Bi S,Jia X Q,He P.Anal.Chim.Acta,2014,837:44-51.
[7]Jayanthi S A,David T M,Jayashainy J,Nathan D M,Sagayaraj P.J.Alloys Compd.,2014,606:254 -261.
[8]Mu X H,Tong Z Y,Huang Q B,Liu B,Liu Z W,Hao L Q,Zhang J P.Chin.J.Anal.Chem.(穆晞惠,童朝阳,黄启斌,刘冰,刘志伟,郝兰群,张金平.分析化学),2014,42(6):785-790.
[9]Ding Y J,Wang H,Li J S,Shen G L,Yu R Q.Chem.J.Chin.Univ.(丁艳君,王桦,李继山,沈国励,俞汝勤.高等学校化学学报),2005,26(2):222-226.
[10]Li N,Yuan N,Chai Y Q,Chen S H,Tang D P,An H Z.J.Instrum.Anal.(李娜,袁若,柴雅琴,陈时洪,唐点平,安海珍.分析测试学报),2007,26(6):769-773.
[11]Ikeda T,Hata Y,Ninomiya K I.Anal.Biochem.,2009,385(1):132 -137.
[12]Shen G Y,Cai C B,Wang K,Lu J L.Anal.Biochem.,2011,409(1):22-27.
[13]Mu X H,Tong Z Y,Huang Q B,Liu B,Liu Z W,Hao L Q,Zhang J P,Gao C,Wang F W.Sensors,2015,15:3896-3910.
[14]Cui Y L,Hui W L,Wang H R,Wang L J,Chen C.Sci.China B(崔亚丽,惠文利,汪慧蓉,王利军,陈超.中国科学:B辑),2003,33(6):482-488.
[15]Mu X H,Tong Z Y,Huang Q B,Liu Z W,Liu B,Hao L Q,Zhang J P.Chin.J.NBC Def.(穆晞惠,童朝阳,黄启斌,刘志伟,刘冰,郝兰群,张金平.防化学报),2014,2:24-27.

