Pd/Co双金属纳米颗粒的制备及催化制氢性能
赵万国 苏 丽 周振宁 张海军,* 鲁礼林 张少伟(武汉科技大学省部共建耐火材料与冶金国家重点实验室,武汉4008;武汉科技大学材料与冶金学院,武汉4008;武汉科技大学化学工程与技术学院,武汉4008)
Pd/Co双金属纳米颗粒的制备及催化制氢性能
赵万国1,2苏 丽1,2周振宁1,2张海军1,2,*鲁礼林3张少伟1,2
(1武汉科技大学省部共建耐火材料与冶金国家重点实验室,武汉430081;2武汉科技大学材料与冶金学院,武汉430081;3武汉科技大学化学工程与技术学院,武汉430081)
采用聚乙烯吡咯烷酮(PVP)保护的化学共还原法制备了Pd/Co双金属纳米颗粒,研究了PVP及还原剂(NaBH4)的用量、金属盐浓度、金属比例等对Pd/Co双金属纳米颗粒催化NaBH4制氢性能的影响.透射电子显微镜(TEM)的结果表明,所制备的Pd/Co双金属纳米颗粒的平均粒径在1.5-2.8 nm之间.Pd/Co双金属纳米颗粒(BNPs)的催化活性远高于Pd与Co单金属纳米颗粒的活性;当Pd/Co的理论原子比为1/9时,双金属纳米颗粒的催化活性最高可达15570 mol·mol-1·h-1(文中纳米颗粒的催化活性均为每摩尔Pd的活性).密度泛函理论(DFT)的计算结果表明,Pd原子与Co原子之间发生电荷转移,使得Pd原子带负电而Co原子带正电,荷电的Pd和Co原子进而成为催化反应的活性中心.所制备的Pd/Co双金属纳米颗粒具有很好的催化耐久性,即使重复使用5次后,该催化剂仍具有较高的催化活性,且使用后的纳米颗粒催化剂也没有出现团聚现象.双金属纳米颗粒催化NaBH4水解反应的活化能约为54 kJ·mol-1.
Pd/Co;双金属纳米颗粒;NaBH4;催化制氢
1 引言
近年来,硼氢化钠(NaBH4)、硼烷氨(NH3BH3)和水合肼(N2H4·H2O)等液相化学储氢材料1逐渐引起了研究人员的关注.NH3BH3作为液相化学储氢材料的缺点在于其价格昂贵,N2H4·H2O的缺点是产氢困难,且二者的产物中均伴有杂质气体(N2).相比之下,NaBH4作为液相化学储氢材料则具有储氢量较高、水解产生的氢气纯度高、水解产物NaBO2可回收利用等优点.除此之外,NaBH4催化水解制氢的反应条件相对温和(室温甚至更低温度),其储运和使用也都比较安全.
NaBH4在常温下水解速率较低,因此催化剂的研究显得尤为重要.近年来,贵金属纳米材料因其独特的物理化学性质以及很好的催化活性而成为很多领域的研究热点.2-4Mu等5的研究表明,聚乙烯吡咯烷酮(PVP)稳定的Pd纳米催化剂具有很好的烯烃加氢催化活性.Pushkarev等6制备的Pt纳米颗粒催化剂对苯和甲苯的加氢反应表现出很高的催化活性.贵金属纳米颗粒的催化活性虽然很好,但其过高的成本限制了该类催化剂的大规模工业应用.
双金属纳米颗粒往往表现出比单金属纳米颗粒更高的催化活性.7,8通过控制双金属纳米颗粒的化学成分和显微结构不仅可以提高催化剂的催化活性和选择性,而且可以降低贵金属的用量.例如,我们制备的Pt/Ni双金属纳米颗粒显示出比Pt和Ni单金属纳米颗粒更高的催化NaBH4水解制氢活性,且成本也相对低廉.9Wang等10研究了石墨烯负载Pd-Co双金属纳米催化剂催化氧化乙醇的活性,结果表明该催化剂具有很好的催化稳定性,并且易于回收.
本文采用化学共还原法制备了一系列Pd/Co双金属纳米颗粒催化剂,并研究了催化剂催化水解NaBH4制氢的活性,结果表明该双金属溶胶型催化剂具有催化活性高、耐久性强及成本低等优点.
2 实验部分
2.1 原 料
实验用的氯化钯(PdCl2,纯度>99%(质量分数(w),国药集团化学试剂有限公司)、氯化钴(CoCl2· 6H2O,纯度>99%(w),国药集团化学试剂有限公司)、氢氧化钠(NaOH,纯度>96%(w),天津博迪化工股份有限公司)、硼氢化钠(NaBH4,纯度>96%(w),国药集团化学试剂有限公司)均为分析纯;PVP(K35, MW=40000,西格马奥利奇(上海)贸易有限公司)则为化学纯.
2.2 样品的制备
采用NaBH4化学共还原的方法制备Pd/Co双金属纳米颗粒.以Pd/Co(原子比为50/50)的双金属纳米颗粒为例,其制备过程如下:将25 mL浓度为0.88 mmol·L-1的CoCl2溶液与25 mL浓度为0.88 mmol·L-1的PdCl2溶液加入250 mL的两口烧瓶中,在0°C的条件下搅拌均匀混合,而后加入50 mL浓度为88 mmol·L-1的PVP溶液搅拌30 min后再向混合溶液中快速注射10 mL浓度为17.6 mmol·L-1的NaBH4溶液(注射时间在5 s以内),然后再搅拌1 h制备得到Pd/Co双金属纳米颗粒.整个反应过程在N2的保护下进行.
2.3 样品的表征
采用FEI公司的Tecnai G250-S-TWIN TEM型透射电子显微镜(TEM,日本)分析Pd/Co双金属纳米颗粒的粒径、形貌及粒度分布,操作电压为80 kV.将金属纳米颗粒直接滴在覆盖有碳膜的铜网上,自然干燥后制得TEM试样.统计测量至少200个纳米颗粒的粒径大小,并在此基础上计算出该金属纳米颗粒的平均直径和标准方差,绘出粒度分布图.采用JEOL公司的JEM-2100F型高分辨透射电子显微镜(HR-TEM,日本)分析Pd/Co双金属纳米颗粒的晶格像,并根据测定的晶面间距判断所制备纳米颗粒的化学结构.操作电压为200 kV.
2.4 催化NaBH4制氢性能表征
测量碱性NaBH4溶液(pH=14)在催化剂的作用下产生H2的体积及速率,在此基础上计算催化剂单位时间内的放氢量,并以此来对比催化剂的催化活性.双金属纳米颗粒催化性能的表征过程如下:向三口烧瓶中加入所制备的Pd/Co双金属纳米颗粒溶胶,调节水浴温度为30°C,通过分液漏斗向三口烧瓶中加入10 mL浓度为30 mmol·L-1的碱性NaBH4溶液,待催化反应开始后,通过排水法测量不同时间下H2的产生量.采用多次加入相同浓度、相同体积、相同pH的NaBH4溶液的方法测量纳米颗粒的催化耐久性.
3 结果与讨论
3.1 PVP用量对Pd/Co双金属纳米颗粒催化性能的影响
PVP是一种具有特殊结构的水溶性高分子聚合物,由主链的疏水碳氢链骨架和支链的亲水吡咯烷酮环构成.PVP是多齿配位体,可利用其内酰基的配位作用和纳米颗粒表面的原子结合,起到配位、机械阻聚的作用.实验利用PVP为保护剂制备Pd/Co双金属纳米颗粒,PVP的长分子链可以将纳米颗粒表面包覆起来进而防止团聚现象的发生,并制备出粒径细小的纳米颗粒.
图1为PVP用量(RPVP表示PVP与金属离子的摩尔比)对Pd50Co50(下标50代表配方中Pd和Co的理论摩尔分数为50%,下同,声明为实际组成的除外).双金属纳米颗粒催化制氢性能的影响.结果表明,随着RPVP的增大,催化剂的催化活性先增大后减小.RPVP=0时,催化剂的催化活性最低;RPVP=40时,催化剂的催化性能最好,而当RPVP>40时,随着PVP的用量增大,催化剂的催化活性则逐渐降低.这是由于(1)纳米颗粒由于其粒径小、比表面积大而极易团聚长大,因此在未加PVP或其加入量较少(PVP难以起到有效的配体与机械阻聚作用)时,所制备的Pd/Co纳米颗粒粒径较大,导致其催化活性较低;(2)当PVP的用量较为适中时(RPVP=40),PVP在纳米颗粒表面形成的吸附层能有效阻止纳米颗粒的团聚,使得此时合成的纳米颗粒粒径细小,并具有较高的催化活性;(3)但当PVP用量太多时(如RPVP=80,100),大量PVP分子吸附在纳米颗粒表面,可能会完全覆盖纳米颗粒表面的催化活性位点,进而降低了催化剂的共催化活性.

图1 PVP用量对Pd50Co50双金属纳米颗粒催化NaBH4水解反应制氢的影响Fig.1 Influence of the amount of PVPon hydrogen generation from the hydrolysis reaction of NaBH4solution catalyzed by Pd50Co50bimetallic nanoparticles(BNPs)
3.2 NaBH4用量及金属盐离子浓度对Pd/Co双金属纳米颗粒催化性能的影响
本文以快速注射的方式在极短时间内将过量的NaBH4注入PdCl2和CoCl2的均匀混合溶液中,进而制备Pd/Co双金属纳米颗粒催化剂.因此NaBH4的用量对双金属纳米颗粒的催化活性有着重要影响.研究结果表明,在金属盐离子浓度为0.88 mmol·L-1, Pd/Co原子比为50/50,RPVP=40,RNaBH4=4(RNaBH4表示NaBH4与金属离子的摩尔比)时,纳米颗粒的催化活性最高,其数值可达3360 mol·mol-1·h-1(文中纳米颗粒的催化活性均为每摩尔Pd的活性).
为了探究金属盐离子浓度[Me2+]对Pd/Co双金属纳米颗粒催化水解NaBH4制氢活性的影响,我们在Pd/Co原子比为50/50,RPVP=40,RNaBH4=4,金属盐浓度分别为0.44、0.88、1.32以及1.76 mmol·L-1的条件下制备了4种Pd50Co50双金属纳米颗粒催化剂.催化实验结果表明,随着金属盐浓度的增大,所制备的4种Pd50Co50纳米颗粒催化NaBH4制氢的活性数值分别为2700、3240、3120与2810 mol·mol-1·h-1,也就是说当金属盐离子浓度[Me2+]=0.88 mmol·L-1时,所制备的Pd50Co50纳米颗粒的催化活性最高.其原因可能如下:(1)当[Me2+]>0.88 mmol·L-1时,金属盐离子的浓度较高,单位体积中被还原出的金属纳米颗粒也较多,这些纳米颗粒在布朗运动与机械搅拌的作用下,相互间碰撞的几率也大,进而发生团聚及长大现象,使得最终制得的双金属纳米颗粒的粒径也较大,导致其具有较低的催化活性;(2)而当[Me2+]<0.88mmol·L1时,根据晶体成核-生长理论,11,12在还原剂加入后,金属盐离子先被还原成原子,原子相互之间碰撞生成晶核.由于低浓度溶液生成的晶核数量也较少,使得晶核的浓度难以在短时间内达到过饱和状态,进而使得纳米颗粒的成核过程、晶核与原子碰撞聚集长大的过程同时发生,因此所制得的纳米颗粒的粒径也较大,进而导致其催化NaBH4制氢活性也较差.
3.3 化学组成对Pd/Co双金属纳米颗粒催化性能的影响
由前面的实验结果可知,实验条件下制备双金属纳米颗粒的最佳PVP用量、NaBH4用量以及[Me2+]浓度分别如下:RPVP=40、RNaBH4=4、[Me2+]=0.88 mmol· L-1.根据这些条件,又采用快速注射NaBH4的方法制备了一系列化学组成不同的Pd/Co纳米颗粒催化剂.图2为Pd单金属纳米颗粒与部分双金属纳米颗粒的TEM照片及其粒度分布直方图.结果表明,Pd纳米颗粒的平均粒径为2.1 nm.Pd80Co20、Pd50Co50和Pd10Co90双金属纳米颗粒的平均粒径分别为1.5、2.7及2.1 nm,所制备的纳米颗粒粒度分布基本较窄,尺寸大小均匀.文献以及我们的研究结果都表明,采用NaBH4化学还原的方法很难合成粒径细小的Co单金属纳米颗粒,其平均粒径一般在几十个纳米左右.13-15图2的TEM结果表明所制备的Pd80Co20、Pd50Co50以及Pd10Co90纳米颗粒没有发现像单金属Co纳米颗粒那么大的颗粒,这说明实验所制备的纳米颗粒应该是双金属纳米颗粒,而不是Co和Pd单金属纳米颗粒的物理混合物.

图2 Pd(a)、Pd80Co20(b)、Pd50Co50(c)和Pd10Co90(d)纳米颗粒的TEM照片及粒度分布直方图(插图)Fig.2 TEM images and size distribution histograms(inset)of Pd(a),Pd80Co20(b),Pd50Co50(c),and Pd10Co90(d)nanoparticles
为了进一步表征所制备的纳米颗粒的结构,我们通过HR-TEM随机测定了4个Pd50Co50双金属纳米颗粒的晶面间距,结果如图3所示.图中颗粒1、2、3及4的晶面间距分别为0.218、0.218、0.217及0.218 nm,这些数据与Pd或Co单金属纳米颗粒的各个晶面的理论晶面间距值均不相同(表1),而是处于Co (111)晶面的理论晶面间距(0.2047 nm)和Pd(111)晶面的理论晶面间距(0.2246 nm)之间,这表明所制备的Pd/Co双金属纳米颗粒应该具有合金型结构.

表1 不同晶面指数的Pd和Co的理论晶面间距Table1 Theoretical lattice spacing of bulk Pd and Co with various reflection planes
由晶体的相关理论可知,面心立方结构的晶面间距计算公式(1)如下:

式中d为晶面间距(nm);(hkl)为晶面指数;a为晶格常数(nm).因此可以根据图3测定的晶面间距的数值计算出纳米颗粒1、2、3和4的晶格常数a分别为0.378、0.378、0.376和0.378 nm.
由于Pd、Co同属面心立方结构,可以认为其间形成连续的固溶体.连续固溶体的晶格常数符合线性叠加规律,因此理论上可以根据Pd和Co的理论晶格常数计算Pd50Co50合金的理论晶格常数,其计算过程如式(2)所示:

式中aPd50Co50为Pd50Co50合金的理论晶格常数,aPd及aCo分别为纯Pd及纯Co的理论晶格常数,其值分别为0.3890与0.3546 nm.式(2)的计算结果表明Pd50Co50合金的理论晶格常数应该为0.3718 nm,这与图5所测定的4个纳米颗粒的实际晶格常数也不相同,这说明所制备的纳米颗粒的组成与Pd50Co50的理论配比(50:50)并不严格相同.
为了从理论上计算所制备的Pd/Co双金属纳米颗粒的化学组成,我们假设所测定的4个纳米颗粒的化学组成为PdxCo1-x,以Pd和Co的理论晶格常数以及由图3测定的4个纳米颗粒的实际晶格常数为基础,并根据晶格常数线性累加计算公式(3)可计算出Pd/Co双金属纳米颗粒的实际化学组成.其计算过程如下:


图3 四个(Nos.1-4)Pd50Co50双金属纳米颗粒的HR-TEM照片Fig.3 High-resolution(HR)-TEM images of the four as-prepared Pd50Co50BNPs(Nos.1-4)
式中x为Pd在Pd/Co纳米颗粒中所占的原子含量(%),a为根据式(1)计算出的双金属纳米颗粒的实际晶格常数(nm),0.3890及0.3546分别为纯Pd和纯Co的论晶格常数(nm).变换(3)式则有

根据(4)式,可计算出纳米颗粒1、2、3及4中Pd原子的比例分别为68%、68%、62%及68%,进而可推算出该双金属纳米颗粒的实际化学组成分别为Pd67Co33、Pd67Co33、Pd62Co38及Pd67Co33.上述计算结果表明,实验所制备的合金双金属纳米颗粒的实际组成并不完全相同,也不严格遵循Pd/Co原子比为50/ 50的理论配比.
为了进一步证实所制备的催化剂为双金属纳米颗粒,我们又测定了Pd50Co50合金双金属纳米颗粒、Pd单金属纳米颗粒、Co单金属纳米颗粒及Pd与Co单金属纳米颗粒的物理混合物(1:1,原子比)的催化活性,实验结果如图4所示,该结果表明Pd50Co50双金属纳米颗粒的催化活性远高于Pd单金属纳米颗粒、Co单金属纳米颗粒及它们的物理混合物(Pd: Co原子比1:1)的活性.这进一步表明了所制备的Pd50Co50是双金属纳米颗粒,而不是由两种单金属纳米颗粒组成的物理混合物.

图4 Pd、Co、Pd50Co50金属纳米颗粒以及Pd和Co纳米颗粒的物理混合物(1:1,原子比)的催化活性对比Fig.4 Catalytic activity comparison of Pd and Co monometallic nanoparticles,and Pd50Co50bimetallic nanoparticles and a physical mixture of Pd monometallic nanoparticles and Co monometallic nanoparticles (1:1,atom ratio)
实验所制备的不同组分Pd/Co双金属纳米颗粒的NaBH4催化水解制氢活性结果如图5所示,结果表明,单位时间内双金属纳米颗粒的催化活性均高于单金属Pd和Co纳米颗粒的催化活性.其中Pd10Co90双金属纳米颗粒催化剂的催化活性最高,其值可达15570 mol·mol-1·h-1,是单金属Pd纳米颗粒催化活性的7倍.
Pd/Co双金属纳米颗粒优异的催化性能可归因于两个方面:(1)均匀分散效应,8Pd/Co双金属纳米颗粒的合金结构使得催化剂表面的Pd原子分散更加均匀,催化效果更好;(2)电荷转移效应,16,17在Pd/ Co双金属纳米颗粒中,Pd原子与Co原子相互作用并发生电荷转移,使得Pd原子带负电而Co原子带正电,这些带电的原子成为催化剂的活性中心.由于H2O中的H为+1价态,带负电的Pd原子可能优先与其相互作用,进而促进H2O中H―O键断裂. NaBH4中的H为-1价态,带正电的Co原子则可能优先与其相互作用并促使NaBH4中B―H键断裂.这两种作用形式的存在都加快了H2的产生.Pd/Co双金属纳米颗粒中的电荷转移效应示意图如图6所示.

图5 金属组成对Pd/Co双金属纳米颗粒催化NaBH4水解反应制氢影响Fig.5 Influence of metal compositions on hydrogen generation from the hydrolysis of NaBH4solution catalyzed by Pd/Co BNPs

图6 Pd/Co双金属纳米颗粒原子间电荷转移示意图Fig.6 Schematic illustration of electronic charge transfer effects in Pd/Co BNPs
为了证实Pd/Co双金属纳米颗粒中各原子确实带有电荷,我们采用密度泛函理论(DFT)对Pd/Co双金属纳米颗粒中原子的带电状态进行了研究.初步对由55个原子组成的Pd6Co49合金纳米颗粒中各个原子的带电状态进行了计算,结果如图7所示.计算结果表明,双金属纳米颗粒中Pd原子带负电,其电荷数为-0.111 a.u.,而Co原子则带正电,其电荷值为0.019及0.017 a.u..
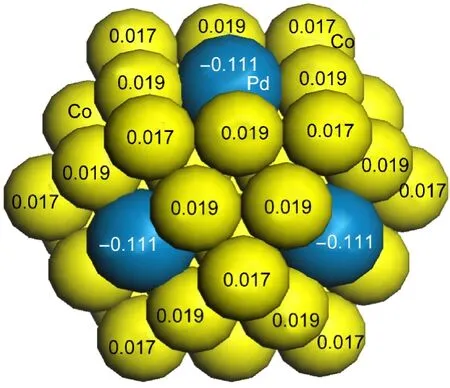
图7 Pd6Co49双金属纳米颗粒的电子结构的DFT计算Fig.7 DFT calculations of electronic structure of Pd6Co49BNPs
3.4 Pd/Co双金属纳米颗粒催化剂耐久性研究
要实现Pd/Co双金属纳米颗粒催化剂的工业应用,不但要求其具有高催化活性,还要求其具有很好的催化耐久性,满足催化剂多次重复使用的目的.为此,实验通过多次加入等量NaBH4碱性溶液的方法来测定Pd/Co双金属纳米颗粒的催化耐久性,实验结果如图8所示.由图中可看出,Pd/Co双金属纳米颗粒在5次重复试验后,其产氢量与产氢速率略有下降,但其催化活性依然很高.此外,我们还采用TEM对NaBH4催化水解制氢循环5次后的Pd10Co90双金属纳米颗粒的形貌进行了表征(图9).结果表明,即使5次催化放氢循环后,双金属纳米颗粒依然均匀分散,未发现明显的团聚现象.

图8 Pd10Co90纳米颗粒催化NaBH4水解制氢耐久性Fig.8 Long-term activity for hydrogen generation from hydrolysis reaction of NaBH4solution catalyzed by Pd10Co90nanoparticles
3.5 催化动力学研究
3.5.1 Pd/Co双金属纳米颗粒催化水解NaBH4的反应级数研究
为了研究NaBH4浓度对所制备的Pd/Co双金属纳米颗粒催化动力学的影响实验,保持催化剂用量为20 μmol、反应温度为30°C的条件不变,在NaBH4的浓度分别为20、30、40、50及60 mmol·L-1(其加入量均为10 mL)的条件下研究所制备的Pd10Co90双金属纳米颗粒的催化活性,实验结果如图10所示.结果表明,在其它因素相同的条件下,ln(v(H2))与ln(cNaBH4)间呈现出良好的线性关系,该直线的斜率为1.3,这表明Pd/Co双金属纳米颗粒催化NaBH4水解是关于NaBH4浓度的一级反应,该结果与Co-P-B催化剂催化水解NaBH4的结果是一致的.18

图9 Pd10Co90纳米颗粒催化NaBH4水解制氢循环五次后的TEM照片及粒度分布直方图(插图)Fig.9 TEM micrograph and size distribution histogram (inset)of used Pd10Co90nanoparticles for hydrogen generation from NaBH4solution after five cycles
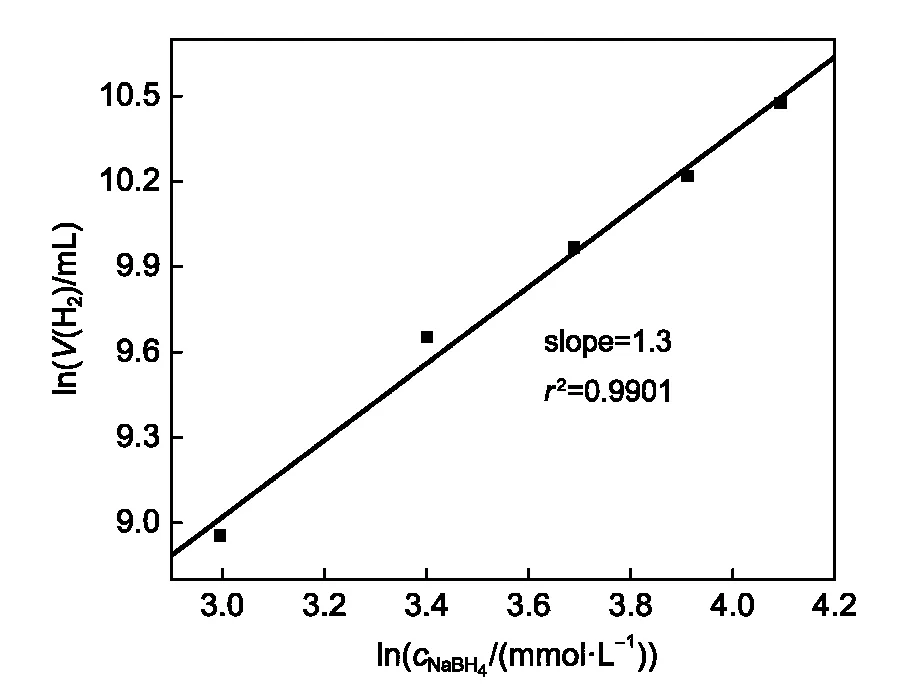
图10 NaBH4浓度对Pd10Co90双金属纳米颗粒催化NaBH4水解制氢活性的影响Fig.10 Influence of NaBH4concentrations on the hydrogen generation from the hydrolysis of NaBH4solution catalyzed by Pd10Co90nanoparticles
3.5.2 Pd/Co双金属纳米颗粒催化水解NaBH4的活化能研究
Pd10Co90双金属纳米颗粒催化水解NaBH4的速度常数(lnk)与反应温度倒数(l/T)之间的关系如图11所示,可以看出,实验条件下lnk与1/T间呈现出良好的线性关系.根据阿伦尼乌斯公式(lnk=lnAe-Ea/RT)可计算出在该催化剂的作用下NaBH4碱性溶液水解反应的表观活化能Ea=54 kJ·mol-1.Kaufman和Sen19用块状Co、Ni及雷尼Ni为催化剂催化NaBH4水解,其活化能分别为75、71和63 kJ·mol-1.这表明实验所制备的Pd/Co双金属纳米颗粒是一种性能更优异的催化剂.

图11 Pd10Co90双金属纳米颗粒催化NaBH4水解制氢的lnk与1/T之间的关系Fig.11 Linear fitting of lnk to 1/T of Pd10Co90BNPs for hydrogen generation from hydrolysis reaction of NaBH4solution
4 结论
采用化学共还原法制备了PVP保护的Pd/Co双金属纳米颗粒,研究了PVP用量、NaBH4还原剂用量、金属盐离子浓度以及化学组成对所制备的Pd/Co双金属纳米颗粒催化NaBH4水解反应活性的影响,并且还研究了所制备的金属纳米颗粒的催化耐久性与催化NaBH4水解反应的动力学,计算了催化反应的活化能,最终得出如下结论.
(1)在RPVP=40、RNaBH4=4及cMe2+=0.88 mmol·L-1的条件下,所制备的Pd10Co90双金属纳米颗粒催化NaBH4水解反应的催化活性最高,其值可达15570 mol·mol-1·h-1.
(2)所制备的Pd/Co双金属纳米颗粒平均粒径约为2.0 nm,即使5次重复使用后,该双金属纳米颗粒的粒径依然细小,无团聚现象发生,双金属纳米颗粒具有良好的催化耐久性.
(3)Pd/Co双金属纳米颗粒催化NaBH4的过程为NaBH4浓度的一级反应,其反应水解表观活化能为54 kJ·mol-1.
(4)密度泛函理论计算结果表明,Pd/Co双金属纳米颗粒优异的催化活性可归因于其中Pd原子与Co原子间的电荷转移效应.
(1) Akdim,O.;Demirci,U.B.;Miele,P.Int.J.Hydrog.Energy2011,36,13669.doi:10.1016/j.ijhydene.2011.07.125
(2) Guella,G.;Zanchetta,C.;Patton,B.;Miotello,A.J.Phys. Chem.B2006,110,17024.doi:10.1021/jp063362n
(3) Özkar,S.;Zahmakiran,M.J.Alloy.Compd.2005,404,728.
(4) Singh,S.K.;Xu,Q.Chem.Commun.2010,46,6545.doi: 10.1039/c0cc01879a
(5) Mu,X.D.;Evans,D.G.;Kou,Y.Catal.Lett.2004,97,151. doi:10.1023/B:CATL.0000038577.18441.bf
(6) Pushkarev,V.V.;An,K.;Alayoglu,S.;Beaumont,S.K.; Somorjai,G.A.J.Catal.2012,292,64.doi:10.1016/j. jcat.2012.04.022
(7) Wang,X.Y.;Ning,P.;Liu,H.L.;Ma,J.Appl.Catal.B: Environ.2010,94,55.doi:10.1016/j.apcatb.2009.10.020
(8) Zhang,H.J.;Watanabe,T.;Okumura,M.;Haruta,M.;Toshima, N.J.Catal.2013,305,7.doi:10.1016/j.jcat.2013.04.012
(9) Kong,D.C.;Gu,Y.J.;Xiang,S.;Wang,P.;Cheng,J.;Zhang, H.J.;Zhang,S.W.Chem.J.Chin.Univ.2013,34,2377.[孔德成,古亚军,向 胜,王 鹏,成 君,张海军,张少伟.高等学校化学学报,2013,34,2377.]
(10) Wang,Y.;Zhao,Y.;Yin,J.;Liu,M.C.;Dong,Q.;Su,Y.Q.Int.J.Hydrog.Energy2014,39,1325.
(11) Yoon,K.H.;Yong,S.C.;Dong,H.K.J.Mater.Sci.1998,33, 2977.doi:10.1023/A:1004310931643
(12) Wada,H.;Sakane,K.;Kitamura,T.;Hata,H.;Kambara,H.J.Mater.Sci.Lett.1991,10,1076.doi:10.1007/BF00720129
(13) Zhu,H.M.;Zhou,D.B.;Yu,H.Y.;Tang,C.;Xiong,F.J.Appl. Chem.Ind.2012,41,1757.[朱红梅,周德璧,于红英,唐超,熊凤姣.应用化工,2012,41,1757.]
(14) He,L.J.;Lin,X.P.;Wang,T.B.;Liu,C.Y.Acta Phys.Sin.2007,56,7158.[何丽静,林晓娉,王铁宝,刘春阳.物理学报,2007,56,7158.]
(15) Zhou,M.;Gong,J.;Si,P.Z.;Wang,X.Q.;Ge,H.L.J.Alloy. Compd.2014,584,222.doi:10.1016/j.jallcom.2013.09.050
(16) Zhang,H.J.;Watanabe,T.;Okumura,M.;Haruta,M.;Toshima, N.Nat.Mater.2012,11,49.
(17) Zhang,H.J.;Okumura,M.;Toshima,N.J.Phys.Chem.C2011,115,14883.doi:10.1021/jp203457f
(18) Patel,N;Fernandes,R.;Miotello,A.J.Power Sources2009,188,411.doi:10.1016/j.jpowsour.2008.11.121
(19) Kaufman,C.M.;Sen,B.J.Chem.Soc.Dalton Trans.1985,2, 307.
Preparation of Pd/Co Bimetallic Nanoparticles and Their Catalytic Activity for Hydrogen Generation
ZHAO Wan-Guo1,2SU Li1,2ZHOU Zhen-Ning1,2ZHANG Hai-Jun1,2,*LU Li-Lin3ZHANG Shao-Wei1,2
(1The State Key Laboratory of Refractory and Metallurgy,Wuhan University of Science and Technology,Wuhan 430081,P.R.China;2College of Materials and Metallurgy,Wuhan University of Science and Technology,Wuhan 430081,P.R.China;3College of Chemical Engineering and Technology,Wuhan University of Science and Technology,Wuhan 430081,P.R.China)
Reported here is a facile route for the synthesis of polyvinyl pyrrolidone(PVP)-stabilized Pd/Co bimetallic nanoparticles via a chemical co-reduction process.The effects of molar ratio of PVP and reducing reagent(NaBH4)to the total metal ions,and metal ion concentration and composition on the catalytic activity for hydrogen generation from NaBH4over Pd/Co bimetallic nanoparticles(BNPs)were studied.The transmission electron microscopy(TEM)results indicated that the prepared Pd/Co bimetallic nanoparticles,which had an average size of 1.5-2.8 nm,showed much higher catalytic activity than Pd and Co monometallic nanoparticles (MNPs).The highest catalytic activity of all the prepared bimetallic nanoparticles was 15570 mol·mol-1·h-1(the activity was normalized by the content of Pd in the BNPs),which was achieved with Pd/Co theoretical atom ratio of 1/9.The higher catalytic activity of the Pd/Co BNPs compared with the corresponding MNPs was ascribed to electronic charge transfer effects;this hypothesis was validated using density functional theory(DFT)calculations,which showed that the Pd atoms were indeed negatively charged,while the Co atoms were positively charged because of electron donation from the Co atoms to the Pd atoms.The positively charged Co atoms and negatively charged Pd atoms acted as catalytic active sites for the hydrolysis reaction of the alkaline NaBH4solution.Good catalytic stability was observed with the existing high catalytic activity,even after five runs of evaluating the catalytic activity.Moreover,no clear agglomeration was observed in the nanoparticle catalyst used.The corresponding apparent activation energy was determined as 54 kJ·mol-1,based on the kinetic study of the hydrogen generation achieved via the NaBH4hydrolysis over the PVP-protected Pd10Co90bimetallic nanoparticles.©Editorial office ofActa Physico-Chimica Sinica
Pd/Co;Bimetal nanoparticle;NaBH4;Catalytic hydrogen generation
O643.36
10.3866/PKU.WHXB201410241www.whxb.pku.edu.cn
Received:July 9,2014;Revised:October 23,2014;Published on Web:October 24,2014.
∗Corresponding author.Email:zhanghaijun@wust.edu;Tel:+86-15697181003.
The project was supported by the National Natural Science Foundation of China(51272188,51472184,51472185),National Key Basic Research
Program of China(973)(2014CB660802),Natural Science Foundation of Hubei Province,China(2013CFA086),and Foreign Cooperation Projects in Science and Technology of Hubei Province,China(2013BHE002).
国家自然科学基金(51272188,51472184,51472185)面上项目,国家重点基础研究发展规划项目(973)(2014CB660802),湖北省自然科学基金重点项目(2013CFA086)及湖北省科技支撑计划对外科技合作项目(2013BHE002)资助

