早产儿脑损伤与宫内感染引起细胞因子网络反应的临床研究
莫坤梅,黎远团,谢建红,陈雨彬,梁伯泉,陈忠其,邓 玲(佛冈县人民医院.儿科; .检验科; .病理科; .产科,广东 佛冈 511600)
早产儿脑损伤与宫内感染引起细胞因子网络反应的临床研究
莫坤梅a,黎远团a,谢建红a,陈雨彬a,梁伯泉b,陈忠其c,邓 玲d(佛冈县人民医院a.儿科; b.检验科; c.病理科; d.产科,广东 佛冈 511600)
目的 研究宫内感染与早产儿脑损伤的因果关系,从细胞因子网络反应角度探讨宫内感染早产儿脑损伤机制,为防治早产儿脑损伤提供新途径。方法 将100例早产儿根据头颅超声及CT检查结果分为早产脑损伤组(31例)和早产无脑损伤组(69例)。通过对2组胎膜、胎盘的病理检测(主要以检测绒毛膜羊膜炎为主),判断是否有宫内感染导致的早产儿脑损伤。采用酶联免疫吸附试验(ELISA)检测2组血清中细胞因子[IL-1β、IL-6、IL-10及肿瘤坏死因子(TNF-α)]的水平。结果 100例患儿中发生宫内感染40例,60例为非宫内感染,宫内感染患病率为40.0%。宫内感染患儿脑损伤的患病率为47.5%(19/40),非宫内感染患儿脑损伤的患病率为20.0%(12/60)。宫内感染患儿脑损伤患病率显著高于非宫内感染患儿(χ2=8.485,P<0.05)。早产脑损伤组IL-1β、IL-6、IL-10及TNF-α分别为(6.33±2.17)(8.20±4.10)(1.46±0.25)及(5.35±2.00)μg·L-1;早产无脑损伤组IL-1β、IL-6、IL-10及TNF-α分别为(1.44±1.01)(1.58±2.33)(1.65±0.30)及(3.57±1.33)μg·L-1。早产脑损伤组IL-1β、IL-6、TNF-α显著高于早产无脑损伤组,IL-10低于早产无脑损伤组(均P<0.05)。结论 早产儿脑损伤与宫内感染关系密切,细胞因子网络反应可能介导该损伤过程。
早产儿; 脑损伤; 宫内感染; 细胞因子
随着当代医学的飞速发展,早产儿的存活率越来越高,但早产儿脑损伤及其损伤后遗症,在严重影响患儿生活质量的同时,给社会及家庭也带来巨大负担。早产儿脑损伤已逐渐成为早产儿死亡的重要原因,是导致早产儿发生严重神经系统后遗症的主要危险因素[1]。出生体质量<1 500 g的早产儿5.0%~15.0%长大后遗留有严重的神经系统缺陷,其中约10.0%发生脑性瘫痪(CP),25.0%~50.0%表现为轻度神经发育障碍;脑损伤所致后遗症不仅累及运动系统,而且累及认知和行为,从而引起学习障碍[2]。有研究[3]表明,早产儿脑损伤除其自身脑部病理基础外,宫内感染后引起炎性细胞因子网络反应是导致早产儿脑损伤的主要原因。本研究主要是为了明确宫内感染与早产儿脑损伤的因果关系,从细胞因子网络反应角度探讨宫内感染早产儿脑损伤机制,为防治早产儿脑损伤提供新的途径。
1 对象与方法
1.1 研究对象
选择2011年6月至2013年6月在佛冈县人民
医院产科分娩的早产儿100例,男50例,女50例,均为单胎,出生体质量为2.0~3.1 kg。分娩孕周为28~36+6周,其中28~30周14例,31~33周65例,34~36+6周21例。自然分娩80例,臀位助产分娩2例,剖腹产18例。Apgar评分:8分35例,9分50例,10分15例。均排除:1)孕妇产前有妊娠合并症(子痫前期、妊娠期糖尿病、妊娠合并心脏病及胎盘早剥等);2)新生儿出生<12 h,有遗传代谢性疾病、神经系统畸形及其他系统严重畸形;3)围生期早产儿有窒息缺氧史。
早产儿出生3~7 d由专人经前、后囟进行头颅超声检查(探头频率为7.5~10.0 MHz),以后每隔l周复查1次,直至出院;对头颅B超正常、但疑有颅内病变者行头颅CT检查。根据头颅超声及CT检测结果将100例患儿分为早产脑损伤组(31例)和早产无脑损伤组(69例)。
2组日龄、性别、出生体质量、Apgar评分等比较差异均无统计学意义(均P>0.05),见表1。
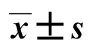
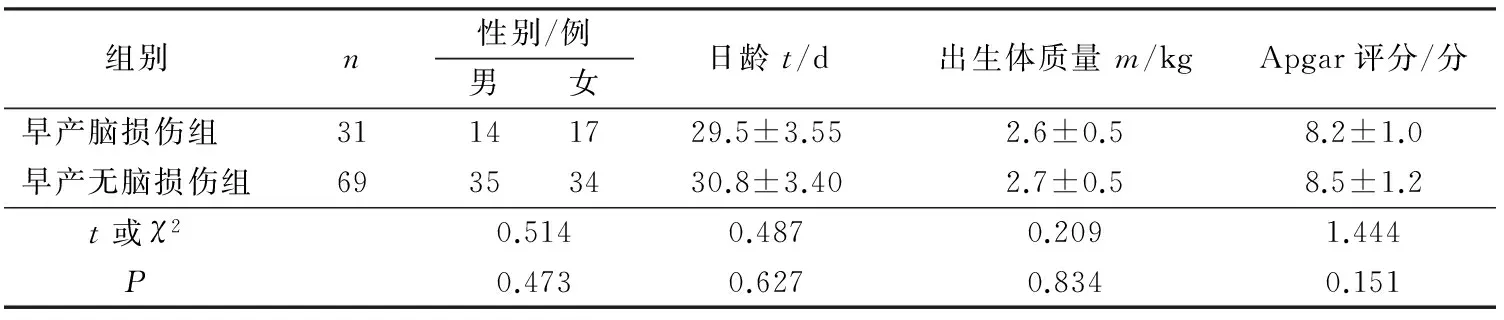
组别n性别/例男女日龄t/d出生体质量m/kgApgar评分/分早产脑损伤组 31141729.5±3.552.6±0.58.2±1.0早产无脑损伤组69353430.8±3.402.7±0.58.5±1.2t或χ20.5140.4870.2091.444P0.4730.6270.8340.151
1.2 方法
通过对产妇胎膜、胎盘的病理检测,判断是否存在宫内感染;行早产儿头颅超声及CT检测,确定是否有脑损伤;通过酶联免疫吸附试验检测细胞因子IL-1β、IL-6、IL-10及肿瘤坏死因子(TNF-α)等。
1.2.1 胎膜、胎盘的病理检测及诊断标准
产妇分娩后,及时进行胎膜、胎盘病理检测(主要以检测绒毛膜羊膜炎为主),判断是否有宫内感染。绒毛膜羊膜炎诊断标准[4]:在绒毛膜及羊膜组织中,显微镜下可见中性粒细胞浸润5~10个/HP为轻度,11~30个为中度,>30个为重度。临床诊断标准:如胎盘病理检测为绒毛膜羊膜炎,产妇发热,体温≥37.5 ℃,心率>100次·min-1,胎心率>160次·min-1,羊水臭味,子宫压痛,末梢血WBC>15×109L-1,可诊断为宫内感染[5]。
1.2.2 头颅超声检查
患儿在出生3~7 d后进行头颅超声检查,后每隔1周进行复查,超声检测正常但怀疑有病变者行CT检查。头颅超声检查早产儿脑损伤:1)生发基质-脑室内出血,脑室周围出血及梗死;2)脑室周围白质软化(PVL);3)其他部位的损伤,如蛛网膜下腔、小脑的出血、基底核及桥脑的变性或坏死等[6]。
1.2.3 脐带血细胞因子检测
新生儿娩出后未断脐带前,脐静脉穿刺抽取脐血6 mL,静置5 min后,以3 000 r·min-1的速度离心5 min, 收取上层血清液,低温(—70 ℃)保存,待检。采用酶联免疫吸附试验(ELISA)检测血清中细胞因子IL-1β、IL-6、IL-10及TNF-α水平。ELISA试剂盒购自博谷生物科技有限公司,严格按试剂盒说明书进行操作。
1.3 统计学方法
2 结果
2.1 胎膜、胎盘的病理检测
100例患儿中有40例患儿被诊断为宫内感染,60例患儿为非宫内感染。宫内感染患病率为40.0%。
2.2 2组患儿宫内感染发生率的比较
40例宫内感染患儿脑损伤的患病率为47.5%(19/40),60例非宫内感染患儿为20.0%(12/60)。宫内感染患儿脑损伤患病率显著高于非宫内感染患儿(χ2=8.485,P<0.05)。早产脑损伤组宫内感染发生率明显高于早产无脑损伤组(P<0.05)。见表2。
表2 2组宫内感染发生率的比较

组别n宫内感染非宫内感染例%例%早产脑损伤组311961.3*1238.7早产无脑损伤组692130.44869.6
*P<0.05与早产无脑损伤组比较。
2.3 2组细胞因子及TNF-α水平的比较
早产脑损伤组IL-1β、IL-6、TNF-α显著高于早产无脑损伤组,IL-10低于早产无脑损伤组,差异均有统计学意义(均P<0.05)。见表3。
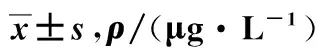
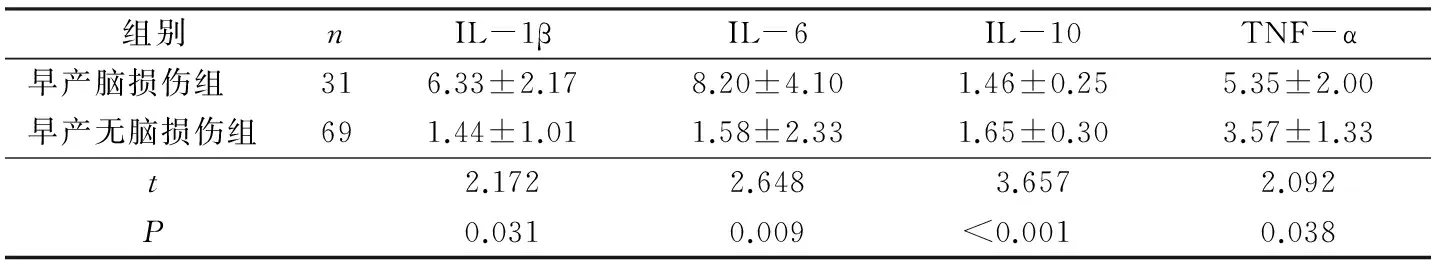
组别nIL-1βIL-6IL-10TNF-α早产脑损伤组316.33±2.178.20±4.101.46±0.255.35±2.00早产无脑损伤组691.44±1.011.58±2.331.65±0.303.57±1.33t2.1722.6483.6572.092P0.0310.009<0.0010.038
3 讨论
随着围产医学水平的提高,早产儿出生率也逐年提高,但如何提高早产儿的成活率及生存质量是当前关注的问题。新生儿重症监护病房(NICU)出现后,保暖箱、机械通气以及其他医疗技术的引进,使早产儿病死率显著降低。但根据国外大样本的研究资料[7]结果显示,早产儿脑损伤(内出血和脑白质损伤)发生率无明显降低。其中约10%患儿发生不同程度的脑性瘫痪(cerebral palsy,CP),25%~50%表现为轻度神经发育障碍,涉及到运动、认知和行为,从而引起学习障碍[8],严重的后遗症给患儿、家庭和社会带来严重负担。
目前认为,引起早产儿脑损伤的因素很多,发病机制复杂,尚不完全清楚。有研究[9]表明,早产儿脑损伤与早产儿脑血管发育不完善而导致的易损性增加、围产期窒息、缺氧缺血、宫内感染以及免疫学机制等有关,尤其是宫内感染后引起炎性细胞因子网络反应是导致早产儿脑损伤的主要原因。有研究[10]通过对怀孕大鼠体内注入脂多糖建立动物模型发现,宫内感染能导致仔鼠脑损伤,表明脑损伤与宫内感染有密切的关系。
本研究以早产儿为研究对象,经胎膜、胎盘病理检测,100例患儿中,40例被诊断为宫内感染,宫内感染患病率为40.0%;行头颅超声检查,31例被诊断为脑损伤(早产脑损伤组),患病率为31.0%,其中19例宫内感染(61.3%)。宫内感染患儿脑损伤的患病率为47.5%(19/40),非宫内感染患儿脑损伤的患病率为20.0%(12/60)。宫内感染患儿脑损伤患病率显著高于非宫内感染患者(χ2=8.485,P<0.05)。结果提示,宫内感染患儿其患脑损伤概率明显增加,表明宫内感染与脑损伤关系密切。但宫内感染导致脑损伤的机制尚未完全明确。由于宫内感染时蜕膜、胎盘或羊水,以及局部和循环中有较高水平的炎性因子,因此被认为与胎膜早破和早产密切相关[11]。
本研究对2组患儿采用ELISA法检测脐静脉血血清中细胞因子水平,结果显示:早产脑损伤组IL-1β、IL-6、TNF-α显著高于早产无脑损伤组,IL-10低于早产无脑损伤组(均P<0.05)。提示细胞因子反应网络在早产儿脑损伤的形成机制中产生了重要作用。可能是由于孕妇宫内感染后,激活机体产生大量炎性因子,脐血中与此相关的IL-1β、IL-6、TNF-α水平明显增高,并造成早产儿脑损伤;同时作为抗炎分子的IL-10水平显著降低,炎症保护作用减弱,亦可能是早产儿脑损伤的机制之一。
综上所述,本研究提示产妇宫内感染与早产儿脑损伤有较为显著的关系,细胞因子网络反应可能是早产儿脑损伤的重要机制。同时提示:可从抗细胞因子药物着手进行干预,为防治早产儿脑损伤提供新的途径,具有良好的科学价值以及社会效益。
[1] 陈慧金,范秀芳,高喜容,等.6家医院147例脑损伤早产儿的多中心随访报告[J].中国当代儿科杂志,2009,11(3):166-172.
[2] 中华医学会儿科学分会新生儿学组.早产儿脑室周围-脑室内出血与脑室周围白质软化的诊断建议[J].中华儿科杂志,2007,45(1):34-36.
[3] 史学凯,农绍汉,高平明,等.胎盘组织炎症对早产儿脑室内出血发病风险的影响[J].中国新生儿杂志,2010,25(3):139-141.
[4] Peled E,Eidelman M,Katzman A,et al.Neonatal incidence of hip dysplasia:ten years of experience[J].Clin Orthop Relat Res,2008,466(4):771-775.
[5] Morin C,Zouaoui S,Delvalle Fayada A,et al.Ultrasound assessment of the acetabulum in the infant hip[J].Acta Orthop Belg,2013,65(3):261-265.
[6] 陈惠金.新生儿缺氧缺血性脑损伤和颅内出血的B超诊断[J].中华妇幼临床医学杂志,2005,1(1):10-12.
[7] Herber Jonat S,Schulze A,Kribs A,et al.Survival and major neonatal complications in infants born between 22 0/7 and 24 6/7 weeks of gestation(1999—2003)[J].Am J Obstet Gynecol,2006,195(1):16-22.
[8] De Vries L S,van Haastert I C,Rademaker K J,et al.Ultrasound abnormalities preceding cerebral palsy in high-risk preterm infants[J].Pediatr,2004,144(6):815-820.[9] 姚裕家.早产儿脑损伤的病因及病理生理机制[J].临床儿科杂志,2009,24(3):16-18.
[10] [刘艳,徐三清,丰利芳,等.宫内感染导致脑损伤幼鼠脑组织核因子-κB、肿瘤坏死因子-α表达的变化[J].实用医学杂志,2010,26(23):4319-4322.
[12] Ennen C S,Huisman T A,Savage W J,et al.Glial fibrillary acidic protein as a biomarker for neonatal hypoxic-ischemic encephalopathy treated with whole-body cooling[J].Am J Obstet Gynecol,2011,205(3):251-257.
(责任编辑:周丽萍)
Premature Brain Damage and Intrauterine Infection Cause Cytokine Network Response
MO Kun-meia,LI Yuan-tuana,XIE Jian-honga,CHEN Yu-bina,LIANG Bo-quanb,CHEN Zhong-qic,DENG Lingd(a.DepartmentofPediatrics; b.DepartmentofClinicalLaboratories; c.DepartmentofPathology; d.DepartmentofObstetrics,FogangPeople’sHospital,Fogang511600,China)
Objective To explore the causality relationship between intrauterine infection and brain damage in premature infants,to observe the mechanism of brain damage in premature infants with intrauterine infection from the perspective of cytokine network response,and to provide a new way of preventing premature brain damage.Methods According to head ultrasound and CT results,100 premature infants were divided into brain damage group(n=31) and non-brain damage group(n=69).Intrauterine infection-induced premature brain damage was observed through pathological examinations of fetal membranes and placenta(mainly chorioamnionitis).In addition,serum levels of cytokines interleukin-1β(IL-1β),interleukin-6(IL-6),interleukin-10(IL-10) and tumor necrosis factor-α(TNF-α) were detected by ELISA.Results The prevalence of intrauterine infection was 40.0%(40/100).The incidence of brain damage in infants with intrauterine infection(47.5%,19/40) was significantly higher than that in infants without intrauterine infection(20.0%,12/60)(χ2=8.485,P<0.05).Moreover,infants with brain damage had higher levels of IL-1β,IL-6 and TNF-α and lower levels of IL-10 than infants with non-brain damage((6.33±2.17),(8.20±4.10),(1.46±0.25) and(5.35±2.00)μg·L-1vs(1.44±1.01),(1.58±2.33),(1.65±0.30) and(3.57±1.33)μg·L-1,respectively;P<0.05).Conclusion Premature brain damage is positively associated with intrauterine infection,and the cytokine network response may mediate the damage process.
preterm infants; brain damage; intrauterine infection; cytokine
2014-12-19
清远市科技项目(2009B067)
莫坤梅(1979—),女,学士,主治医师 主要从事新生儿重症监护的研究。
R722
A
1009-8194(2015)09-0050-04
10.13764/j.cnki.lcsy.2015.09.022

