淫羊藿苷对实验性自身免疫性脑脊髓炎小鼠的治疗作用
古玉梅,徐长青,洪铭范,邓雪梅,彭忠兴,余青云,危智盛
药理学
淫羊藿苷对实验性自身免疫性脑脊髓炎小鼠的治疗作用
古玉梅,徐长青,洪铭范,邓雪梅,彭忠兴,余青云,危智盛
(广东药学院附属第一医院神经内科,广东广州510080)
目的探讨淫羊藿苷(ICA)对实验性自身免疫性脑脊髓炎(EAE)小鼠的治疗作用,及其对血清转化生长因子-β(TGF-β)、内源性雌激素(E2)水平的影响。方法构建EAE小鼠模型,按评分相当原则将EAE小鼠随机分为雌激素组、高、中、低剂量ICA组、ICA+ICI组、模型组和正常对照组,观察给药前后以及治疗后各组间小鼠体质量、神经功能评分变化及血清E2、TGF-β水平的差异。结果雌激素组和高剂量ICA组小鼠体质量明显增加,神经功能评分明显改善,与模型组比较差异有统计学意义(P<0.05);与各ICA治疗组比较,ICA+ICI组未见改善(P<0.05)。高剂量ICA组E2水平较模型组明显升高(P<0.05);雌激素组和高剂量ICA组血清TGF-β水平与模型组比较明显增高(P<0.05);与高、中剂量ICA组比较,ICA+ICI组E2水平、TGFβ水平均下降明显(P<0.05)。结论ICA具有拟雌激素样作用,并可通过增加E2及血清TGF-β水平,达到改善EAE小鼠体质量下降及神经损害的作用。
自身免疫性脑脊髓炎;淫羊藿苷;雌激素;转化生长因子-β
多发性硬化(multiple sclerosis,MS)是以中枢神经系统白质脱髓鞘病变为主要病理特点的自身免疫性疾病。临床研究表明雌二醇治疗可使MS患者磁共振成像病变体积和数目显著减少,从而使病情得到缓解[1];动物实验也表明雌二醇可使MS模型实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠病情显著缓解,或病情不再加重,复发率减少[2]。采用雌激素治疗MS近年受到广泛关注,但因雌激素有诱发肿瘤的风险而存在争议。淫羊藿苷(icariin,ICA)是淫羊藿的主要活性成分之一,动物实验表明淫羊藿具有较强雌激素样作用,而ICA是其发挥雌激素活性的主要物质,可以模拟、干扰雌激素的生理生化作用[3-4]。本研究选用具有雌激素样作用的ICA,通过其对EAE小鼠模型的体质量变化、神经功能评分、转化生长因子-β(transforming growth factor-β,TGF-β)、内源性雌激素(estradiol,E2)水平的影响,探讨ICA对EAE小鼠的治疗作用,为ICA治疗MS的临床应用提供实验依据。
1 材料与方法
1.1 实验动物
选取60只SPF级C57BL/6雌性小鼠,7~9周龄,体质量16~22 g,购于广东省实验动物中心,生产许可证号SCXK(粤)2012-2015。饲养3 d后54只用于构建模型,6只作为正常对照组。
1.2 药品和试剂
髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG35-55)、百日咳毒素(ENZO公司);灭活结核分枝杆菌(美国Difco公司);多聚甲醛(上海生物工程有限公司);戊巴比妥钠(上海试剂一厂);不完全弗氏佐剂、淫羊藿苷、雌激素受体阻断剂ICI182,780(美国Sigma);己烯雌酚(上海阿拉丁公司);雌激素放免试剂盒、TGF-β ELISA试剂盒(上海瑶韵生物科技有限公司)。
用0.01 mol/L磷酸盐缓冲液(PBS)将MOG35-55稀释成质量浓度为600 μg/mL,然后加入等体积的完全弗氏佐剂(灭活结核分枝杆菌的终质量浓度为5 mg/mL)混合,用电动搅拌器充分搅拌乳化,直至乳化液滴入水中呈油包水状,制成抗原乳剂,放置于4℃冰箱保存并在12 h内用完。对小鼠进行称质量,然后按0.1 mL/20 g予以1%(φ)戊巴比妥钠腹腔注射麻醉,将抗原乳剂接种于小鼠脊柱两侧皮下(分为4个部位,每个部位50 μL),第7天再次注射等剂量MOG35-55/完全弗氏佐剂混合液加强免疫。同时于免疫后第0及48 h腹腔注射500 ng百日咳毒素。本组小鼠第9天开始发病,第12~13天神经功能损害达高峰。
1.4 分组与给药
造模过程中,密切观察小鼠的症状,进行称质量,并根据Becher[6]的标准对EAE小鼠进行神经损害程度评分。将评分1分以上的36只小鼠纳入实验,并按评分相当原则将其随机分为6组,每组6只:雌激素组,给予己烯雌酚0.2 mg/(kg·d)灌胃;高、中、低剂量ICA组,分别给予ICA 300 mg/(kg·d)、150 mg/(kg·d)、50 mg/(kg·d)灌胃;ICA+ICI组,给予ICA150 mg/(kg·d)灌胃加ICI182,780 1 mg/ (kg·d)皮下注射;模型组,给予等容量0.5%羧甲基纤维素钠灌胃;正常对照组,给予等容量0.5%羧甲基纤维素钠灌胃。造模前各组间神经损害程度评分差异无统计学意义。给药在造模后第13天小鼠发病高峰期开始,连续5 d。
1.5 观察指标
给药前后测定小鼠体质量、神经功能评分,并将小鼠处死取材。首先用1%戊巴比妥钠0.1 mL/20 g腹腔注射麻醉小鼠,采用眶静脉取血,放入EP管中室温下静置1 h,然后放入4℃的台式离心机中,12 000 r/min离心30 min,取上清液放入做好标记的EP管中,存放于-80℃冰箱中待检。按雌二醇试剂盒说明书采用放射免疫法检测血清中E2水平;按照TGF-βELISA试剂盒说明书的步骤测定血清中细胞因子TGF-β水平。
1.6 统计学方法
自身污染主要是指在水产养殖过程中因一些养殖行为造成的水污染。这些影响因素主要有苗种、肥料、鱼药、环境改良剂、粪便以及排泄物、底部沉积物等。具体来说:
2 结 果
2.1 小鼠体质量及神经功能评分变化
2.1.1 小鼠体质量变化 体质量变化比较,与造模前比,各组小鼠造模后均明显下降(P<0.05)。与模型组比,治疗后雌激素组和高剂量ICA组明显增加(P<0.05),中、低剂量ICA组及ICA+ICI组治疗前后差异无统计学意义(P>0.05)。ICA+ICI组较雌激素组及高、中剂量ICA组降低明显(P<0.05),而与低剂量ICA组比较差异无统计学意义(P>0.05)。见表1。
表1 各组小鼠在不同造模时间的体质量比较Table 1 Changes of mice weight in different groups(±s,n=6)

表1 各组小鼠在不同造模时间的体质量比较Table 1 Changes of mice weight in different groups(±s,n=6)
与造模前比较:△P<0.05;与治疗前比较:∗P<0.05;与模型组比较:#P<0.05;与ICA+ICI组比较:▲P<0.05。
组别 剂量/(mg·kg-1) 造模前/g 治疗前/g 治疗后/g正常对照组 - 16.3±0.12 16.6±0.11 16.8±0.12模型组 - 17.4±0.11 15.9±0.12△15.7±0.13雌激素组 0.2 17.3±0.12 15.8±0.12△17.8±0.11∗#▲高剂量ICA组 300 17.9±0.12 16.6±0.12△18.0±0.11∗#▲中剂量ICA组 150 17.3±0.12 15.2±0.11△15.7±0.13▲低剂量ICA组 50 17.8±0.11 15.4±0.13△15.6±0.12 ICA+ICI组 150,1.0 16.8±0.13 14.8±0.12△14.5±0.13
2.1.2 小鼠神经功能评分变化 小鼠神经功能评分比较,治疗后雌激素组及高剂量ICA组有改善(P<0.05),中、低剂量ICA组及ICA+ICI组差异无统计学意义(P>0.05)。治疗后各组与模型组比较,仅雌激素组和高剂量ICA组有明显改善(P<0.05);ICA+ICI组较雌激素组及高、中剂量ICA组明显增高(P<0.05),与低剂量ICA组比较差异无统计学意义(P>0.05)。见表2。
表2 各组小鼠治疗前后神经功能评分比较Table 2 Neurofuction deficiency in different groups(±s,n=6)

表2 各组小鼠治疗前后神经功能评分比较Table 2 Neurofuction deficiency in different groups(±s,n=6)
与治疗前比较:∗P<0.05;与模型组比较:△P<0.05;与ICA+ICI组比较:#P<0.05。
组别 剂量/ (mg·kg-1) 治疗前 治疗后正常对照组 - 0.0 0.0模型组 - 1.8±0.62 2.0±0.53雌激素组 0.2 2.0±0.21 0.5±0.13∗△#高剂量ICA组 300 2.5±0.21 1.5±0.14∗△#中剂量ICA组 150 2.0±0.16 1.6±0.23#低剂量ICA组 50 2.0±0.23 1.8±0.21 ICA+ICI组 150,1.0 2.0±0.14 2.3±0.32
2.2 小鼠血清中E2、TGF-β水平的变化
E2水平比较,与模型组比,高剂量ICA组水平明显升高(P<0.05),中、低剂量ICA组差异无统计学意义(P>0.05);ICA+ICI组较高、中剂量ICA组显著减低(P<0.05),与雌激素组、低剂量ICA组比差异无统计学意义(P>0.05)。TGF-β水平比较,各组均较正常对照组低(P<0.05);与模型组比,雌激素组、高剂量ICA组增高明显(P<0.05),与中、低剂量ICA组、ICA+ICI组比差异无统计学意义(P> 0.05);ICA+ICI组明显低于雌激素组和高、中剂量ICA组(P<0.05),与小剂量ICA组比差异无统计学意义(P>0.05)。见表3。
表3 各组小鼠血清中E2及TGF-β水平比较Table 3 Levels of serum estrogen and TGF-β in different groups(±s,n=6)
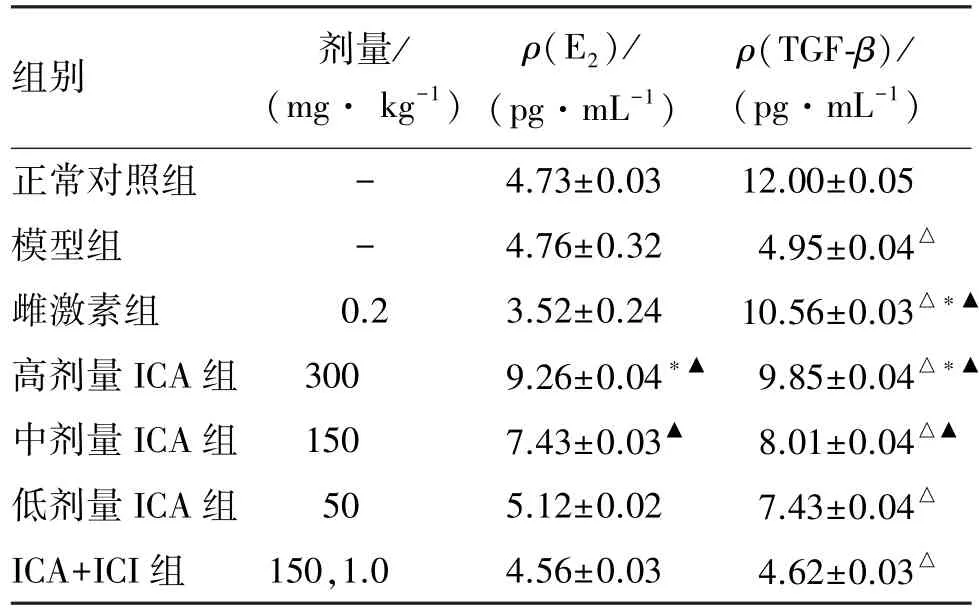
表3 各组小鼠血清中E2及TGF-β水平比较Table 3 Levels of serum estrogen and TGF-β in different groups(±s,n=6)
与正常对照组比较:△P<0.05;与模型组比较:∗P<0.05;与ICA+ICI组比较:▲P<0.05。
组别 剂量/ (mg·kg-1) ρ(E2)/ (pg·mL-1) ρ(TGF-β)/ (pg·mL-1)正常对照组 - 4.73±0.03 12.00±0.05模型组 - 4.76±0.32 4.95±0.04△雌激素组 0.2 3.52±0.24 10.56±0.03△∗▲高剂量ICA组 300 9.26±0.04∗▲9.85±0.04△∗▲中剂量ICA组 150 7.43±0.03▲8.01±0.04△▲低剂量ICA组 50 5.12±0.02 7.43±0.04△ICA+ICI组 150,1.0 4.56±0.03 4.62±0.03△
3 讨论
临床及动物实验均表明雌激素对MS或EAE具有保护作用。然而,大剂量或长期使用雌激素可能引发雌激素依赖性肿瘤、血栓性疾病、高血压、水肿等并发症。近年研究发现淫羊藿具有较强的雌激素活性[3-4],而ICA是淫羊藿发挥其雌激素活性的主要物质,具有雌激素样活性作用且较雌激素副作用少,同时还具有心脏保护、神经保护、抗炎、抗凋亡等作用,对神经变性疾病[7]、慢性炎症性疾病[8]、糖尿病[9]、骨质疏松[10]等均具有潜在的治疗作用。然而,ICA在MS或EAE方面的研究甚少,其对EAE的作用机制亦尚不清楚。
本研究对EAE小鼠治疗前后以及治疗后各组间体质量指标、神经功能评分进行比较,发现高剂量ICA与雌激素一样能改善EAE小鼠体质量下降及神经功能损害,但中、低剂量作用不显著;应用了雌激素受体拮抗剂ICI182,780后该疗效可被阻断,以上结果表明ICA可通过拟雌激素样作用途径而对EAE起治疗作用。本实验结果还发现高剂量ICA治疗组能明显增加血清E2水平。表明ICA可能同时通过促进E2的分泌而发挥作用。
目前,研究普遍认为MS患者外周血中调节性T细胞有功能障碍,其分泌的TGF-β减少,导致T、B细胞和巨噬细胞活化过度,上调黏附因子,破坏血脑屏障[11]。TGF-β参与机体的多种免疫反应[12-13]:抑制对IL-2依赖的T细胞增殖;抑制IL-2依赖的B细胞分泌IgM;抑制细胞因子TNF-α产生。TGF-β在治疗伤口愈合、通过免疫抑制治疗自身免疫性疾病和移植排斥反应方面有确切的作用[14]。本研究发现,雌激素和大剂量ICA能提高血清TGF-β水平,表明ICA可通过增加TGF-β水平发挥抗炎作用,而达到治疗EAE的作用。ICA+ICI组较ICA组明显减低,表明ICA升高TGF-β的作用可被雌激素受体拮抗剂ICI182,780所阻断。
综上所述,本研究证实了ICA具有拟雌激素样作用,可通过增加血清TGF-β水平,达到改善EAE小鼠体质量及神经损害的作用,且高剂量ICA组疗效较中、小剂量组显著。ICA对EAE治疗作用的机制十分复杂,其发挥神经保护、抗炎、抗凋亡等作用的具体机制有待进一步研究。
[1]STUVE O,YOUSSEF S,STEINMAN L,et al.Statins as potential therapeutic agents in neuroinflammatory disorders [J].Curr Opin Neurol,2003,16(3):393-401.
[2]NIINO M,HIROTANI M,FUKAZAWA T,et al.Estrogens as potential therapeutic agents in multiple sclerosis[J]. Cent Nerv Syst Agents Med Chem,2009,9(2):87-94.
[3]de NAEYER A,POCOCK V,MILLIGAN S,et al.Estrogenic activity ofa polyphenolic extractofthe leaves of Epimedium brevicornum[J].Fitoterapia,2005,76(1):35-40.
[4]LIU Jian,LOU Yijia.Determination of icariin and metabolites in ratserum by capillary zone electrophoresis: rat pharmacokinetic studies after administration of icariin[J]. J Pharm Biomed Anal,2004,36(2):365-370.
[5]MENDEL I,KERLERO D R N,BEN-NUN A.A myelin oligodendrocyte glycoprotein peptide induces typical chronic experimental autoimmune encephalomyelitis in H-2b mice: fine specificity and T cell receptor V beta expression of encephalitogenic T cells[J].Eur J Immunol,1995,25(7): 1951-1959.
[6]BECHER B,DURELL B G,NOELLE R J.Experimental autoimmune encephalitis and inflammation in the absence of interleukin-12[J].J Clin Invest,2002,110(4):493-497.
[7]ZHANG Lan,SHEN Cong,CHU Jin,et al.Icariin decreases the expression of APP and BACE-1 and reduces the betaamyloid burden in an APP transgenic mouse model of Alzheimer's disease[J].Int J Biol Sci,2014,10(2):181-191.
[8]WU Jinfeng,DU Juan,XU Chang,et al.In vivo and in vitro anti-inflammatory effects of a novel derivative of icariin[J]. Immunopharmacol Immunotoxicol,2011,138(1):49-54.
[9]QI Minyou,CHEN Kai,LIU Haoran,et al.Protective effect of Icariin on the early stage of experimental diabetic nephropathy induced by streptozotocin via modulating transforming growth factor beta1 and type IV collagen expression in rats[J].Immunopharmacol Immunotoxicol,2011,138(3):731-736.
[10]HSIEH T P,SHEU S Y,SUN J S,et al.Icariin isolated from Epimedium pubescens regulates osteoblasts anabolism through BMP-2,SMAD4,and Cbfa1 expression[J]. Phytomedicine,2010,17(6):414-423.
[11]HAAS J,HUG A,VIEHOVER A,et al.Reduced suppressive effect of CD4+CD25 high regulatory T cells on the T cell immune response against myelin oligodendrocyte glycoprotein in patients with multiple sclerosis[J].Eur J Immunol,2005,35(11):3343-3352.
[12]AKHURST R J,HATA A.Targeting the TGF beta signalling pathway in disease[J].Nat Rev Drug Discov,2012,11 (10):790-811.
[13]PARDALI E,TEN D P.TGF beta signaling and cardiovascular diseases[J].Int J Biol Sci,2012,8(2): 195-213.
(责任编辑:幸建华)
Therapeutic effect of icariin on the experimental autoimmune encephalomyelitis in mice
GU Yumei,XU Changqing,HONG Mingfan,DENG Xuemei,PENG Zhongxing,YU Qingyun,WEI Zhisheng
(The First Affiliated Hospital/Clinical Medical Colleges,Guangdong Pharmaceutical University,Guangzhou 510080,China)
ObjectiveTo study the therapeutic effect of icariin(ICA)on the experimental autoimmune encephalomyelitis(EAE)in mice and its influence on the levels of endogenous estrogen and TGF-β.MethodThe mouse EAE model was established,and divided into seven groups including the estrogen group,three different doses of ICA groups,the ICA with ICI group,the model group and the normal group. The mice weight,clinical symptom scoring,serum estrogen and TGF-β were examined.ResultsCompared with the model group,the mice weight and clinical symptom scoring were significantly improved in both estrogen and high dose of ICA groups.There was no obvious difference between the ICA and ICA with ICI groups.The levels of estrogen were increased in the high dose of ICA group in comparison with that of the model group.The levels of TGF-β were elevated in both estrogen and high dose of ICA groups.Compared with the middle and high groups,the levels of estrogen and TGF-β were decreased in the ICA with ICI group.ConclusionICA displays estrogen-like effect on treatment of EAE through enhancing of estrogen and TGF-β expression,and improving weight loss and nerve damage.
experimental autoimmune encephalomyelitis;icariin;estrogen;transforming growth factor-β
R285.5
:A
10.3969/j.issn.1006-8783.2015.05.013
1006-8783(2015)05-0617-04
2015-09-13
国家自然科学基金项目(44173001)
古玉梅(1985—),女,2013级研究生;通信作者:洪铭范(1963—),男,博士生导师,教授,主任医师,主要从事神经免疫性疾病、肝豆状核变性等研究,Email:hmf9001@163.com。
时间:2015-10-16 16:22
http://www.cnki.net/kcms/detail/44.1413.R.20151016.1622.004.html

